易基因:Nat Commun/IF15.7:多组学研究揭示UHRF2在原始生殖细胞DNA甲基化重编程中的抗性调控机制
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
近日,法国斯特拉斯堡大学Michael Weber团队通过多种实验方法揭示了原始生殖细胞(Primordial Germ Cells, PGCs)中DNA甲基化重编程的抗性机制,重点阐明了UHRF2在PGCs中维持特定DNA甲基化模式中的关键作用,并探讨了其对生殖细胞发育和功能的作用。研究结果表明,UHRF2在维持逆转录转座子甲基化、调节减数分裂基因表达和卵母细胞发育中发挥着重要作用。UHRF2缺失在雌性生殖细胞中导致减数分裂基因过表达和卵母细胞发育受损。相关研究成果以“UHRF2 mediates resistance to DNA methylation reprogramming in primordial germ cells“为题发表于《Nature Communications》期刊。

标题:UHRF2 mediates resistance to DNA methylation reprogramming in primordial germ cells(UHRF2介导原始生殖细胞对DNA甲基化重编程的抗性)
发表时间:2025年8月9日
发表期刊:Nature Communications
影响因子:IF15.7/Q1
技术平台:微量单细胞RRBS、RNA-seq、Target-BS等(易基因金牌技术)
DOI:10.1038/s41467-025-61954-0
哺乳动物的原始生殖细胞(PGCs)会经历全局性DNA去甲基化,但对生殖有关基因表现出延迟的去甲基化现象,并在进化上年轻的逆转录转座子区域选择性保留DNA甲基化。然而PGCs中DNA甲基化维持的分子机制尚不清楚。本研究首先揭示了DNMT1辅因子UHRF1的同源基因UHRF2是PGCs对DNA甲基化重编程抗性的关键调控因子。Uhrf2基因敲除小鼠的PGCs中表现出逆转录转座子DNA甲基化缺失,而体细胞中的DNA甲基化则不受影响。这与E13.5 PGCs中逆转录转座子表达变化无关,表明在这一阶段存在其他机制补偿逆转录转座子的调控。此外,Uhrf2缺失的PGCs表现出生殖有关基因的提前去甲基化,且在雌性中过表达减数分裂基因。随后,Uhrf2缺失的小鼠表现出卵母细胞发育受损、雌性特有的生育力降低以及在精子发生中逆转录转座子不完全再甲基化。这些发现揭示了UHRF1同源基因UHRF2在调控生殖谱系DNA甲基化中的关键功能。
易基因微量单细胞DNA甲基化技术案例展示
- Cell|易基因微量DNA甲基化测序助力中国科学家成功构建胚胎干细胞嵌合体猴,登上《细胞》封面
- Nature | 易基因DNA甲基化测序助力人多能干细胞向胚胎全能8细胞的人工诱导
- 项目文章|微量WGBS+ACE-seq揭示卵巢早衰的人卵丘细胞DNA甲基化与羟甲基化表观基因组图谱
- 项目文章:微量DNA甲基化分析揭示MeCP2在卵子发生和卵巢衰老中的表观遗传调控
研究方法
本研究通过多种实验方法,包括小鼠模型构建、微量单细胞DNA甲基化测序、流式细胞分选、RNA测序(RNA-seq)、免疫荧光实验、组织学分析和生殖能力测试,全面揭示了UHRF2在PGCs中维持特定DNA甲基化模式中的关键作用。这些方法的综合应用为理解PGCs中的表观遗传调控机制提供了重要的实验依据。
- 小鼠模型构建:UHRF2基因敲除(knock-out, KO)小鼠模型和Dnmt1条件性敲除(conditional knock-out, cKO)小鼠模型。
- 微量单细胞甲基化测序(RRBS):使用Oct4-GFP转基因小鼠模型,通过流式细胞分选(FACS)技术分离纯化的PGCs。分析E9.5到E17.5不同发育阶段的PGCs进行高深度测序,分析DNA甲基化动态变化。
- RNA测序(RNA-seq):从E8.5胚胎和E13.5 PGCs中提取总RNA,分析基因表达变化,特别是与DNA甲基化相关的基因表达。
- 免疫荧光实验:通过免疫荧光技术检测UHRF2蛋白在PGCs中的表达和定位。
- 组织学分析(Histology):对卵巢和睾丸进行组织学分析,观察UHRF2缺失对生殖细胞发育的作用。
- 生育能力测试:将UHRF2突变小鼠与野生型小鼠交配,观察后代数量,评估生育能力。
- 其他实验:LUMA检测整体CpG甲基化水平。Bisulfite测序分析特定基因启动子区域的甲基化状态。Western Blot检测UHRF2和UHRF1蛋白表达。
结果图形
(1)PGC发育过程中的DNA甲基化动态变化
研究通过RRBS技术,对小鼠PGCs从胚胎阶段E8.5到E17.5的DNA甲基化进行了全面分析。分析结果表明,与上胚层相比,PGCs在E9.5时低甲基化,且在E10.5到E13.5期间发生全局性去甲基化。雄性PGCs从E14.5开始恢复全局甲基化,而雌性PGCs则保持低甲基化状态。此外研究还发现,某些基因启动子区域的去甲基化速率比全基因组慢,表明这些区域甲基化具有延迟性。这些结果为理解PGCs中DNA甲基化的动态变化提供了重要数据。
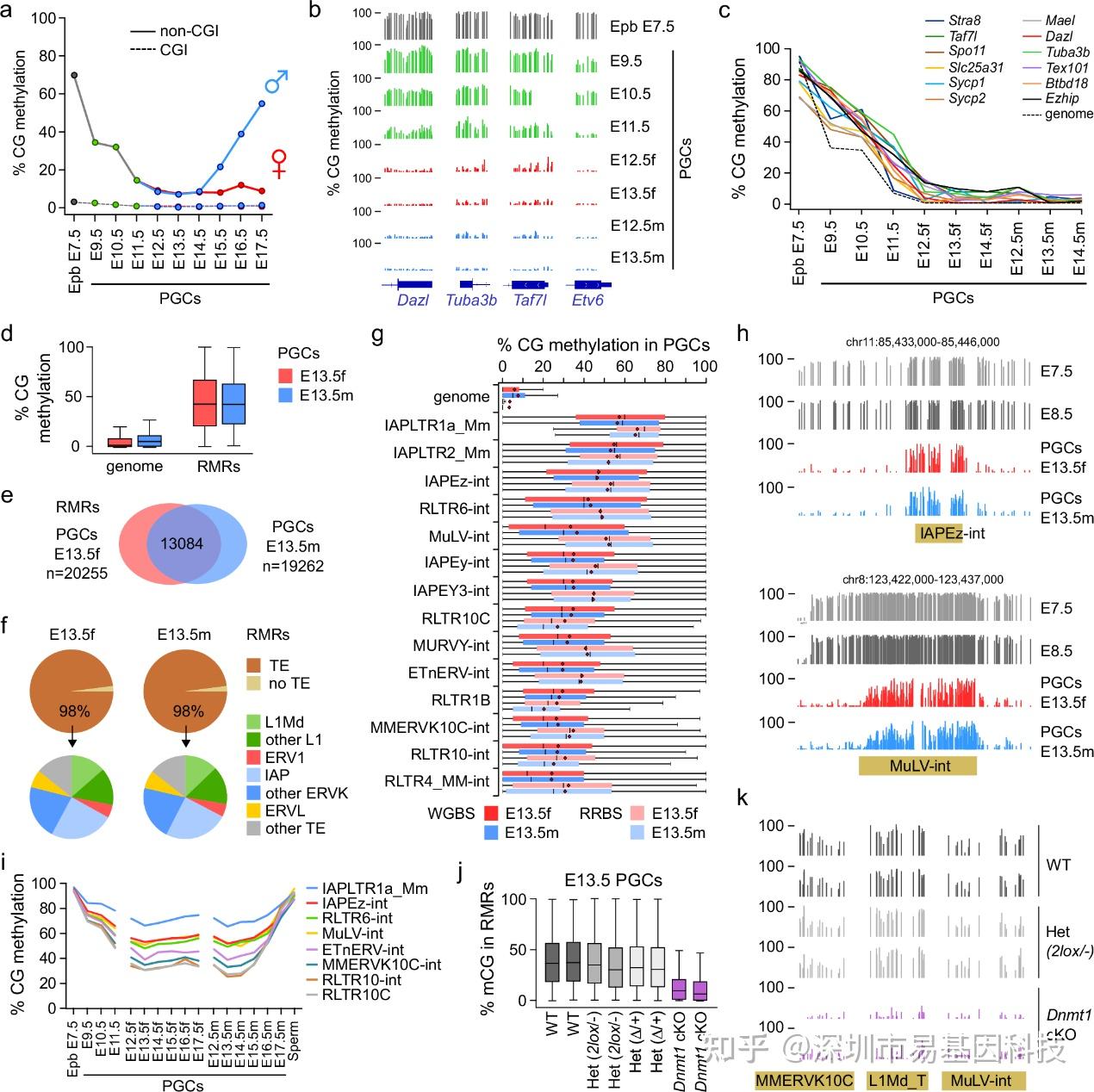
图 1:DNMT1介导PGCs中的选择性维持DNA甲基化
- RRBS检测E7.5上胚层(Epb)及PGC发育过程中的整体 CG 甲基化水平。样本平均覆盖的CpG位点数为CGI 的n=599,050 和non-CGI的n=560,437。
- 三个生殖有关基因(Dazl、Tuba3b、Taf7l)的CG富集启动子区域的RRBS甲基化图谱,以及Etv6 对照基因外显子序列的甲基化图谱。
- 与全基因组相比,PGCs 中生殖有关基因启动子区域去甲基化动态变化。全基因组包括上胚层中甲基化>50% 及E13.5 PGCs中甲基化< 20%的所有CG中位数甲基化水平。
- 与全基因组相比,雌性和雄性E13.5 PGCs 中残留甲基化区域(RMRs)内各CpG 位点甲基化水平(全基因组n=18,909,193个CpG位点,RMRs n=350,807个CpG位点)。
- 雌性和雄性E13.5 PGCs 中 RMRs 的重叠维恩图。
- RMRs 中不同转座元件(TE)家族的分布情况饼图。
- 与全基因组相比,E13.5 PGCs 中最高甲基化逆转录转座子家族的甲基化情况。箱线图显示在 WGBS或RRBS数据集中与每个逆转录转座子家族各拷贝重叠的各个 CpG 位点甲基化水平分布。平均而言,WGBS和RRBS数据集分别覆盖69%和12%的基因组拷贝数。
- E13.5 PGCs 中持续甲基化的逆转录转座子WGBS 甲基化图谱示例。
- 通过RRBS对PGC发育过程中最高甲基化的逆转录转座子家族CG甲基化水平进行定量分析。
- 与同窝对照(WT)相比,Dnmt1条件性敲除(cKO)E13.5 PGCs RMRs 内各个 CpG 位点的甲基化水平的箱线图(WT n=35024个CpG位点,WT n=33610个CpG 位点,杂合子Het n=32389个CpG位点,Het n=31170个CpG位点,Het n=26439个CpG位点,Het n=23172个CpG位点,cKO n=27940个CpG位点,cKO n=24732个CpG位点)。
- Dnmt1 条件性敲除和对照 E13.5 PGCs 中的逆转录转座子的 RRBS 甲基化图谱示例。
(2)PGC中逆转录转座子对DNA去甲基化的位点特异性抗性
通过分析E13.5 PGCs的全基因组数据,研究发现了20,255个和19,262个残留甲基化区域(Residually Methylated Regions, RMRs),这些区域在逆转录转座子中富集,尤其是年轻的LTR和非LTR逆转录转座子(如ERVK、ERV1和L1Md家族)。这些逆转录转座子在PGCs中表现出对去甲基化的抗性,其甲基化水平在PGCs发育过程中保持稳定。通过条件性敲除Dnmt1基因,进一步证实了DNMT1在维持这些逆转录转座子甲基化中的关键作用。
(3)UHRF2在PGCs中维持DNA甲基化不可或缺
研究发现,UHRF2在PGCs中高表达,且其蛋白主要定位于细胞核。通过UHRF2基因敲除小鼠模型,发现UHRF2缺失导致PGCs中逆转录转座子甲基化丢失,而体细胞中的DNA甲基化则不受影响。这表明UHRF2在PGCs中维持特定DNA甲基化模式中发挥着不可或缺的作用。
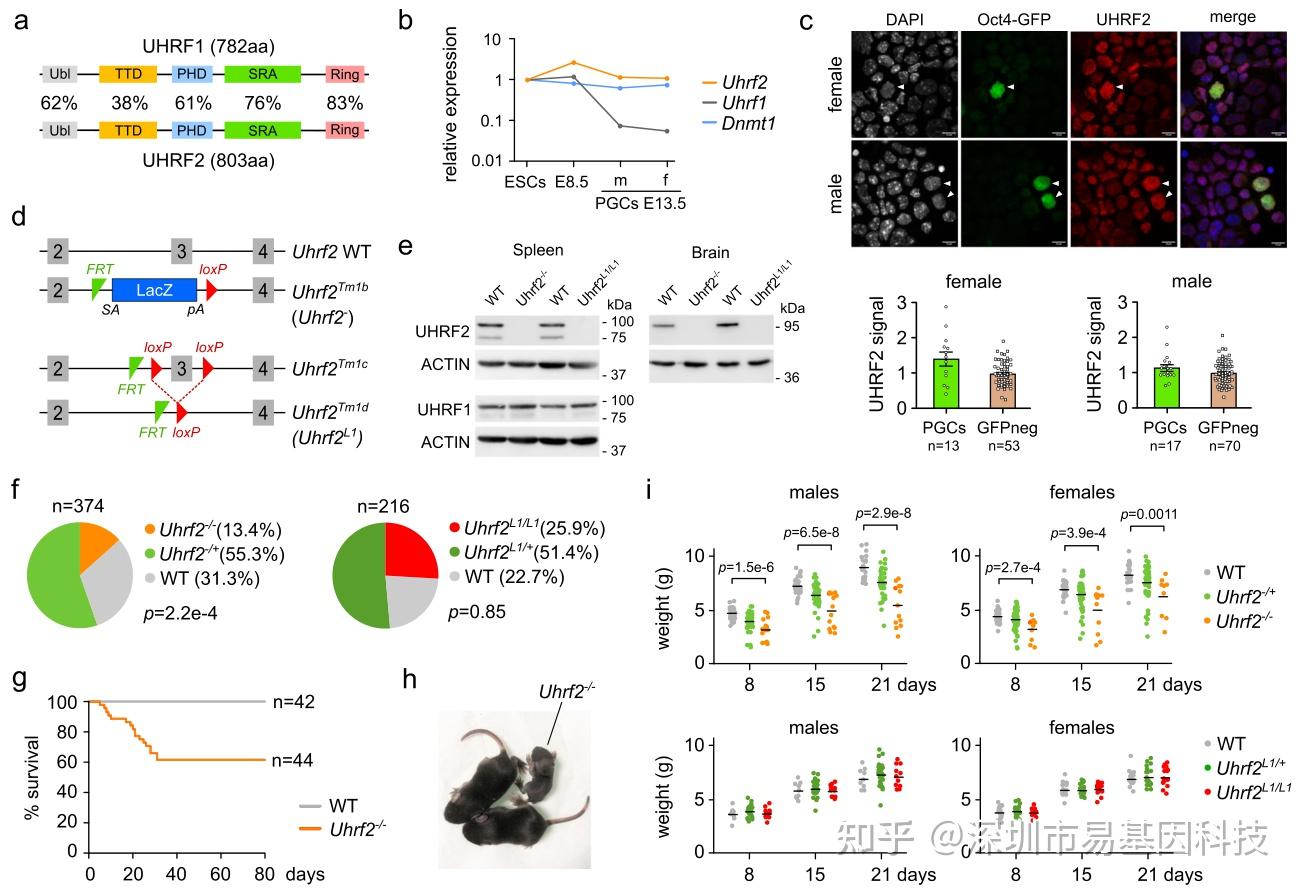
图2:Uhrf2在PGCs中的表达及Uhrf2基因敲除小鼠特征
- 小鼠UHRF1和UHRF2蛋白质结构。
- 通过RNA-seq检测Uhrf2、Uhrf1和Dnmt1基因在胚胎干细胞(ESCs)、E8.5胚胎以及雄性(m)和雌性(f)E13.5 PGCs中的表达。
- 在表达Oct4-GFP的E13.5雌性或雄性性腺细胞中,对UHRF2进行免疫荧光分析。
- 本研究中使用的Uhrf2基因敲除等位基因示意图。
- PND10 Uhrf2缺失小鼠和WT小鼠的脾脏和大脑中UHRF2和UHRF1蛋白Western blot分析。
- 通过Uhrf2-/+×Uhrf2-/+(左)或Uhrf2L1/+×Uhrf2L1/+(右)杂交得到的8日龄幼崽的基因型分布。
- Uhrf2与同窝野生型小鼠的产后存活曲线对比。
- 与同窝小鼠相比,PND10时Uhrf2-/-小鼠出现生长迟缓的情况。
- 与杂合子和野生型同窝小鼠相比,由Uhrf2杂合子父母交配得到的Uhrf2缺失小鼠(上)以及由 Uhrf2L1/+父母交配得到的 Uhrf2L1/L1 小鼠(下)体重对比。出生后第 8、15 和 21 天测量体重。
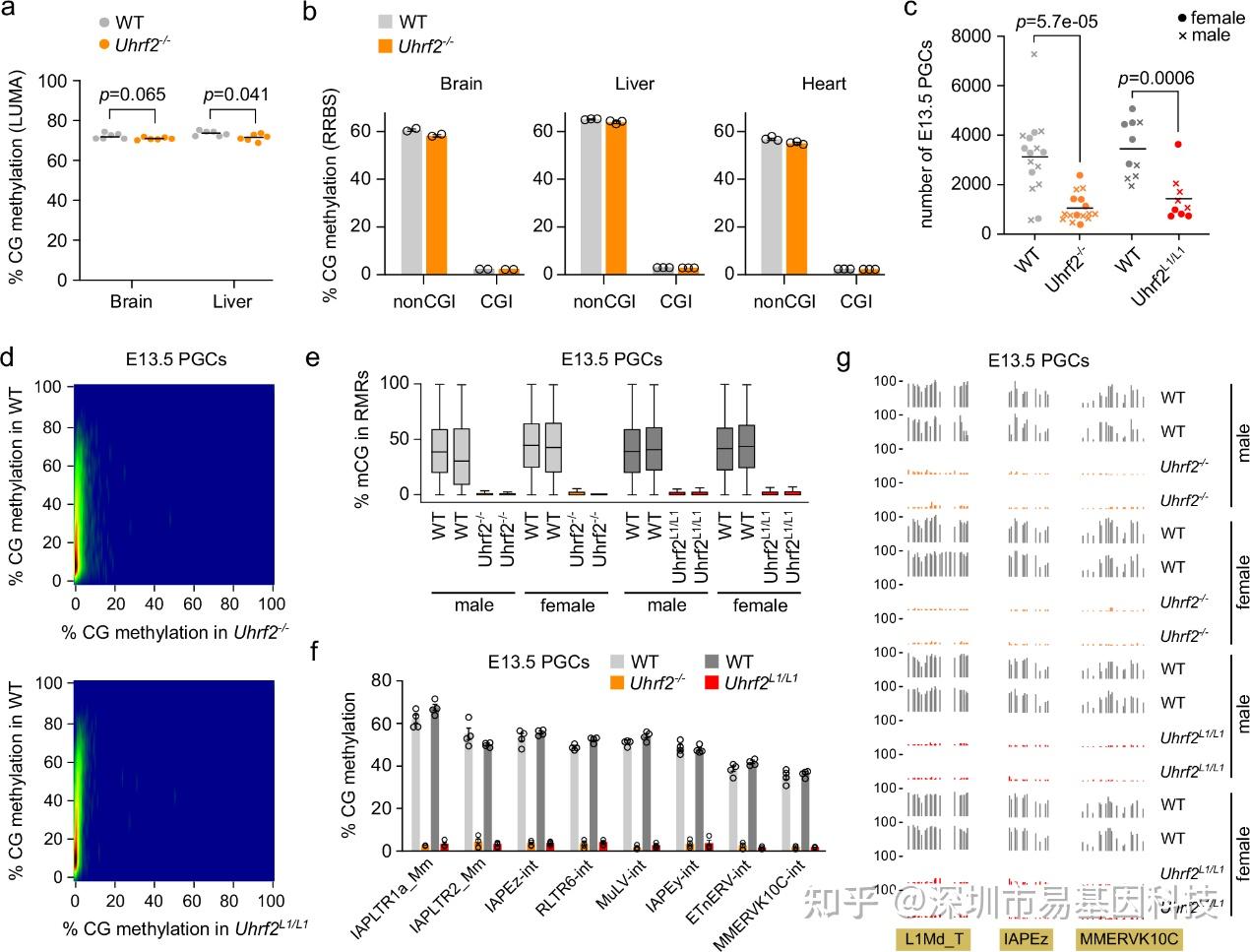
图3:Uhrf2对PGCs中的DNA甲基化至关重要,但对体细胞则不受影响
- LUMA检测的Uhrf2-/-小鼠与WT PND21小鼠大脑和肝脏中的整体CG甲基化水平。
- 通过RRBS对Uhrf2-/-小鼠与WT PND21小鼠的大脑、肝脏和心脏中的CG甲基化进行定量分析。分别显示了CpG岛外(non-CGI)和CpG岛内(CGI)的CG甲基化水平。
- 通过流式细胞术从Uhrf2突变小鼠与同窝WT E13.5胚胎的性腺中回收的PGCs数量(WT n=16个胚胎,Uhrf2-/- n=16,WT n=10,Uhrf2L1/L1n=9)。
- 将来自Uhrf2-/-和Uhrf2L1/L1小鼠的E13.5 PGCs与它们同窝WT胚胎进行比较RRBS CG甲基化评分在500bp窗口中的相关性。
- 与WT E13.5 PGCs相比,Uhrf2-/-和Uhrf2L1/L1小鼠中雄性和雌性PGCs内RMRs中各个CpG位点的甲基化水平箱线图。
- 与WT E13.5 PGCs相比,Uhrf2-/-和Uhrf2L1/L1小鼠中雄性和雌性PGCs中ERV家族的平均甲基化水平。
- Uhrf2突变和WT E13.5 PGCs中逆转录转座子的RRBS甲基化图谱示例。
(4)Uhrf2介导的DNA甲基化对于原始生殖细胞(PGCs)中逆转录转座子的抑制并非必需
尽管UHRF2缺失导致逆转录转座子的甲基化丢失,但RNA-seq分析结果揭示,其逆转录转座子表达并未显著增加。这表明在PGCs中,DNA甲基化可能不是抑制逆转录转座子的主要机制,其他表观遗传机制(如H3K9me3和H3K27me3)可能在维持逆转录转座子沉默中发挥补偿作用。
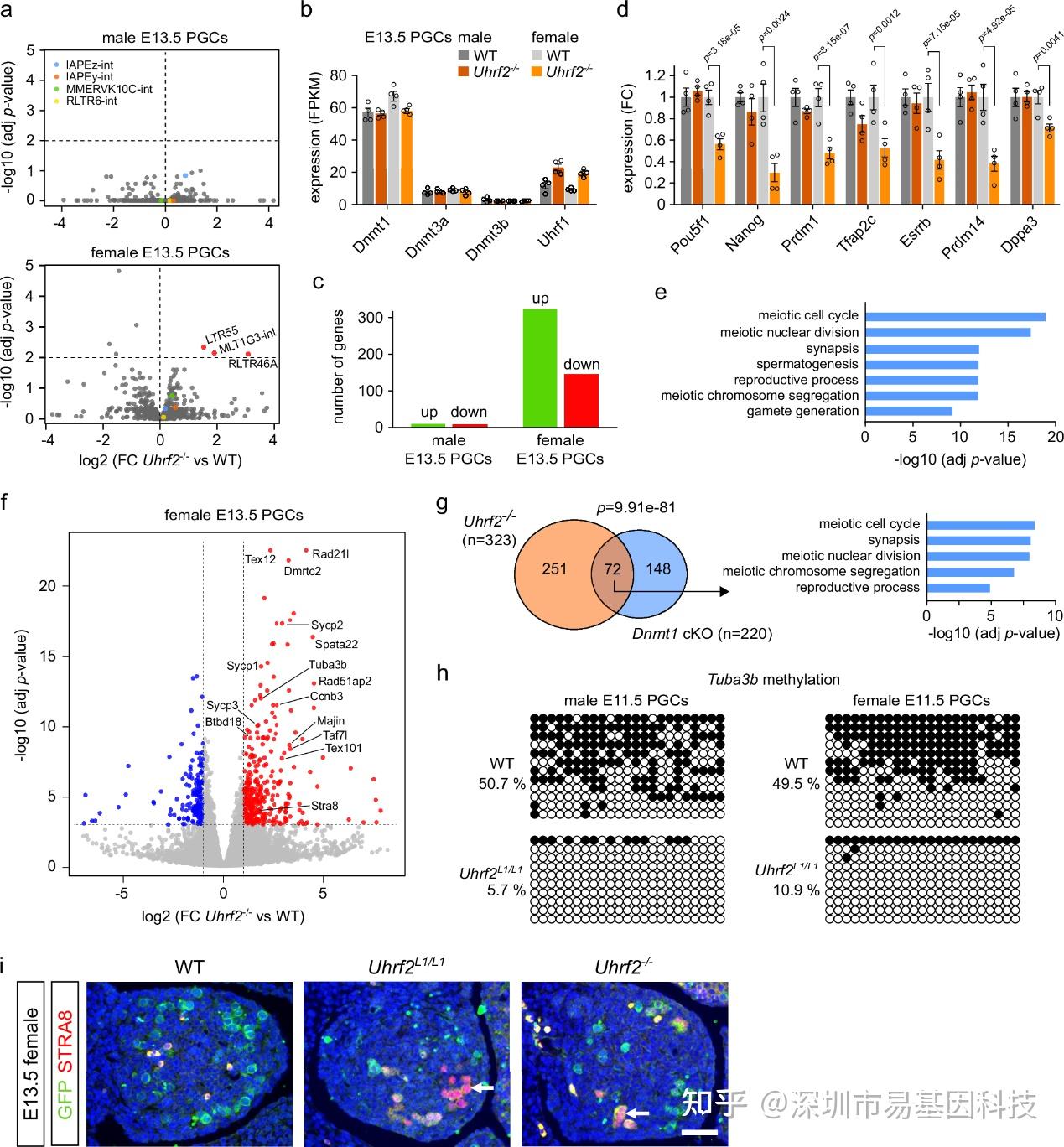
图4:Uhrf2失活导致E13.5 PGCs中减数分裂基因表达增加,但逆转录转座子表达未增加。
- 火山图显示在雄性和雌性Uhrf2-/- E13.5 PGCs中转座元件(TE)家族的差异表达。
- 与WT E13.5 PGCs相比,Uhrf2-/-中Dnmt和Uhrf1基因的FPKM表达值。
- 在雄性和雌性Uhrf2-/- E13.5 PGCs中鉴定出的显著上调和下调基因数量。
- 与WT E13.5 PGCs相比,Uhrf2-/-中多能性和生殖系身份调控因子的表达。图例与b相同。
- 在雌性Uhrf2-/- E13.5 PGCs中上调基因中显著富集的GO分析。
- 与WT E13.5 PGCs相比,雌性Uhrf2-/-的差异基因表达火山图。
- Uhrf2-/-和Dnmt1-cKO E13.5 PGCs中上调基因重叠的维恩图。
- Uhrf2L1/L1与WT E11.5 PGCs相比,Tuba3b启动子的目标区域亚硫酸盐测序分析。
- 通过免疫染色检测STRA8(红色核信号)来鉴定对照(WT)和突变E13.5胎儿卵巢切片中的减数分裂细胞。
(5)Uhrf2失活导致雌性PGCs中减数分裂基因过表达
RNA-seq分析显示,UHRF2缺失的雌性PGCs中,许多减数分裂相关基因(如Stra8、Sycp1等)表达显著上调。这些基因的过表达可能导致雌性PGCs提前进入减数分裂,进而影响卵子发育。免疫荧光实验进一步证实UHRF2缺失的雌性PGCs中出现了更多的减数分裂标志物阳性细胞。
(6)Uhrf2对卵母细胞发育的必要性
组织学分析显示,UHRF2缺失的雌性小鼠卵巢中原始卵泡数量减少,且在生育能力测试中,UHRF2缺失的雌性小鼠生育能力显著下降。这些结果表明,UHRF2在卵母细胞发育中发挥着关键作用。
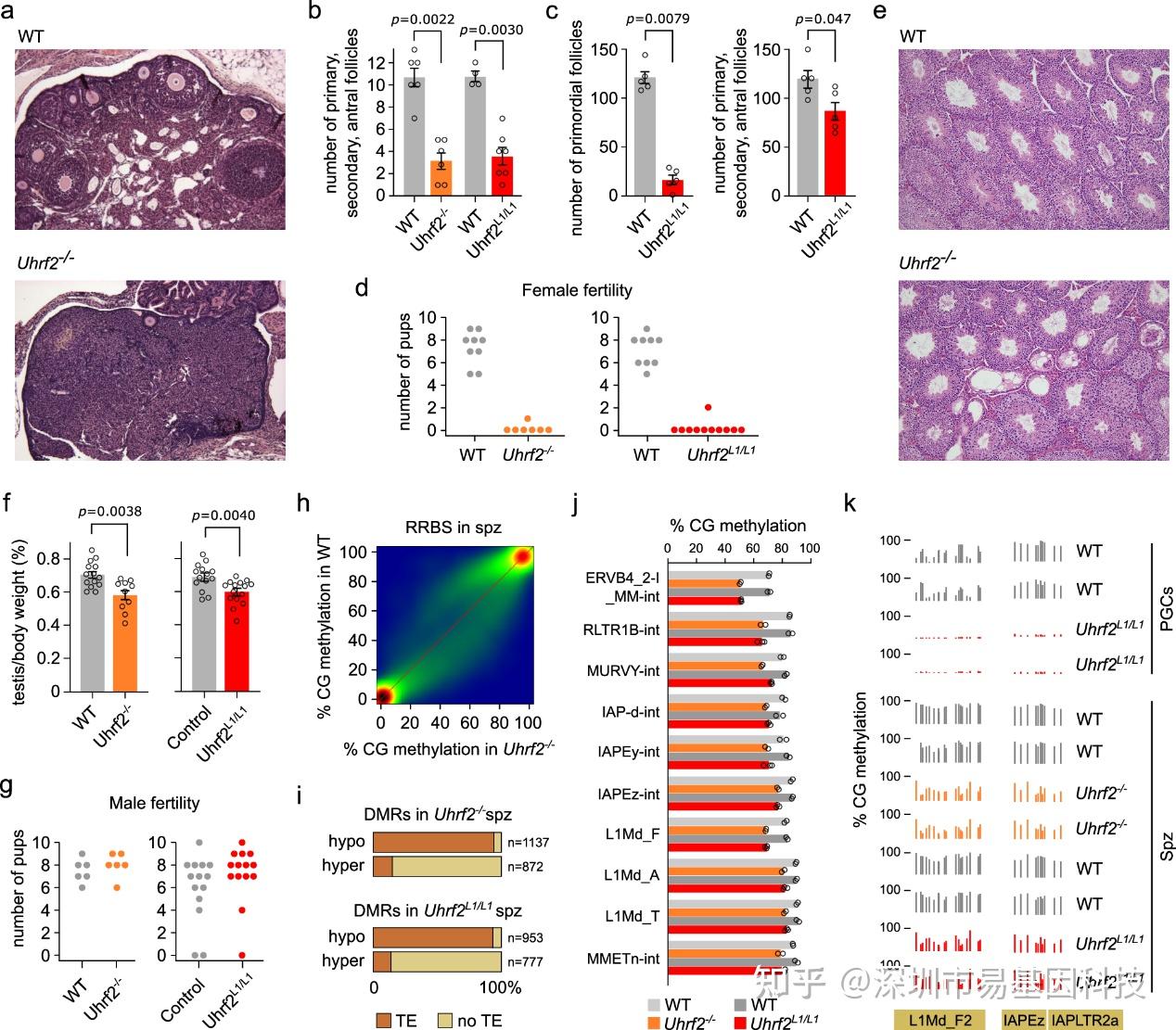
图5:Uhrf2失活会损害卵母细胞发育和精子发生过程中的逆转录转座子甲基化
- H&E染色的PND80时野生型(WT)和Uhrf2-/-雌性小鼠卵巢的组织切片。
- 在PND80的卵巢切片中,Uhrf2突变和WT同窝小鼠雌性的初级、次级和窦状卵泡的数量。
- 在PND15的卵巢连续切片中,Uhrf2L1/L1和WT同窝小鼠雌性的原始卵泡数量(左侧)以及初级、次级和窦状卵泡数量(右侧)。
- 与WT同窝对照组相比,Uhrf2缺失雌性小鼠所生的幼崽数量。
- 用H&E染色的PND80时野生型(WT)和Uhrf2-/-雄性小鼠睾丸的代表性组织切片。
- PND80时Uhrf2缺失雄性小鼠与其同窝对照组的睾丸与体重比。Uhrf2L1/L1雄性小鼠与WT和Uhrf2L1/+杂合子进行了比较。
- 与同窝对照组相比,Uhrf2缺失雄性小鼠交配所生的幼崽数量。
- 在Uhrf2-/-与WT精子中,500bp范围内RRBS CG甲基化评分的相关性。
- 在Uhrf2缺失精子中鉴定出的与转座元件(TEs)共定位的差异甲基化区域(DMRs)比例。
- 与WT精子相比,Uhrf2缺失精子中选定的ERV和L1家族的平均甲基化水平。
- 在Uhrf2缺失PGCs和精子中低甲基化的逆转录转座子序列的两个示例。
(7)Uhrf2 失活会损害精子发生过程中的逆转录转座子再甲基化
在雄性生殖细胞中,UHRF2缺失导致精子中逆转录转座子低甲基化。尽管如此,UHRF2缺失的雄性小鼠仍能产生功能正常的精子并保持生育能力。这表明UHRF2在精子发生过程中对逆转录转座子的再甲基化具有重要作用,但并非绝对必要。
讨论和启示
本研究揭示了UHRF2在PGCs中维持特定DNA甲基化模式中的关键作用。UHRF2可能通过与DNMT1协同,维持逆转录转座子的甲基化,防止潜在有害元件的激活。此外,UHRF2在调节减数分裂基因表达和卵子发育中也发挥重要作用。尽管UHRF2缺失对雄性生殖细胞的作用不明显,但在雌性生殖细胞中,UHRF2缺失导致减数分裂基因过表达和卵子发育损害。这些发现为理解PGCs中的表观遗传调控机制提供了新的见解,并为未来的研究提供了新的方向。
微量单细胞甲基化测序分析的作用
微量单细胞甲基化测序技术在本研究中发挥了重要作用。通过微量RRBS技术,研究者能够高分辨率地分析PGCs在不同发育阶段的DNA甲基化动态变化,揭示全基因组去甲基化和特定区域的甲基化抗性。这种技术不仅提供了详细的甲基化图谱,还帮助研究者发现了UHRF2在维持特定DNA甲基化模式中的关键作用。未来,微量单细胞甲基化测序技术有望在更多类似研究中应用,特别是在探索表观遗传调控机制和细胞命运决定中的研究和应用。
目前,易基因科技有限公司在DNA甲基化修饰等表观遗传检测领域,积累了一系列国际先进技术,可对高通量单细胞甲基化组学研究,微量DNA甲基化测序,ctDNA、FFPE等严重降解痕量DNA甲基化检测等,提供多种有效解决方案。低成本、高通量的单细胞甲基化组学测序技术建立,将为研究者对不同时间和空间的单细胞表观修饰研究奠定基础。
- 微量细胞或单细胞全基因组甲基化测序(Micro DNA-WGBS)DNA起始量:
单细胞/100-1000个细胞
1ng基因组DNA
90%以上基因组CG覆盖 - 微量细胞或DNA简化基因组甲基化测序(Micro DNA-RRBS)DNA起始量:
1ng基因组DNA;
10-20M有效CG位点覆盖;
10-20G测序数据量; - 微量cfDNA简化基因组甲基化测序(cfDNA-RBS)
100ul血浆或1ng cfDNA
10M有效CG位点覆盖
15-20G测序数据量
参考文献:
Bender A, Morel M, Dumas M, Klopfenstein M, Osmani N, Greenberg MVC, Bourc'his D, Ghyselinck NB, Weber M. UHRF2 mediates resistance to DNA methylation reprogramming in primordial germ cells. Nat Commun. 2025 Aug 9;16(1):7350. doi: 10.1038/s41467-025-61954-0.
相关阅读:
1. Cell|易基因微量DNA甲基化测序助力中国科学家成功构建胚胎干细胞嵌合体猴,登上《细胞》封面
2. Nature | 易基因DNA甲基化测序助力人多能干细胞向胚胎全能8细胞的人工诱导
3. 项目文章 | WGBS+RNA-seq揭示黄瓜作物的“源-库”关系受DNA甲基化调控
4. 项目文章 | WGBS等揭示SOX30甲基化在非梗阻性无精症中的表观遗传调控机制
5. 项目文章|WGBS+RNA-seq揭示PM2.5引起男性生殖障碍的DNA甲基化调控机制
6. 项目文章 | WGBS+RNA-seq揭示松材线虫JIII阶段形成过程中的DNA甲基化差异
7. 项目文章:微量DNA甲基化分析揭示MeCP2在卵子发生和卵巢衰老中的表观遗传调控
8. 项目文章 | 单细胞DNA甲基化与转录组分析揭示猪生发泡卵母细胞成熟的关键调控机制
9. 项目文章 | 植入前胚胎的全基因组DNA甲基化和转录组分析揭示水牛胚胎基因组激活进展
10. 项目文章:微量DNA甲基化分析揭示MeCP2在卵子发生和卵巢衰老中的表观遗传调控
11. 项目文章|微量WGBS+ACE-seq揭示卵巢早衰的人卵丘细胞DNA甲基化与羟甲基化表观基因组图谱
12. 项目文章:微量DNA甲基化分析揭示MeCP2在卵子发生和卵巢衰老中的表观遗传调控
13.技术推介|靶基因DNA甲基化测序(Target-BS)
14.表观技术 | 单细胞及微量细胞全基因组重亚硫酸盐甲基化测序(scWGBS)
DNA 5mC专题
