重组蛋白包涵体形成原因及解决方案
 重组蛋白的生产过程在生物制药和生物科研领域具有重要的应用。尽管基因工程技术的进步大大提高了重组蛋白的生产效率,但在某些情况下,重组蛋白在表达过程中会形成包涵体,影响其纯度、活性和后续的应用。这篇文章将从技术角度探讨重组蛋白包涵体的形成原因及常见的解决方案,为研究人员和相关行业从业者提供有价值的参考。
重组蛋白的生产过程在生物制药和生物科研领域具有重要的应用。尽管基因工程技术的进步大大提高了重组蛋白的生产效率,但在某些情况下,重组蛋白在表达过程中会形成包涵体,影响其纯度、活性和后续的应用。这篇文章将从技术角度探讨重组蛋白包涵体的形成原因及常见的解决方案,为研究人员和相关行业从业者提供有价值的参考。
一、重组蛋白包涵体的定义与形成机制
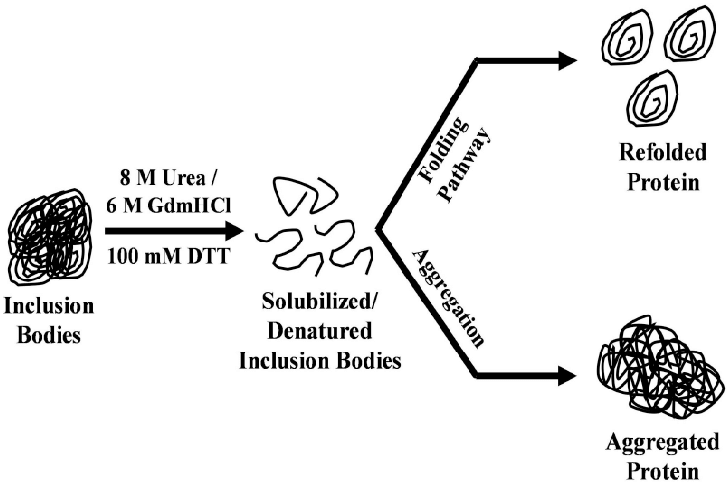
重组蛋白包涵体是指在细胞内,尤其是大肠杆菌(E. coli)等宿主细胞中,重组蛋白在过表达过程中形成的非溶解性颗粒。这些包涵体通常含有大量的蛋白质分子,但其大部分处于错误的折叠状态,无法正常发挥生物学功能。
1. 重组蛋白表达量过高
重组蛋白包涵体的主要形成原因之一是表达量过高。当细胞内的重组蛋白超出宿主细胞的表达和折叠能力时,蛋白质就无法及时正确折叠,进而形成包涵体。过度表达会导致蛋白质在细胞质中的积累,形成不溶性聚集物。尤其在大肠杆菌等原核宿主中,这一问题尤为突出,因为这些宿主缺乏复杂的分子伴侣系统,难以处理大量的重组蛋白。
2. 重组蛋白的折叠问题
蛋白质的折叠是一个复杂的过程,涉及到多种分子伴侣(如DnaK、GroEL等)以及正确的环境条件。在重组蛋白的合成过程中,如果没有合适的分子伴侣和折叠环境,重组蛋白容易形成错误折叠的结构,从而导致包涵体的形成。此外,某些蛋白质本身具有较为复杂的二级结构或特定的翻译后修饰需求,这些蛋白质在过量表达时更容易积聚成包涵体。
3. 培养条件的影响
培养温度、培养基成分、通气条件等也会影响重组蛋白的折叠与聚集。例如,在高温下表达时,蛋白质折叠速率可能超过分子伴侣的反应能力,导致折叠不完全并聚集成包涵体。此外,不适宜的培养基成分,尤其是缺乏必需的氨基酸或辅因子,也会影响蛋白质的正常折叠,从而促进包涵体的形成。
二、重组蛋白包涵体的解决方案
虽然包涵体的形成会给重组蛋白的生产带来挑战,但通过一定的技术手段和优化策略,研究人员可以有效地解决这一问题。以下是几种常见的解决方案。
1. 降低表达温度
降低重组蛋白的表达温度是防止包涵体形成的一种常见方法。在较低的温度下,蛋白质合成速率会减缓,分子伴侣有更多的时间帮助蛋白质正确折叠,从而减少错误折叠的风险。对于许多重组蛋白而言,降低表达温度(如16-25°C)通常能够显著降低包涵体的形成。
2. 优化宿主细胞的选择
选择适合的宿主细胞也是减少包涵体形成的有效方法。大肠杆菌是最常用的重组蛋白表达系统,但对于某些蛋白,尤其是那些需要复杂折叠的蛋白,大肠杆菌的分子伴侣系统可能不足以支持其正确折叠。在这种情况下,可以考虑使用其他宿主细胞,如酵母(Saccharomyces cerevisiae)、昆虫细胞(如Sf9细胞)或哺乳动物细胞。这些宿主通常具备更复杂的折叠和后期修饰能力,有助于减少包涵体的形成。
3. 添加分子伴侣或辅助因子
在表达过程中添加分子伴侣或辅助因子可以提高蛋白质的折叠效率,减少包涵体的形成。例如,GroEL/GroES复合物和DnaK分子伴侣系统可以帮助蛋白质在合成过程中正确折叠,减少误折叠和聚集。此外,一些化学试剂,如精氨酸或甘油等,也能够提高折叠效率,抑制包涵体的形成。
4. 调控诱导剂的浓度
许多重组蛋白的表达是通过使用诱导剂(如IPTG)来控制的。如果诱导剂浓度过高,可能会导致过量表达,进而形成包涵体。因此,适当控制诱导剂的浓度,确保蛋白质在细胞内以适当的速度合成,是避免包涵体形成的关键措施。一般来说,诱导剂浓度应在最低能够促进重组蛋白表达的范围内,避免过高的表达量。
5. 适当的溶解条件
如果包涵体已经形成,在提取过程中需要采取适当的溶解条件。通过优化溶解缓冲液的成分、pH和温度等,可以有效地溶解包涵体,恢复蛋白质的可溶性。常用的溶解剂包括尿素或硫脲等,能够有效破坏蛋白质聚集体并重新获得可溶性蛋白。之后,通过透析或其他纯化步骤去除溶解剂,恢复蛋白质的活性。
三、重组蛋白的相关产品及应用
在重组蛋白的生产过程中,解决包涵体问题不仅仅是提升蛋白质表达的效率,更能为后续的应用提供高质量的蛋白质。这些蛋白质广泛应用于生物制药、疫苗开发、抗体生产以及其他生命科学领域。以下是几种在重组蛋白生产中常用的产品类别:
重组酶:如重组DNA酶、重组RNA酶、重组胰蛋白酶等,广泛应用于基因工程、克隆实验等领域。
重组抗体:通过重组技术生产的单克隆抗体,广泛应用于免疫学研究、诊断试剂开发等。
重组疫苗:通过重组技术生产的抗原蛋白,用于疫苗的研发。
重组酶标试剂:用于各种生化分析、蛋白质检测等实验室操作。
重组激素:如人胰岛素、生长激素等,广泛应用于医学治疗和生物制剂领域。
四、结论
重组蛋白包涵体的形成是重组蛋白生产过程中的一个常见问题,但通过优化表达条件、选择合适的宿主系统以及添加分子伴侣等技术手段,可以有效减少包涵体的形成,确保重组蛋白的高质量表达。对于生物公司而言,掌握这些技术细节,不仅能提升重组蛋白生产的效率,还能确保其在科研和产业化应用中的可靠性。
参考文献
1.Walsh, G. (2018). Post-translational modifications of protein biopharmaceuticals. Nature Biotechnology, 36(10), 1069-1077.
2.Sharma, S. & Verma, S. (2017). Impact of temperature and pH on the formation of inclusion bodies in recombinant protein production. Applied Microbiology and Biotechnology, 101(5), 1895-1904.
3.Jang, H., et al. (2019). Improving the solubility of recombinant proteins in E. coli via optimized expression conditions. Biotechnology Advances, 37(1), 18-24.
4.Xu, X., et al. (2020). Strategies to enhance the yield of soluble recombinant proteins expressed in E. coli. FEMS Microbiology Letters, 367(3), fnaa052.
5.Banas, A., et al. (2015). Inclusion body formation in Escherichia coli: Strategies for prevention and solubilization. Journal of Biotechnology, 207, 22-31.
6.Garg, D., et al. (2019). Molecular chaperones in protein folding and inclusion body formation. Biochemical Society Transactions, 47(5), 1513-1523.
7.Hong, P., et al. (2016). Effect of molecular chaperones on inclusion body formation and protein aggregation in Escherichia coli. Journal of Molecular Biology, 428(1), 23-31.
