ChIP-seq
DNA与蛋白质的相互作用是细胞生命活动的核心,涉及基因表达、调控、DNA复制、修复以及RNA转运、翻译等关键过程。ChIP-seq(Chromatin Immunoprecipitation with highthroughput sequencing, 染色质免疫共沉淀高通量测序)是一种用来分析蛋白质与DNA交互作用的研究方法,它将染色质免疫沉淀和高通量测序技术结合,可de novo鉴定任意具有DNA结合活性的蛋白在体内的结合位点。
背景说明
目前的ChIP-seq研究主要包括两大类应用——TF ChIP和Histone ChIP。转录因子作为反式作用因子,与真核基因的顺式作用元件比如启动子、增强子等发生特异性相互作用,从而激活或者抑制基因的转录。ChIP-seq技术可以动态地捕捉到生物体内转录因子在基因启动子区等的结合情况和强度变化,是研究转录调控的有力武器。对于表观遗传学调控的主要方式之一组蛋白修饰,ChIP-seq技术可以获得组蛋白在染色体上的分布情况,从而确定组蛋白修饰相关的特定位点,还可以确定组蛋白修饰酶类的靶标。
该技术首先通过甲醛交联将DNA结合蛋白和DNA紧密固定,然后将细胞/组织破碎,提取细胞核,抽提染色质,并用超声波破碎或酶处理DNA至合适的长度。利用抗原抗体的特异性识别反应,将与目的蛋白相结合的DNA片段沉淀下来。Protein A/G磁珠拉取抗体-蛋白-DNA复合物。洗脱解交联、DNA纯化后,即可通过高通量测序的方法对与目的蛋白结合的DNA片段进行建库分析。
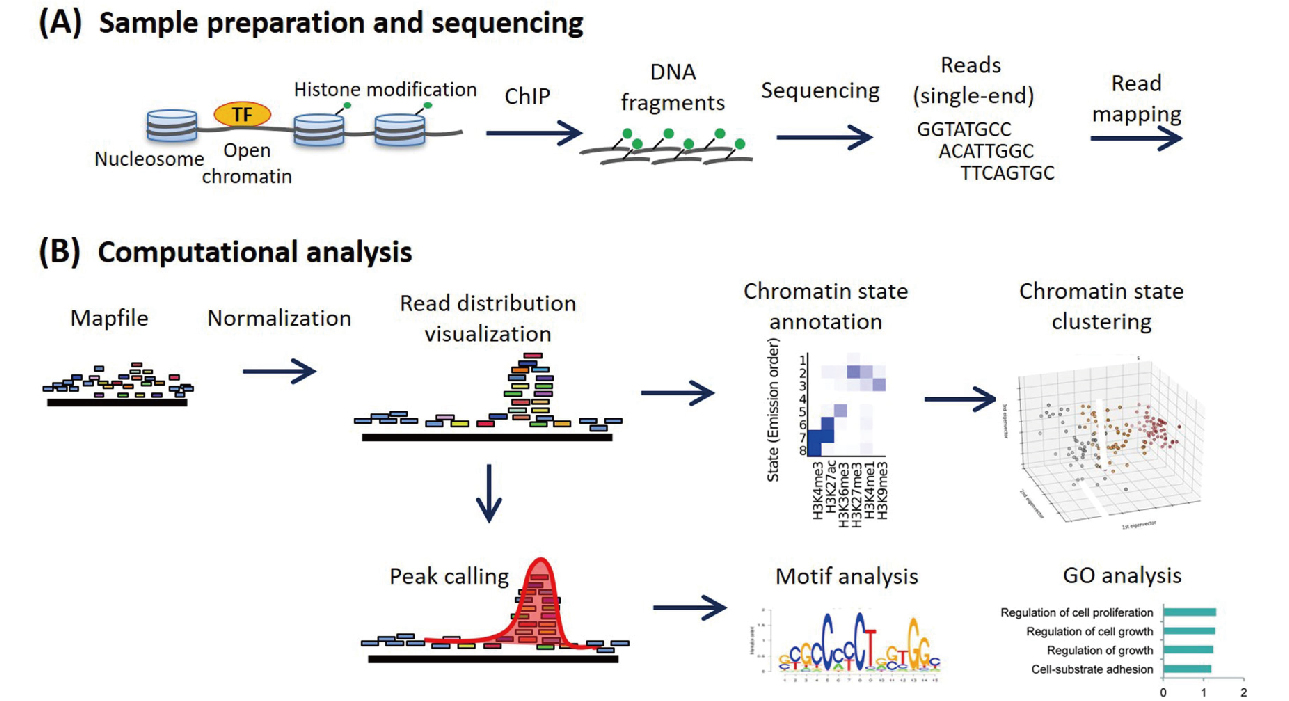
图 ChIP-seq技术流程示意图(Nakato R, Sakata T., 2021)。
服务流程
客户在线下单——订单/实验材料确认——材料准备——甲醛交联——染色质片段化——免疫共沉淀——解交联并纯化DNA片段——文库构建——高通量测序——生信分析——结果交付
服务内容及说明
适用场景
1、转录因子与DNA互作研究:定位转录因子在基因组上的结合位点,揭示基因调控网络。
2、组蛋白修饰分析:鉴定组蛋白修饰(如H3K4me3激活标记、H3K27me3抑制标记)的分布,解析表观遗传调控机制。
(1)追踪不同条件下修饰的动态变化;
(2)关联特定修饰与疾病(如癌症中H3K27me3异常)。
3、染色质结构与功能探索:
(1)增强子/启动子定位:通过H3K27ac标记识别活性增强子,结合RNA-seq验证功能;
(2)三维基因组学:联合Hi-C技术,研究染色质环与基因调控的关系。
4、疾病机制与生物标志物发现:分析肿瘤样本中转录因子或修饰的异常。
5、发育与细胞命运决定研究:如比较多能干细胞与分化细胞中转录因子的结合差异。
实验周期
致电详询
客户下单及项目信息填写
在我司官网http://www.biorun.com/进行注册或登录,请客户按照页面提示填写项目名称、选择项目类型、填写个人信息及联系方式,提交项目所需要的具体信息(可联系区域销售经理),包括:
1、组织、细胞等样品来源、状态及其他相关信息;
2、参考基因组信息(提供下载链接);
3、尽可能丰富的相关资料、文献。
实验信息
实验过程中客户可以随时登入管理系统查看项目实时进展情况。实验结题时系统会通过短信自动通知客户,并发送实验报告查看网址。实验结题后,实验报告、检测结果可在线查看或打印,并永久保留。
实验交付内容
1、前期质检WB验证结果;
2、IP-DNA质检结果;
3、文库质检结果;
4、包括实验原理介绍、实验仪器与试剂、具体实验步骤以及实验结果与分析等的实验报告;
5、生信分析结题报告;生物信息学分析内容包括:数据预处理及分析、测序数据质量评估、参考序列比对、Peak峰calling、Peak分析、Peak基因注释、Peak相关基因的功能富集分析、Motif分析、差异peak分析等。
案例展示

期刊:Elife
影响因子:8.7
发表年份:2022
一、研究背景
自然杀伤细胞(NK细胞)是先天免疫系统中的关键淋巴细胞,尽管关于调控NK细胞发育和功能的转录因子在小鼠中的研究已经相当深入,但RUNX2这一转录因子在小鼠和人类NK细胞的发育与功能中的作用尚未得到充分探讨。作者采用ChIP-seq和RNA-seq等联合分析对此进行了系统性研究。
二、研究结果
作者发现RUNX2可以促进人类成熟NK细胞的产生,其可以通过调控IL-2Rβ表达水平来控制NK细胞的发育过程。通过对RUNX2 ChIP-seq和RNA-seq数据分析发现大多数差异表达的基因都是RUNX2的直接靶标,进一步探究了RUNX2介导NK细胞分化的分子机制,说明了RUNX2调控NK细胞分化过程的重要性。
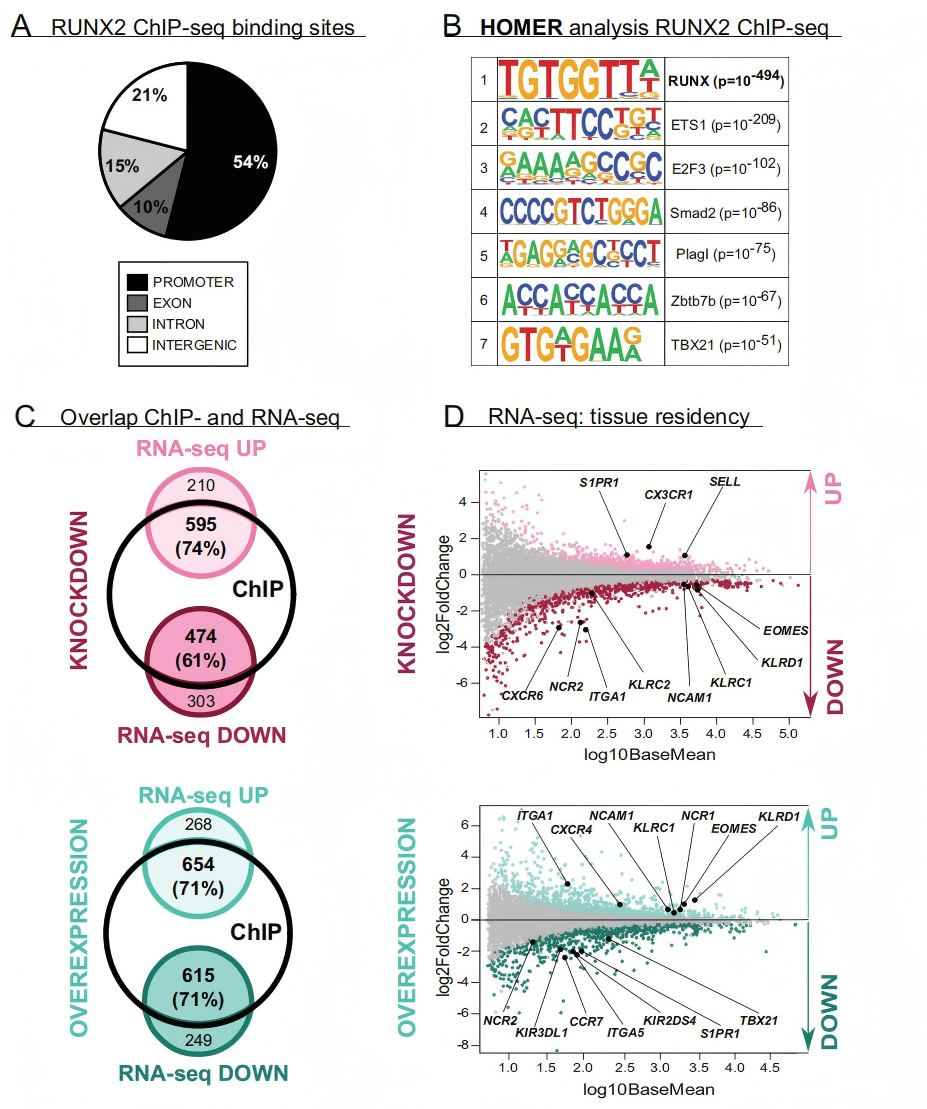
图 ChIP-seq和RNA-seq联合分析结果(Wahlen et al., 2022)。
参考文献
Nakato R, Sakata T. Methods for ChIP-seq analysis: A practical workflow and advanced applications[J]. Methods, 2021, 187: 44-53.
Wahlen S, Matthijssens F, Van Loocke W, et al. The transcription factor RUNX2 drives the generation of human NK cells and promotes tissue residency[J]. Elife, 2022, 11: e80320.
