AbMole小课堂丨L-NAME:一氧化氮合酶(NOS)经典抑制剂在心血管及免疫研究中的应用
L-NAME(NG-nitro-L-arginine methyl ester)是一种广泛应用的一氧化氮合酶(NOS)抑制剂。L-NAME(AbMole,M2818)是探索一氧化氮(NO)信号通路在心血管系统和免疫系统中生理与病理作用的基石性工具化合物。AbMole为全球科研客户提供高纯度、高生物活性的抑制剂、细胞因子、人源单抗、天然产物、荧光染料、多肽、化合物库、抗生素等科研试剂,全球大量文献专利引用。
一、L-NAME的作用原理
一氧化氮(NO)作为一种信号分子,广泛参与细胞增殖、血管舒张、神经传递、免疫应答等多种生理过程,其功能异常与心血管疾病、神经系统病变、炎症紊乱等多种病理状态密切相关。NO的生物合成依赖一氧化氮合酶(NOS)的催化作用,该酶以L -精氨酸为底物,在辅酶(如NADPH、FAD、FMN)参与下生成NO与L-瓜氨酸。根据组织分布与功能差异,NOS主要分为神经元型(nNOS)、诱导型(iNOS)和内皮型(eNOS)三类。L-NAME对上述三种NOS均具有抑制活性。L-NAME(N'-硝基-L-精氨酸甲酯) 的分子结构与 NOS 的天然底物 L-精氨酸高度相似,二者均可竞争性结合NOS的活性中心。L-NAME 与 NOS 的结合常数(Ki 值)要低于L-精氨酸的米氏常数(Km 值),因此在同等浓度下,L-NAME 可优先占据 NOS 活性中心,阻断L-精氨酸的结合。结合后的 L-NAME 可通过其分子中的硝基(-NO₂)与 NOS 活性中心的血红素基团形成稳定的配位键,导致酶的构象改变,进一步抑制 NOS 的催化活性。
二、L-NAME(51298-62-5)的科研应用
1. L-NAME用于动物高血压模型的构建
L-NAME(NG-Nitroarginine methyl ester,AbMole,M2818)可通过抑制NOS,减少NO的生物合成,后者的缺乏将导致血管收缩功能异常,最终可建立高血压动物模型。L-NAME诱导的动物高血压模型特征包括血压升高、血管张力异常及氧化应激增强。例如L-NAME可诱导Wistar大鼠的高血压模型,使用剂量为50 mg/kg/Day,结果显示L-NAME处理后的大鼠的收缩压升高(收缩压≈80mmHg)[1]。在另一项研究中,L-NAME通过饮用水给予C57BL/6基因编辑小鼠,给药方案为50 mg/kg/day(1-17周),100 mg/kg/day(18-21周),在结合高盐饮食后成功构建了小鼠的高血压模型[2]。此外,L-NAME的动物给药方式十分便捷,一般可将其溶于水中进行喂食或者通过腹腔进行注射[3]。在联合高脂饮食(HFD)时,L-NAME还能诱发心脏舒张功能障碍(HFpEF)和肾脏纤维化,为代谢性疾病的研究提供模型[4]。L-NAME还能用于构建先兆子痫动物模型,例如L-NAME在Wistar大鼠中通过自由饮水的方式给药,诱导大鼠出现先兆子痫的经典症状[5]。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。
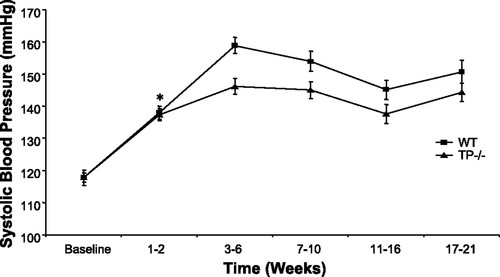
图 1. Systolic blood pressures during L-NAME and high-salt administration.
2. L-NAME用于心肌缺血再灌注损伤的研究
L-NAME还被用于研究 NO 信号通路在心肌缺血再灌注(I/R)损伤中的作用机制。例如L-NAME(剂量为30 μM,在缺血前10分钟和缺血期间,通过加入灌注液的形式给药)在白化Wistar大鼠的心肌I/R损伤模型中,抑制了蒲公英提取物对大鼠心脏的保护[6]。L-NAME(100 μmol/l,静脉注射)还可以逆转白藜芦醇对SD大鼠心肌I/R损伤模型的保护作用,表明NO是白藜芦醇发挥功能的机制之一[7]。
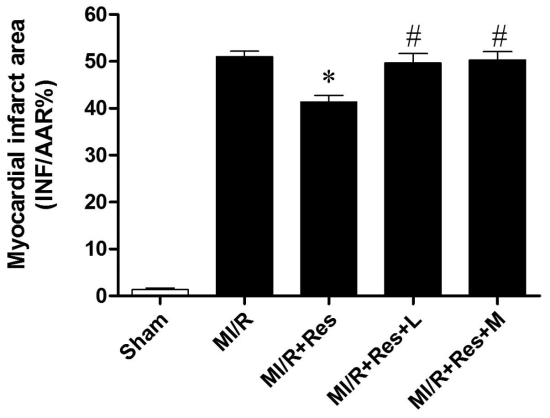
图 2. 白藜芦醇抑制SD大鼠心肌I/R模型中的梗塞比例[7]
3. L-NAME用于炎症与免疫调控研究
NOS 在炎症刺激(如脂多糖 LPS、细胞因子)诱导下可大量表达,生成的NO 作为免疫效应分子参与病原体清除与炎症反应调控。L-NAME(NG-Nitroarginine methyl ester,AbMole,M2818)通过抑制NOS可以揭示NO在免疫过程中的功能。例如L-NAME 通过降低肿瘤细胞的NO和巨噬细胞的TNF-α来抑制 r/m HM-SFME-1 细胞的肿瘤细胞进展和肺转移。在上述实验中,动物模型为Balb/c小鼠,L-NAME 的剂量为1mg/mL,通过小鼠饮用水给药[8]。L-NAME还在II型胶原诱导的C57/B10小鼠关节炎(CIA)模型中,通过抑制NOS,减少NO和RNS(活性氮)的生成,限制了T细胞的活化,并因此对大鼠CIA起到预防作用。在上述研究中,L-NAME给药方式为腹腔注射或者经口给药,剂量分别为4.3mg/100μL/小鼠和416 mg/L(混入小鼠饮用水中)[9]。
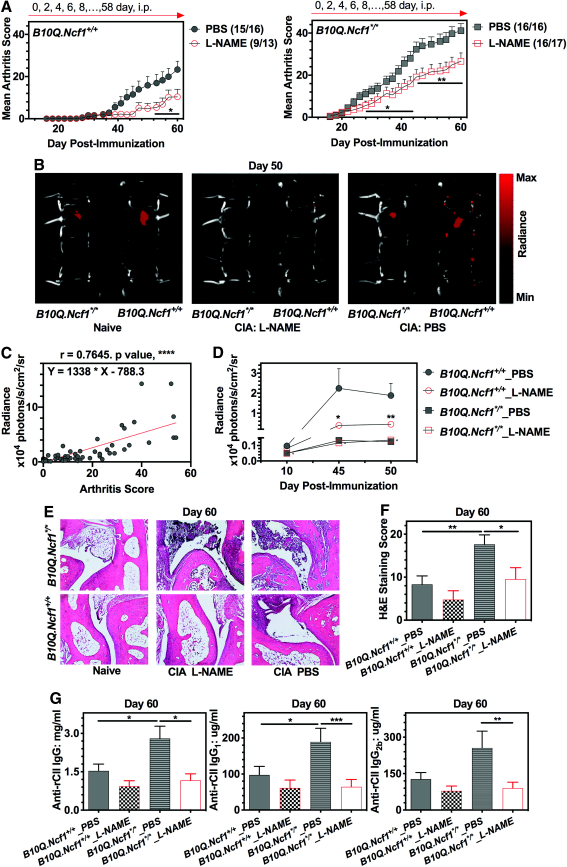
图 3. Treatments of L-NAME suppress CIA in mice[9]
三、范例详解
1. Neurotherapeutics, Volume 21, Issue 1, January 2024, e00301
西班牙瓦伦西亚大学的实验人员在上述论文中研究了肌萎缩侧索硬化症(ALS)的病理机制与潜在干预策略。通过两种 ALS 小鼠模型(SOD1G93A 转基因小鼠、FUSR521C 转基因小鼠),探讨了Nicotinamide riboside(NR)、Pterostilbene (PT)与Ibudilast(IBU)联合使用对运动神经元保护及小鼠存活的影响,并深入解析其作用机制。主要发现以下机制:ALS 病理损伤的核心机制为 “促炎细胞因子→H₂O₂/NO 生成→・OH/・OONO⁻积累→运动神经元氧化损伤”的级联反应。Nicotinamide riboside 通过补充 NAD + 激活抗氧化通路,Pterostilbene 通过激活 Nrf2 增强抗氧化防御,Ibudilast 通过抑制 PDE 降低 TNFα 水平,三者协同作用可阻断氧化应激与亚硝化应激,减少神经炎症,保护线粒体功能,最终实现对运动神经元的保护。由AbMole提供的L-NAME(NG-nitro-L-arginine methyl ester,AbMole,M2818)作为一氧化氮合酶(NOS)的特异性抑制剂,在本研究中用于验证 NO 在 ALS 病理进程中的直接作用。通过腹腔注射 L-NAME(20 mg/kg/天,自18周起给药至小鼠死亡),可显著降低ALS小鼠运动神经元、胶质细胞及内皮细胞的 NO 生成量(NOx 水平较对照组减少 40%-50%),并降低亚硝化应激标志物(亚硝基硫醇、3-硝基酪氨酸)的水平,证明 NO 是ALS模型中促损伤的关键分子[10]。
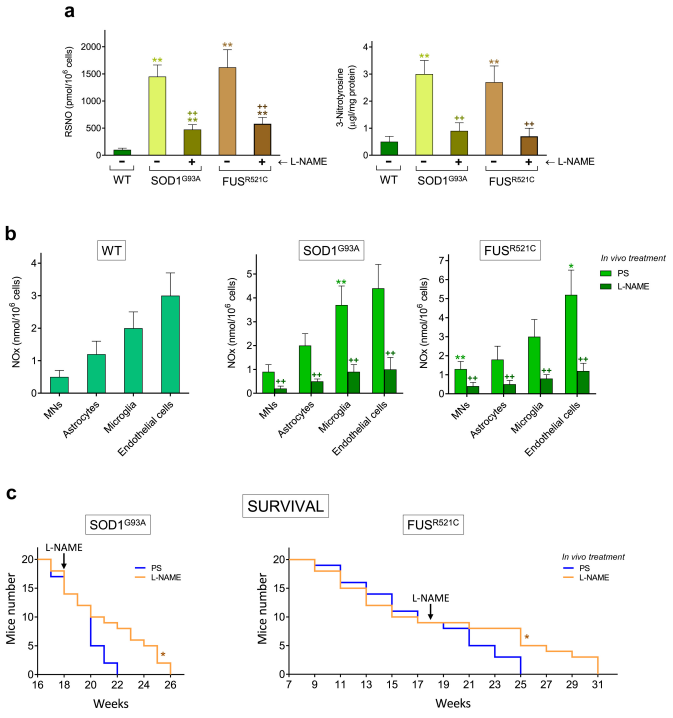
图 4. Treatment with L-NAME decreases NO generation and increases survival in ALS mice[10].
2. Oxid Med Cell Longev. 2021 Jun 14;2021:6662225.
江苏大学附属医院的实验人员在上述文章中,探究了动脉粥样硬化(AS)合并抗磷脂综合征(APS)背景下,氧化低密度脂蛋白/β2糖蛋白I / 抗β2糖蛋白I抗体复合物(oxLDL/β2GPI/anti-β2GPI)对血管内皮细胞自噬的调控机制,及其与内皮细胞功能障碍的关联。实验人员以人脐静脉内皮细胞(HUVECs)和小鼠脑内皮细胞(bEnd.3)为模型,通过 Western blot、透射电镜(TEM)及 mRFP-GFP-LC3 腺病毒转染实验发现:oxLDL/β2GPI/anti-β2GPI 复合物可以抑制内皮细胞自噬,并且在复合物处理后,细胞的PI3K(Tyr458)、AKT(Ser473)、mTOR(Ser2448)及 eNOS(Ser1177)磷酸化水平显著升高(峰值出现于处理后的30-45 分钟),且 AKT 抑制剂 AZD5363可抑制 eNOS 磷酸化,证明eNOS是AKT的下游靶点。来自AbMole的L-NAME(N (ω)-nitro-L-arginine methyl ester,M2818)在本研究中用于验证 eNOS 通路在复合物调控内皮细胞自噬中的必要性,L-NAME预处理HUVECs和bEnd.3细胞(100μM,4 小时),可抑制 oxLDL/β2GPI/anti-β2GPI 复合物诱导的 eNOS 磷酸化(Ser1177),从而阻断 eNOS 通路激活[11]。
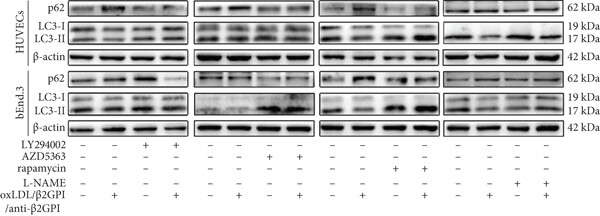
图 5. The regulation of PI3K/AKT/mTOR and eNOS signaling pathways in oxLDL/β2GPI/anti-β2GPI complex-mediated endothelial autophagy[11].
AbMole是ChemBridge中国区官方指定合作伙伴。

参考文献及鸣谢
[1] C. F. Küng, P. Moreau, H. Takase, et al., L-NAME hypertension alters endothelial and smooth muscle function in rat aorta. Prevention by trandolapril and verapamil, Hypertension (Dallas, Tex. : 1979) 26(5) (1995) 744-51.
[2] H. Francois, N. Makhanova, P. Ruiz, et al., A role for the thromboxane receptor in L-NAME hypertension, American journal of physiology. Renal physiology 295(4) (2008) F1096-102.
[3] R. Schreckenberg, R. Schulz, N. Itani, et al., Inhibition of MMP2 activity mitigates N-omega-nitro-l-arginine-methyl ester (l-NAME)-induced right heart failure, Redox biology 76 (2024) 103308.
[4] J. Chen, L. Zhang, T. Xie, et al., Nitazoxanide protects against heart failure with preserved ejection and metabolic syndrome induced by high-fat diet (HFD) plus L-NAME "two-hit" in mice, Acta pharmaceutica Sinica. B 15(3) (2025) 1397-1414.
[5] Yu-Hsuan Chen, Yo-Cheng Chang, Wan-Ju Wu, et al., Kefir peptides mitigate L-NAME-induced preeclampsia in rats through modulating hypertension and endothelial dysfunction, Biomedicine & Pharmacotherapy 180 (2024) 117592.
[6] Monika Sharma, Pankaj Pal, FaheemHyder Pottoo, et al., Mechanistic Role of Methanolic Extract of Taraxacum officinale Roots as Cardioprotective Against Ischemia–Reperfusion Injury-Induced Myocardial Infarction in Rats, Applied Biochemistry and Biotechnology 195(5) (2023) 3384-3405.
[7] X. Cong, Y. Li, N. Lu, et al., Resveratrol attenuates the inflammatory reaction induced by ischemia/reperfusion in the rat heart, Molecular medicine reports 9(6) (2014) 2528-32.
[8] Hideaki Yamaguchi, Yumi Kidachi, Hironori Umetsu, et al., l-NAME inhibits tumor cell progression and pulmonary metastasis of r/m HM-SFME-1 cells by decreasing NO from tumor cells and TNF-α from macrophages, Molecular and Cellular Biochemistry 312(1) (2008) 103-112.
[9] J. Zhong, A. C. Y. Yau, R. Holmdahl, Regulation of T Cell Function by Reactive Nitrogen and Oxygen Species in Collagen-Induced Arthritis, Antioxidants & redox signaling 32(3) (2020) 161-172.
[10] Rafael López-Blanch, Rosario Salvador-Palmer, María Oriol-Caballo, et al., Nicotinamide riboside, pterostilbene and ibudilast protect motor neurons and extend survival in ALS mice, Neurotherapeutics 21(1) (2024) e00301.
[11] G. Zhang, C. He, Q. Wu, et al., Impaired Autophagy Induced by oxLDL/β2GPI/anti-β2GPI Complex through PI3K/AKT/mTOR and eNOS Signaling Pathways Contributes to Endothelial Cell Dysfunction, Oxidative medicine and cellular longevity 2021 (2021) 6662225.
