生物化学Learning Track(14)酶催化机制
本篇笔记基于杨荣武教授主编的《生物化学》第四版
(配图也来自于教材)
酶催化机制研究的主要方法
对于酶催化机制的研究有助于我们更好地去了解这个酶是如何依赖其特定的基团发挥催化功能的,进而帮助我们对这个酶进行定点突变以提高稳定性或者是活性。下面介绍几种常用的研究酶催化机制的方法,其实本质上就是想要研究是什么残基以及哪些基团参与了活性中心以及活性的调节。
1. 测定酶蛋白的一级结构,找出保守性的序列:这个是分析功能位点比较常见的方式,但是也存在着局限性,一方面,如果酶的进化历程确实符合保守性序列分析的要求,那么我们筛选出来的位点未必是活性中心的功能位点,也可能是对结构支撑起着关键作用的位点,也就是我们没法很好地分析出哪些是有着功能的;另一方面,如果存在这个蛋白的进化历史较短或者同源蛋白的数量不足,就可能会出现大范围的保守序列,这在实际分析当中的意义就大大衰减。
2. 确定酶三级结构:酶的催化和三维构象之间有着非常重要的关联,如果我们可以解析出蛋白质的三维构象的话,那么我们就可以直接确定哪些位点可能起着功能位点的作用,而哪些位点仅仅是起着结构支撑的作用。
3. 定点突变:
其实这是一种间接判定残基的重要性的方法,如果我们想要判断某个残基是否在酶催化上起着关键作用,我们就可以对这个位点进行化学修饰或者突变,比如我们可以把丝氨酸替换为丙氨酸然后观察酶的功能结构,进而就可以判断丝氨酸在这个结构当中起着什么作用。(这里我们不选择敲除,因为敲除某个氨基酸可能会对二级结构等产生影响,我们更倾向于用一个符合条件的类似氨基酸来进行替代)
4. 动力学分析:
其实这就是利用酶对外界环境响应较为灵敏的这一特点,通过调节pH或者加入抑制剂,来调控不同基团的解离情况,进而研究各个基团在酶催化上的作用
5. 化学修饰:
这一点其实和定点突变有点相像,可以说思路一致只是实现方法有差异。这里我们不突变这个位点,而是选择修饰它。比如,我现在怀疑某些氨基酸位点可能对活性有着影响,那么我就可以依次化学修饰,来观察在修饰前后酶的活性是否受到了影响。或者我们需要确定活性中心的位点,那么我们可以利用竞争性抑制剂(底物类似物型)或者就是高浓度的底物处理酶,然后再进行化学修饰,那么没有被化学修饰的位点就说明被保护起来了,也就意味着这些位点是处于活性中心的。
6. 计算机模拟和AI预测:
这一步其实是真的方便我们对一个蛋白进行可视化,以及做出初步的预判,但具体原理并不是很懂,所以略过
过渡态稳定学说
什么是过渡态,过渡态指的是化学反应当中必须经历的一个高能阶段,这个高能阶段就是恰好处于旧键未完全断裂以及新键未完全形成的一个阶段,这种不稳定的高能状态就是被称为过渡态,那么过渡态稳定学说目前是解释酶催化化学反应机理的主要学说,这个学说认为酶通过与过渡态的强相互作用从而稳定过渡态的结构,使得底物更容易到达过渡态阶段,从而加快反应速率发挥催化作用。
那么根据这个学说,酶对于过渡态的亲和力应当是高于酶对底物的亲和力的,这个亲和力可以用自由能大小来衡量,如果酶与底物结合使得自由能下降的程度还有高于酶与过渡态结合使得自由能下降的程度,那么此时其实反应的活化能不减反增。但这里如果我们想要call back我们在之前学习过的诱导契合模型(解释酶与底物的特异性结合的理论),其实也发现是相通的。因为这两个学说都是建立在一个重要的基础之上的,也就是酶和底物分子都是具备一定柔性的。那么在正常的催化过程当中,实际上是酶与底物互相通过活性基团彼此诱导,使得酶变为结合过渡态的结构,底物也成功到达过渡态。但是如果我们直接用底物和初始状态的酶结合,那么实际上就是更多的诱导作用是底物诱导酶发生的,这里再剧透一下后面的抗体酶内容,抗体酶发挥作用更多是酶诱导底物发生结构变化到达过渡态发生的。(其实这一个诱导过程是一个比较abstract的过程,但是记住柔性这一个性质非常重要)
那么简单总结一下过渡态学说的主要内容,酶发挥催化作用主要是依赖于酶与过渡态的相互作用使得过渡态更加稳定从而降低过渡态的过渡态的能量而实现的。由此,酶与底物的亲和力是弱于酶与过渡态的亲和力,或者说酶与底物的亲和力不可过强,否则产生较大的结合能反而不利于过渡态的生成(黑线所表示的也就是酶催化的反应,蓝绿色线表示的是无酶催化的反应历程)
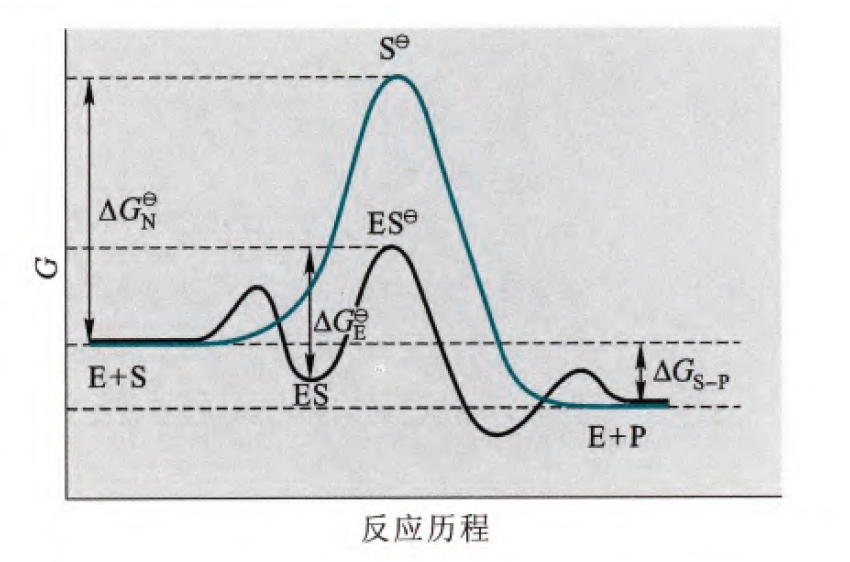
那么实际上之所以过渡态理论被广泛的接受,是由两个基本的实验(或者说是应用)所佐证的
第一个是我们在酶动力学所讲述的不可逆抑制剂当中的过渡态类似物抑制剂,研究者发现过渡态类似物抑制剂可以以非常强的结合能力结合酶,但是酶无法将其转化为产物,总而导致酶不可逆性的失活。这个实验直接佐证了酶对于过渡态是具有很强结合能力的,印证过渡态理论。
第二个是我们在前面有所铺垫的抗体酶。最初有这样一个想法,既然根据酶与过渡态的结合能力是如此之强,以至于酶可以促使底物分子向过渡态发生结构转变。那么如果我根据过渡态分子的类似物制备出一种抗体,那么这种抗体就会和该反应的过渡态同样有着很好的结合能力,那么是否也具备催化能力呢(毕竟这是假设的核心),实际发现是可以的,这种抗体酶确实具有催化作用,同时也满足米氏方程。
但是在这里还是稍微总结一下,我们涉及的酶的催化机理和历程其实是一个非常复杂的生化过程,所以实际上很难对此有一个清楚的描述,我们对于此的认识目前还是基于比较abstract的理论上的——由于酶和底物分子具备柔性,所以可以结合,所以可以互相诱导或者彼此诱导发生反应。
酶稳定过渡态的化学机制
我们一直在强调,酶是通过稳定过渡态的结构降低过渡态的能量,从而降低反应的活化能,从而提高反应速率的。那么问题来了,酶是通过什么样的化学机制来稳定过渡态的呢?下面介绍六种效应
邻近定向效应:
我们知道如果没有酶的相互作用,那么实际上底物分子在溶液当中的碰撞是完全随机的,也就是受到了扩散速率以及取向的作用。但是酶在这里实际上是发挥了一个抓手的作用,首先它会捕获一个底物,然后因为酶的相对质量是明显大于另外一种(或几种底物)的,所以由原来两个底物随机碰撞,现在成为另外的底物去碰撞几乎不动的酶,那么这种相遇的机会提高了很多,同时酶还可以在捕获底物之后,对底物进行合适的定向,这样可以进一步促进反应的发生
广义酸碱催化:
首先什么是广义的酸碱,我们认为只要是可以释放出质子的就称为酸,只要能结合质子的就称为碱。那么在这个意义上,对于具有可解离基团的蛋白质而言,可以被称为酸也可以被称为碱。
酶的广义酸碱催化是酶活性中心的催化基团作为质子供体或者受体参与催化,其中作为质子供体称为广义的酸催化,作为质子受体的称为广义的碱催化。那么与广义酸碱催化有关的基团(或残基),那么必须是可以解离的,比如半胱氨酸、丝氨酸、苏氨酸、天冬氨酸、谷氨酸、精氨酸、赖氨酸以及组氨酸还有肽链两端游离的α-羧基和α-氨基。
那么这些酸碱催化的基团有什么作用吗?首先既然是可以接受和释放质子的,那么就可以起着稳固过渡态的电荷的性质,比如一个过渡态带有正电,那么在这个pH下对于天冬氨酸可能就电离而带有负电,那么这样就可以形成盐键从而稳固过渡态。同时这些酸碱催化基团还可以激活亲核基团和亲电基团或者发挥稳固离去基团的作用。
我们尤其关注组氨酸,组氨酸的pKa在游离的状态下是接近于7的,那么这也就使得组氨酸可以在环境为低pH的时候,作为质子的受体碱催化,当环境为高pH的时候,作为质子的供体,进行酸催化。实际上,组氨酸经常作为质子转移的重要环节,是很多酶的催化基团
(这里需要提到,这里之所以强调在游离状态pKa,我认为其实我们在生化领域定义的这里pKa是用来描述质子释放或者结合的难度的,那么如果pka越大的话,那么说明释放质子就越难(Ka表越大释放质子越容易,那么pKa相当于要取一个反),所以我们对于游离态和结合态是不可以一概而论的,因为残基组成的蛋白结构是不同的,那么其实这时候的反应式也是不同的,我们不可以认为这个时候各个残基的pKa仍然和游离的是一样的,仅仅可以用游离状态下的pKa作为一个参考而已)
静电催化
静电催化指的是酶利用活性中心的电荷来稳定反应的过渡态,在催化当中,酶可以使用自身带电的基团,去中和相反电荷的过渡态
金属催化
近三分之一已知酶的活性需要金属离子的存在,这些酶分为两类,一类是金属酶(紧密结合的金属离子,多数为过渡金属),一类是金属激活酶(金属离子松散地结合,多为碱金属)
金属离子参与的催化称之为金属催化,金属催化作用一般可以分为三部分
1. 电子传递,一方面可以作为路易斯酸接受电子,激活亲核基团;另一方面可以通过接受电子或者释放电子实现价态的可逆変化,促使底物在反应当中正确定向
2. 电性作用,与带负电的底物结合,屏蔽负电荷,促使底物正确定向;参与静电催化,稳定带有负电荷的过渡态
3. 结构作用,作为酶结构的一部分
共价催化
共价催化涉及酶在催化过程当中,与底物暂时形成不稳定的共价中间物,共价中间物的形成可以改变了反应的路径,这有利于克服活化能。那么这种新的反应途径的主要高活化能的部分是,一是共价中间物的形成,二是共价中间物的断裂,所以反应的限速步骤要么是共价中间物的形成或者是共价中间物的断裂部分。
那么酶进行共价催化的方式有亲核催化和亲电催化。但是无论是哪一种催化方式,因为涉及到共价化合物的形成和断裂两个部分,那么会涉及到两个阶段的亲核进攻或者是亲电进攻。第一次的亲核(电)进攻是酶和底物分子形成共价化合物,第二次的亲核(电)进攻是另外一个底物分子对这个共价键进行进攻,从而断开酶与底物的连接。那么理想的情况,也是反应速率最大的情况就是,第一次的酶基团的进攻的亲核(亲电)性要大于离去基团,第二次别的底物的亲核(亲电)性要大于酶基团。
那么对亲核进攻而言,酶常见的参与的亲核基团有羟基氨基酸的羟基(丝氨酸、苏氨酸、酪氨酸)和半胱氨酸的巯基,赖氨酸的σ-氨基和组氨酸的咪唑基,酸性氨基酸的羧基以及作为辅酶的硫胺素焦磷酸(TPP)等
但是对于亲电进攻而言,对于氨基酸残基并没有很好的亲电基团,所以一般需要依赖缺乏电子的辅酶或者金属离子来进行催化,那么常见的辅酶有磷酸吡哆醛(PLP)这类辅酶可以参加所有的转氨基反应(与转氨酶结合)还有脱羧反应(与脱羧酶结合)、脱氨基反应(与脱氨酶结合)以及消旋反应(与消旋酶结合),具体的脱氨基反应历程这里不叙述
底物形变
其实这就是我们最初说的酶通过诱导底物向着过渡态方向转变并且稳定过渡态的机制。我认为这里更多的是对于底物的操作,酶对于过渡态的亲和力为什么高可能更多的机制是由前面的五点效应说明,这里讲的是底物如何向过渡态转变的过程(呼应诱导契合模型)
几种蛋白酶的结构和功能
蛋白酶是催化肽键水解的酶的总称,虽然肽键的水解是热力学上十分有利(自由能降低)的过程,但是在动力学上,如果没有酶的催化需要很长时间才可以发生
根据酶活性中心催化基团的性质,可以把蛋白酶分为四类,第一类为丝氨酸蛋白酶,其催化基团包括1个不可以缺少的丝氨酸,DIPF(二异丙基氟磷酸)是它们的不可逆抑制剂(会形成不可逆的共价修饰),第二类是巯基蛋白酶,其催化基团包括一个半胱氨酸的巯基,碘代乙酸是它们的不可逆抑制剂(同样也是发生不可逆共价修饰);第三类是天冬氨酸蛋白酶,其催化基团包括2个重要的天冬氨酸,在偏碱性的pH下无活性;第四类是金属蛋白酶,此类金属酶在活性中心结合金属离子,金属螯合剂(EDTA或者邻菲罗啉)可以使得其活性丧失
丝氨酸蛋白酶和巯基蛋白酶
这两类蛋白酶在催化反应当中,先后存在两次的亲核进攻,第一次的亲核进攻的基团分别是丝氨酸的羟基和半胱氨酸的巯基,第二次都是水分子。催化机制包括广义的酸碱催化和共价催化等,脂酰化酶是第一次亲核进攻之后酶和底物形成的共价中间物。
丝氨酸蛋白酶
丝氨酸蛋白酶主要包括以下这些成员,动物体内的消化酶:肠肽酶、胰蛋白酶、胰凝乳蛋白酶。弹性蛋白酶(这些蛋白酶对于底物具有不同的专一性,这些专一性是由各个酶的活性中心的立体化学不同导致的,比如对于胰蛋白酶具有很深的底物结合口袋,口袋内部是带有负电荷的天冬氨酸,所以有利于结合精氨酸和赖氨酸等;胰凝乳蛋白酶的底物结合口袋比较宽,同时内部分布有很多的疏水氨基酸残基是,所以适合于芳香族氨基酸的结合。弹性蛋白酶的底物口袋很浅,所以适合与侧链较小的氨基酸残基结合),枯草杆菌蛋白酶(由枯草杆菌分泌到胞外的消化酶),凝血酶、纤溶酶、组织型纤溶酶原激活剂(tPA)、激肽释放酶原是调节蛋白酶,通过剪切蛋白来调节代谢或者信号传导;颗粒酶B是细胞毒性T细胞和自然杀伤细胞分泌,可以在穿孔蛋白的帮助下,进入特定的靶细胞,通过水解激活胱天蛋白酶促进细胞凋亡
丝氨酸蛋白酶的催化机制属于共价催化和广义酸碱催化的混合体,由三个不变的氨基酸残基丝氨酸、组氨酸和天冬氨酸构成的催化三元体起主导作用,这三个氨基酸残基如果有任意一个残基发生突变,都会导致酶活性的丧失。虽然这里我们给定这个三元体编号,但是其实这三个残基在不同的蛋白当中的一级序列并非固定,但是由这三个残基构成的催化三元体的空间结构还是高度保守的
这三个残基的作用如下:
(1)丝氨酸提供进攻底物的亲核基团,并作为广义酸催化剂
(2)组氨酸作为广义碱催化剂
(3)天冬氨酸仅仅用来定向组氨酸,影响组氨酸侧链的pKa
以胰凝乳蛋白酶为例,分析催化的机理
(1)首先底物与活性中心的丝氨酸和甘氨酸通过氢键形成酶-底物复合物(ES复合物),疏水口袋恰好容纳芳香环(这一步是酶与底物结合的过程)
(2)丝氨酸的羟基氧进攻肽键的羰基碳,形成第一个碳四面体过渡态中间物,其中一个氧以阴离子形式存在
(这一部分需要组氨酸通过结合丝氨酸的羟基上的质子激活丝氨酸的亲核性,使其可以作为亲核基团,也可以作为广义酸碱催化基团,而天冬氨酸的作用就是稳定组氨酸刚刚加上的正电性,帮助组氨酸定位(利用氢键))
(3)碳四面体过渡态在氧阴离子与丝氨酸的亚氨基以及甘氨酸的亚氨基形成氢键而得以稳定
(4)肽键断裂,原来氨基侧(肽段右侧)的肽段作为离开集团在组氨酸57咪唑环上得到一个质子之后被释放(获得RNH2),这是肽键断裂的第一个产物;而原来肽键左侧的肽段(羰基氧部分)通过氢键和与丝氨酸形成的共价酯键仍然结合在活性中心
(5)水分子进入活性基团,组氨酸夺取水分子的质子之后,水分子具有很强亲核能力,进攻肽段的羰基碳,第二次形成碳四面体过渡态中间物。随后丝氨酸与产物分子的共价酯键断裂,并从组氨酸重新得到质子,组氨酸和丝氨酸仍然以氢键相连。
所有的步骤如图:
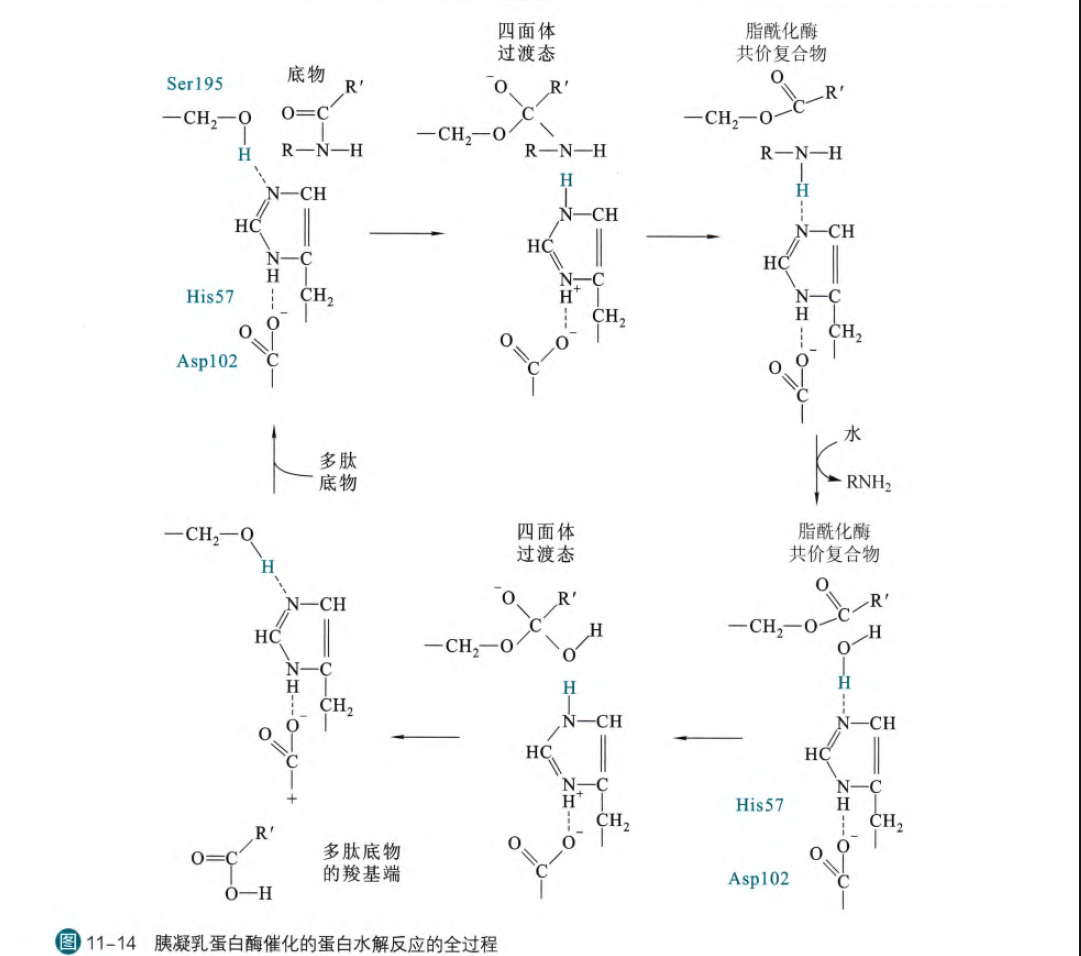
简单来说在底物与酶结合之后(依靠氢键)首先就是组氨酸夺取丝氨酸的羟基氢,丝氨酸的羟基氧作为亲核基团进攻底物分子,形成碳四面体,那么这个碳四面体的结构在酶当中由于氢键的作用得以稳定,然后肽段的N抢夺组氨酸的H,肽键断裂,释放出N产物;然后水分子进入活性中心,同样被组氨酸抢夺质子,作为新的亲核进攻基团进攻羰基碳,形成碳四面体,这个碳四面体仍然可以在氢键作用下相对稳定(但是缺少了组氨酸的作用可能稳定性会有所下降,可能也是为什么这一步是限速步骤的原因),然后底物与丝氨酸的羟基氧的键断裂,丝氨酸羟基氧夺取组氨酸的质子,重新恢复初态。在这一整个过程当中,天冬氨酸都起着稳定组氨酸的结构和位置的作用(可以通过负电性稳定组氨酸所带的正电)
(再强调一遍,最后一步的水分子进攻形成的四面体过渡态和丝氨酸的离去是这个反应的限速步骤,可以通过第一个产物释放速率和第二个产物的释放速率得到这个结论)
巯基蛋白酶
巯基蛋白酶也称为半胱氨酸蛋白酶,包括了木瓜蛋白酶,菠萝蛋白酶,钙蛋白酶,梭菌蛋白酶等等
巯基蛋白酶参与的肽键断裂催化的机理与丝氨酸蛋白酶的作用基本一致,主要差别就在于巯基壁羟基更容易发生去质子化(硫原子的电负性低于氧原子),当巯基蛋白酶的巯基脱质子(组氨酸抢的),硫负原子就作为强亲核基团进攻,步骤与丝氨酸蛋白酶相似
(但是在巯基蛋白酶当中,天冬氨酸并非必要组分,必要组分仅仅为半胱氨酸和组氨酸,这是由于巯基和羟基去质子化难度决定的,对于巯基的去质子化比羟基要容易,所以组氨酸起到的激活作用相对较弱,那么组氨酸的结构稳固作用(质子要还回去也是比较难的)也不再需要天冬氨酸的辅助,所以在这里的天冬氨酸其实作为的是一个可选的辅助基团而非必须)
天冬氨酸蛋白酶和金属蛋白酶
这两类酶书上的叙述不多,所以我们大概了解到这两类酶是没有共价催化的,对于天冬氨酸蛋白酶的两个天冬氨酸相互配合,作为广义的酸解催化剂,金属蛋白酶中的金属离子可能作为水分子亲核性的激活剂或者是进行路易斯酸催化
属于天冬氨酸蛋白酶的重要蛋白有胃蛋白酶、组织蛋白酶D、凝乳酶、肾素和艾滋病病毒-1蛋白酶。对于大多数的天冬氨酸蛋白酶而言,都具有由两叶组成的三级结构,N端和C端各成一叶,每一叶相当于一个结构域,差不多是两重对称,在中性和偏酸性的条件下活性最高。(对于HIV-1蛋白酶是同源二聚体,所以具备高度的对称性,因此可以筛选出高度对称的抑制剂特异性抑制HIV-1蛋白酶活性)
总结而言,我们在这一章主要学习到的是酶是通过对于过渡态结构的稳定来实现对于反应活化能的降低,那么实际上酶可以通过多种机制如邻近定向效应、广义酸碱催化、静电催化、金属催化、共价催化以及底物形变等方式来稳定过渡态(这里不要把酶稳定过渡态想成一个静态的过程,虽然我们用结构式表征出过渡态的结构,但是实际上酶和底物的作用是时刻发生的,时时刻刻酶都是在用一定的机制在稳固过渡态,这一点可以在丝氨酸蛋白酶的作用当中看到,最开始可能是通过氢键作用结合,然后通过静电催化、广义酸碱催化和共价催化等方式稳固,最后再重新回到氢键作用,所以稳固过程是一个动态的过程,这对于理解稳定过渡态的机制非常重要),然后我们也以几种蛋白酶的结构和功能为例,特别是丝氨酸蛋白酶的催化三联体结构,说明在催化过程当中,酶是如何保证反应推进的过程当中维持过渡态结构的稳定~~
