CD4+ T细胞激活区分抗PD-L1联合抗CTLA4疗法与单药抗PD-L1治疗的响应差异-空间最近邻分析
最近看了一篇题为CD4+Tcellactivationdistinguishesresponsetoanti PD-L1+anti-CTLA4 therapy from anti-PD-L1 monotherapy的文章,深入探讨了在头颈部鳞状细胞癌(HNSCC)中,抗PD-L1单药治疗与抗PD-L1联合抗CTLA4治疗的免疫响应机制差异。
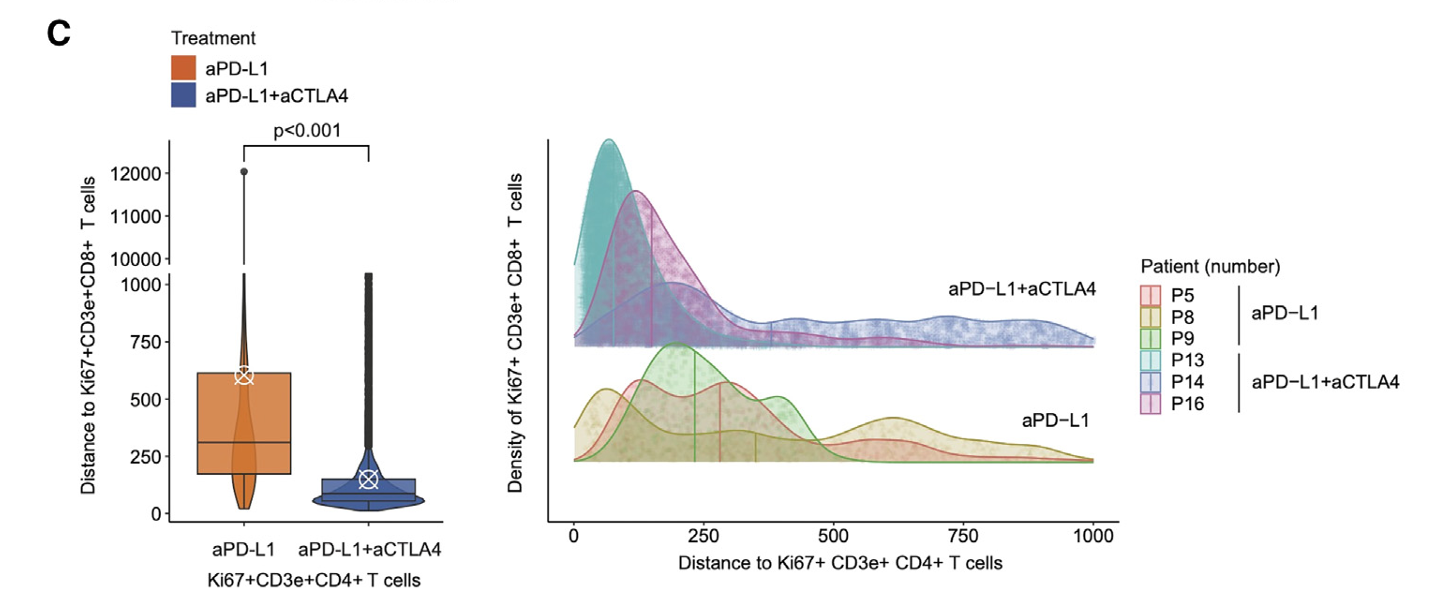
比较感兴趣的是文章中的一张图,进行空间距离统计,主要展示的是抗PD-L1联合抗CTLA4治疗组与抗PD-L1治疗组相比,Ki67⁺ CD3e⁺ CD4⁺ T 细胞 与 Ki67⁺ CD3e⁺ CD8⁺ T 细胞 在空间上更靠近,提示了:
协同增殖与高效免疫应答
Ki67 是细胞进入活跃增殖周期的标志。两类增殖状态的 T 细胞在空间上邻近,往往意味着它们 同时受到抗原刺激和共刺激信号,形成 “增殖热点”;这有助于快速放大 CD4⁺ 辅助信号和 CD8⁺ 杀伤反应,提高抗肿瘤或抗病毒效率。免疫突触与直接互作
CD4⁺ T 细胞可通过免疫突触直接递送 IL-2、CD40L 等信号给 CD8⁺ T 细胞,促进后者克隆扩增与功能成熟。近距离共定位增加了 细胞间直接接触 的概率,从而 增强 CTL(细胞毒性 T 细胞)的杀伤功能。三级淋巴结构(TLS)或免疫微环境热点
在肿瘤中,CD4⁺ 与 CD8⁺ 增殖性 T 细胞紧密聚集常对应 三级淋巴结构 或 “免疫沙漠中的绿洲”,这些区域与 免疫检查点抑制剂反应良好 密切相关。预后/疗效标志
CD4⁺ 和 CD8⁺ T 细胞共定位且均为 Ki67⁺ 的患者,其 客观缓解率和总生存期显著优于 两者分离或仅单一亚群增殖的患者。
计算方法也是比较简单,就是基于细胞空间坐标进行统计和绘图,我们进行了略微修改,自定义函数实现该功能。
研究背景与目的
背景:免疫检查点阻断(ICB)疗法在癌症治疗中取得显著进展,但多数患者对单药治疗无响应或最终复发。联合疗法(如抗PD-L1联合抗CTLA4)在多种癌症中显示出更高的疗效,但其协同作用机制尚不明确。
目的:通过单细胞分析和空间转录组学,研究抗PD-L1单药与联合抗CTLA4治疗在HNSCC中的响应差异,重点关注CD4+ T细胞的作用。
研究方法
患者与样本:20例局部晚期HNSCC患者随机接受单剂量抗PD-L1(n=10)或抗PD-L1联合抗CTLA4(n=10)治疗,14天后手术切除肿瘤。收集治疗前(诊断时)和治疗中(手术时)的肿瘤活检样本,以及血液、肿瘤引流淋巴结(tdLNs)和正常邻近组织。
技术手段:
单细胞RNA测序(scRNA-seq):分析肿瘤微环境(TME)中的细胞组成和基因表达。
单细胞TCR/BCR测序(scTCR/BCR-seq):追踪T细胞和B细胞的克隆扩增。
空间转录组学(Visium):解析免疫细胞的空间分布及相互作用。
空间蛋白质组学(PhenoCycler):验证关键蛋白标记的共定位。
主要发现
T细胞扩增作为早期响应标志:
T细胞克隆扩增与治疗后肿瘤缩小显著相关(r=0.759, p<0.001),可作为早期疗效的替代指标。
联合治疗组中,扩增的T细胞克隆更多来自治疗前未检测到的“新克隆”(49.27%),提示治疗可能招募了新的T细胞。
CD4+ T细胞在联合治疗中的关键作用:
单药抗PD-L1:主要扩增CD8+效应记忆(Tem)和耗竭型(Tex)T细胞。
联合治疗:显著扩增CD4+ T细胞(占扩增T细胞的28.18%,单药组为19.13%,p=0.044),尤其是Th1表型(表达TBX21和PDCD1)。
机制:抗CTLA4促进CD4+初始/中央记忆(Tn/cm)细胞从tdLNs经血液迁移至肿瘤,并分化为Th1细胞。
免疫微环境的动态变化:
空间共定位:联合治疗组中,扩增的CD4+与CD8+ T细胞更紧密共定位(92.3% vs. 单药组50%,p=0.019),且与表达T细胞趋化因子(CXCL9/10/11)的树突细胞(DCs)和抗体分泌性浆细胞(IgG+)形成免疫枢纽。
B细胞参与:T细胞扩增与IgG+浆细胞扩增显著相关(r=0.892, p=0.001),提示B细胞介导的体液免疫协同增强抗肿瘤响应。
治疗前微环境预测响应:
单药组:治疗前高表达PDCD1(PD-1)的CD8+ T细胞和CXCL9/10+迁移性DCs与T细胞扩增正相关。
联合组:治疗前微环境特征与响应无关,提示抗CTLA4可能通过激活tdLNs中的CD4+ Tn/cm细胞,独立于肿瘤内预存免疫状态。
肿瘤引流淋巴结(tdLNs)的作用:
联合治疗显著增加tdLNs中CD4+ Tn/cm细胞的克隆多样性(p=0.024),并通过TCR追踪证实这些细胞迁移至肿瘤并分化为效应细胞。
抗CTLA4可能直接作用于tdLNs中的Tn/cm细胞,而抗PD-L1主要靶向肿瘤内的PD-1/PD-L1轴。
临床意义
联合治疗优势:抗CTLA4通过激活CD4+ T细胞并促进其从tdLNs向肿瘤迁移,弥补了单药抗PD-L1对CD8+ T细胞的局限性。
生物标志物:CD4+ T细胞激活和tdLNs参与可作为联合治疗响应的预测指标。
治疗策略:保留tdLNs(如未手术切除)可能增强联合治疗的持久性,为临床设计提供新思路。
结论
该研究揭示了抗PD-L1联合抗CTLA4通过激活CD4+ T细胞并招募其至肿瘤的独特机制,为优化免疫联合疗法提供了理论基础。CD4+ T细胞可作为联合治疗响应的标志物,而tdLNs的免疫调控作用为临床实践提供了新靶点。
功能实现
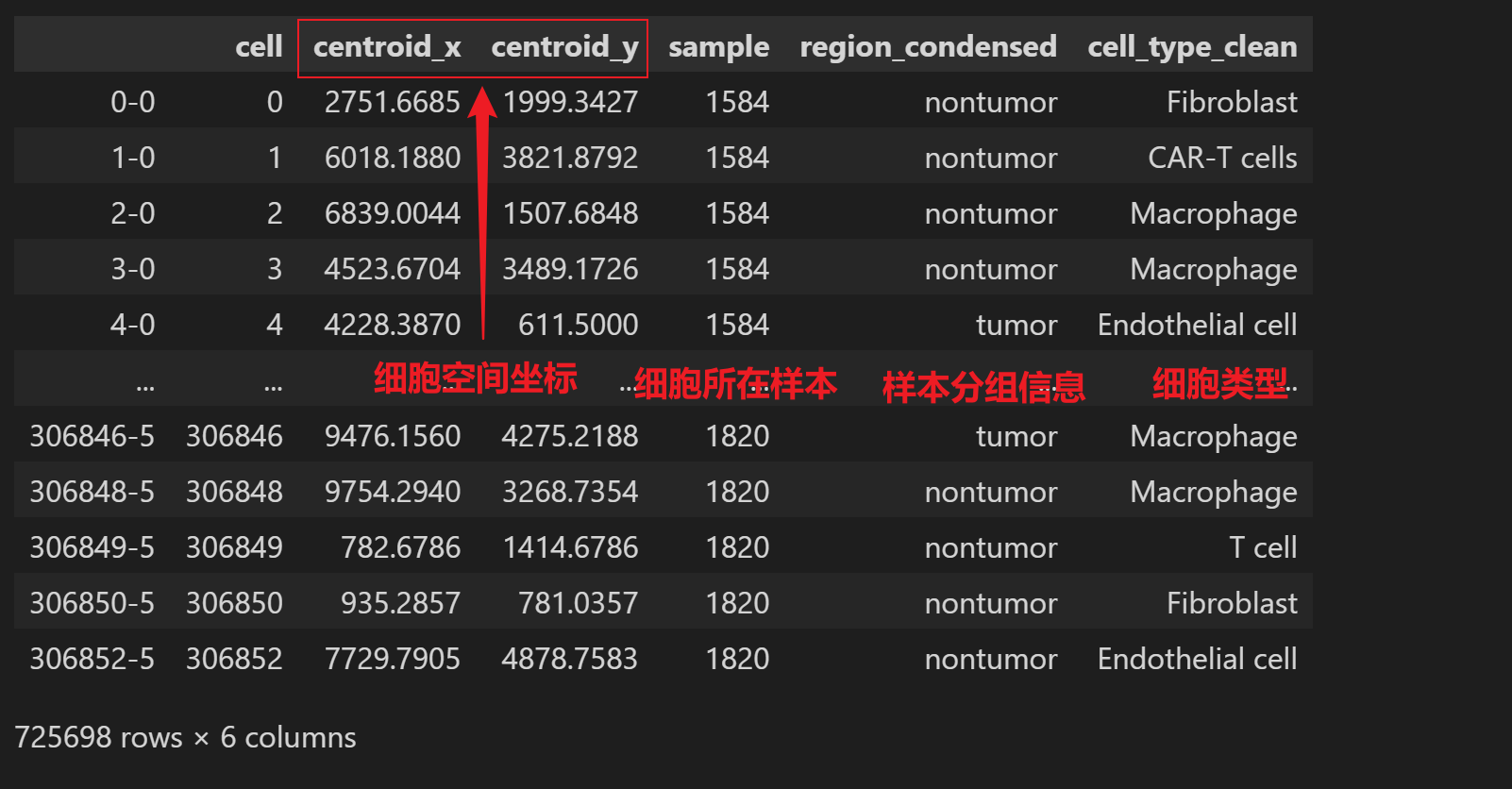
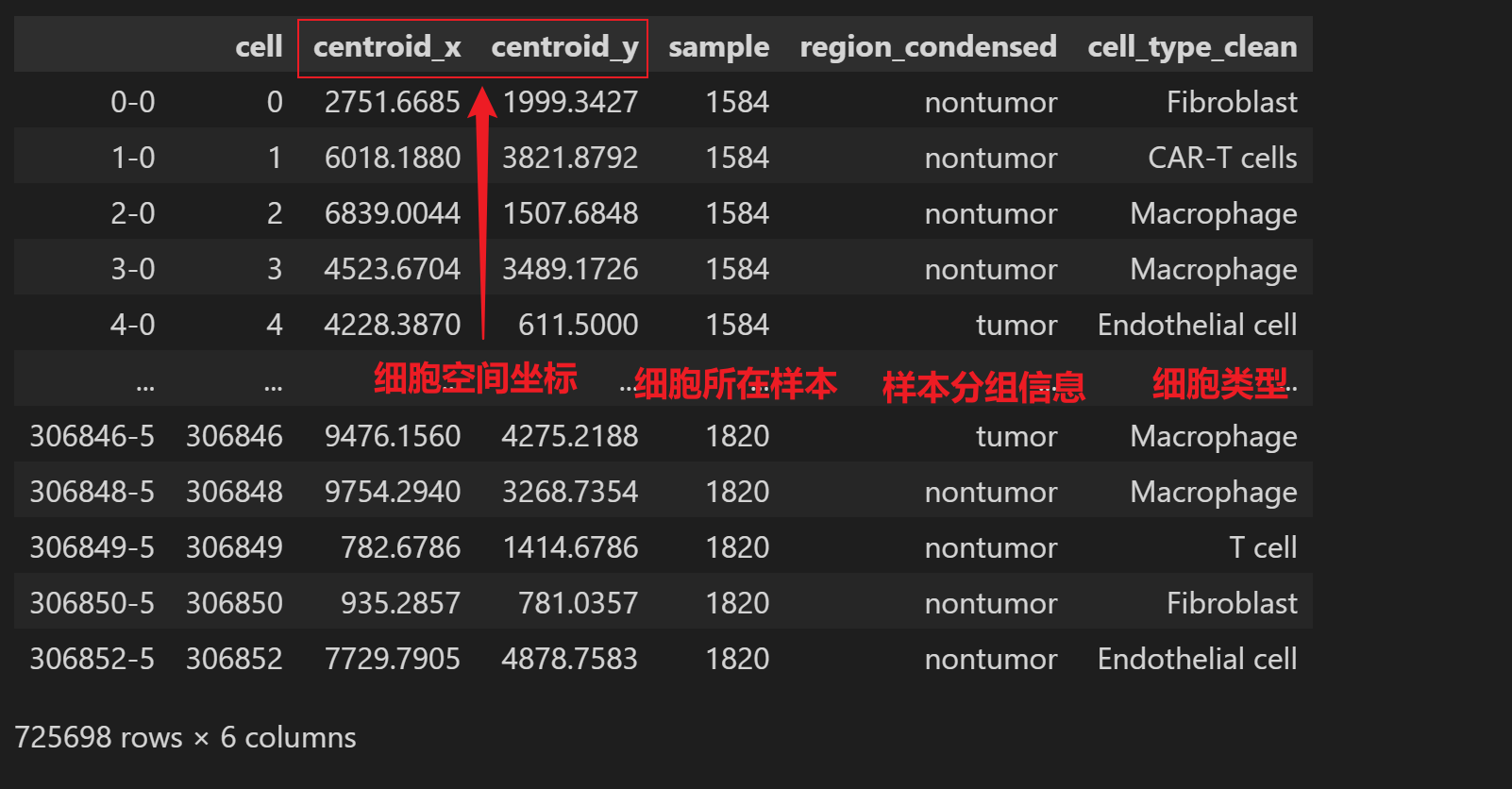
最近邻分析简单理解就是,根据细胞空间坐标判断一个细胞类型周围的最近邻细胞在不同组别间的分布趋势。示例数据如下: 需要的信息有,每个细胞的空间坐标、细胞所在样本名、样本分组信息、细胞类型注释:
输出结果是循环遍历每种细胞类型,展示锚定某一细胞类型后,其他细胞类型在不同分组间的分布趋势
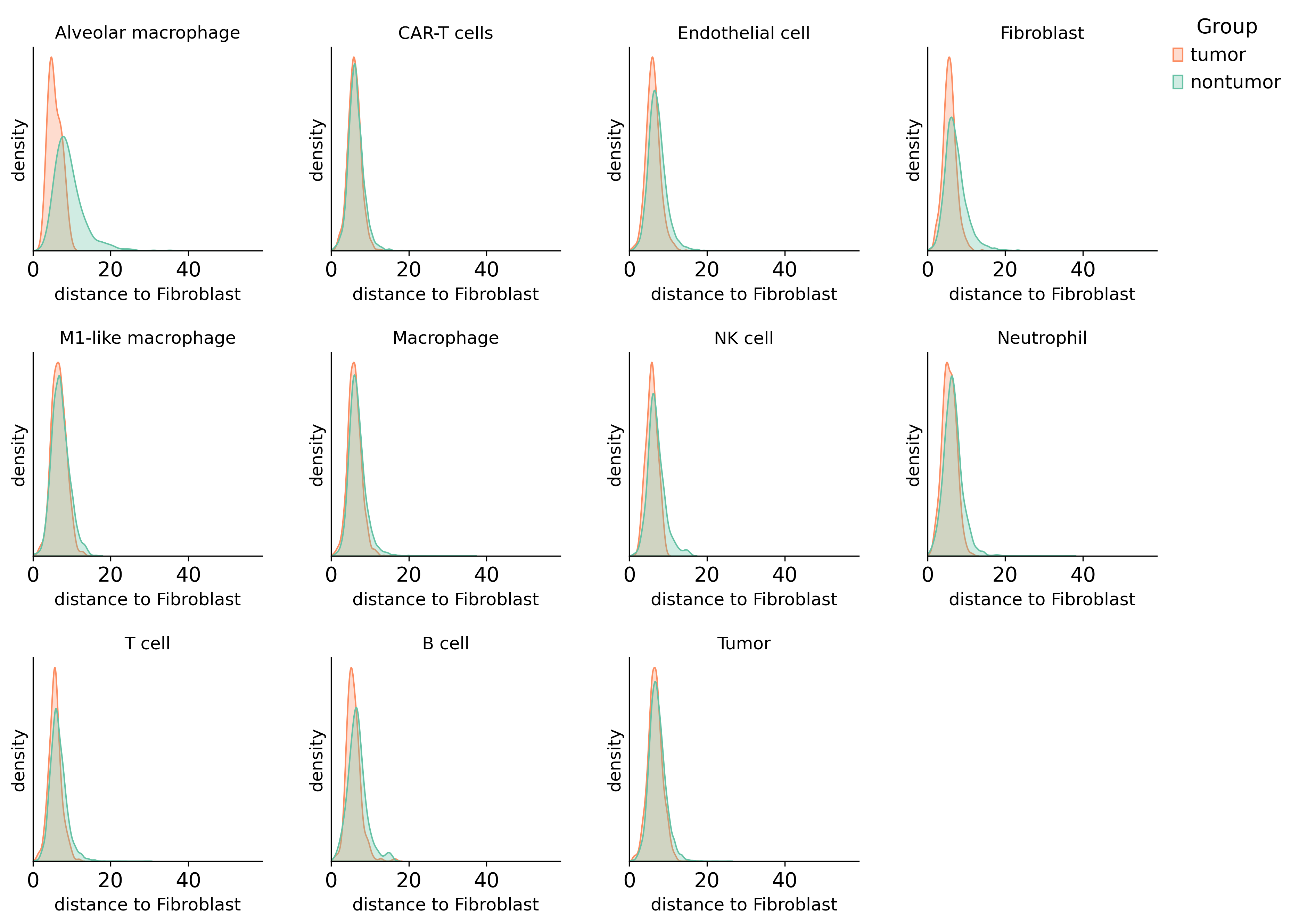
输出对应的统计结果表格(第一列是目标细胞,第二列是离它最近的细胞类型,第三列是这两个细胞之间的距离,第四列是样本名称,第五列是样本分组名称),后续可以其他绘图展示
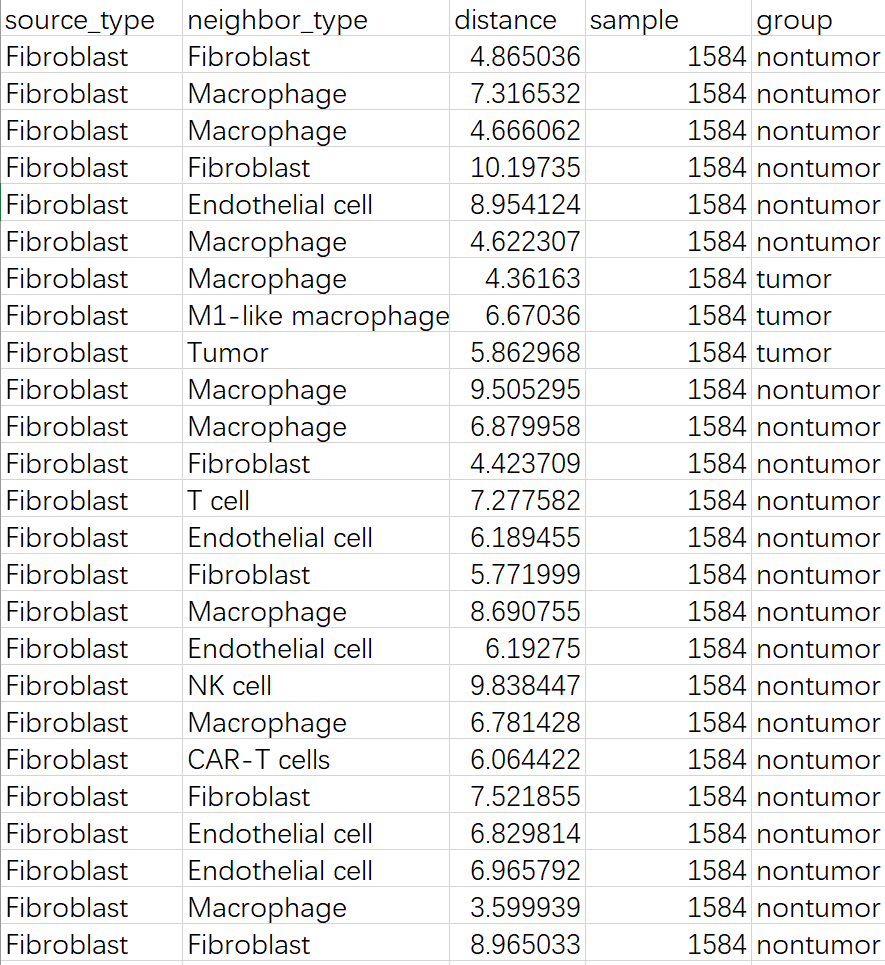
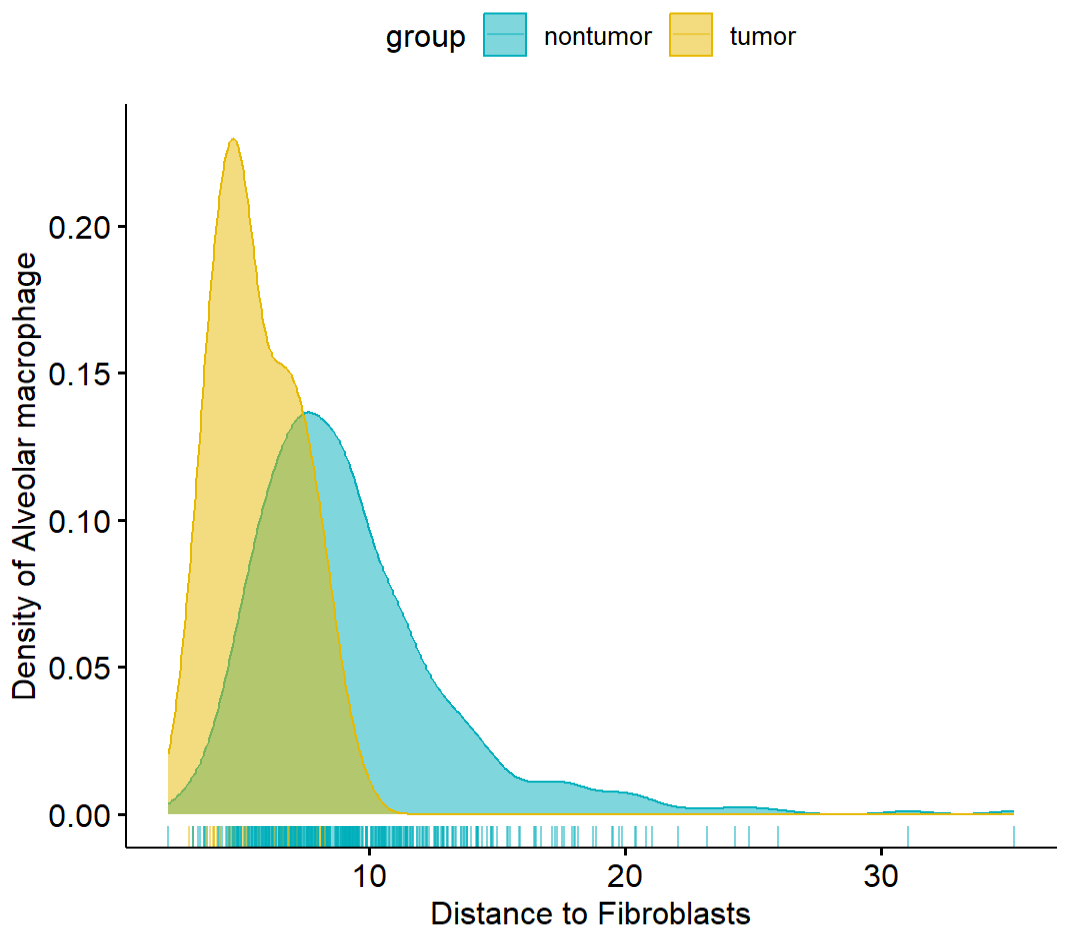
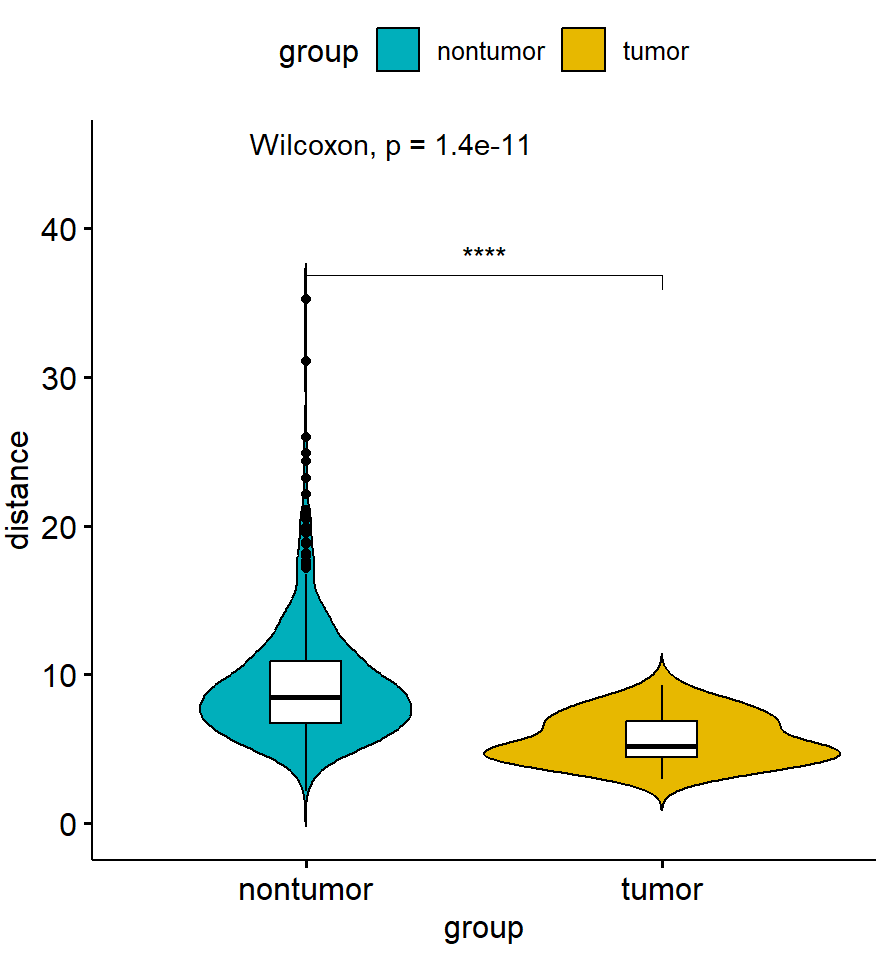
示例:成纤维细胞周围最近邻肺泡巨噬细胞的距离在不同分组间趋势
代码:
import os
import numpy as np
import pandas as pd
import scanpy as sc
import seaborn as sns
from scipy.spatial import KDTree
import matplotlib.pyplot as plt
sc.settings.set_figure_params(dpi=100, dpi_save=200, figsize=(5, 5), facecolor='white')adata = sc.read_h5ad('/mnt/e/空间转录组/scripts/data/xenium_mouse_lung_adenocarcinoma.h5ad')
adata
adata的obs中需要包含的信息:
批量计算所有细胞类型执行函数: 由于空间数据的坐标是以芯片或者样本为一个单元进行标识的,而且从生物学意义上来说,最近邻的空间坐标也只在每个样本内进行计算才有意义(毕竟就算人为把多个样本贴的再近,也不代表任何生物学意义),因此这里一定要在每个样本中计算最近邻才有意义,然后将每个样本的最近邻信息合并即可。
