不确定知识图谱(UKGs)增强中医药大模型:药食同源个性化膳食推荐的智能化新突破

Leveraging Retrieval-Augmented Large Language Models for Dietary Recommendations With Traditional Chinese Medicine's Medicine Food Homology: Algorithm Development and Validation
文章摘要
研究团队开发了Yaoshi-RAG框架,通过构建药食同源知识图谱和检索增强生成技术,显著提升了大语言模型在中医药食同源膳食推荐方面的准确性和可靠性,为传统中医智慧与现代AI技术的融合开辟了新路径。
原文PDF链接: https://t.zsxq.com/wiQZ5
正文
引言:传统智慧遇见人工智能
中医药学中的"药食同源"理念历史悠久,强调某些物质既可作为营养食品,又可作为治疗药物,这一古老哲学在现代医疗保健系统中获得了广泛认可。然而,药食同源原理的实际应用在很大程度上依赖于中医专家的知识和人工解释,这给自动化药食同源膳食推荐带来了挑战。
虽然大语言模型(LLMs)在医疗决策支持方面显示出潜力,但它们在中医药等专业领域的表现往往受到幻觉和领域知识缺乏的限制。为了克服这些局限性,研究团队提出了一个创新的解决方案:将不确定知识图谱(UKGs)与大语言模型通过检索增强生成(RAG)技术相结合,实现了药食同源原理的结构化和忠实表示,同时增强了LLMs理解中医药知识固有不确定性和异质性的能力。
研究方法与技术创新
Yaoshi-RAG框架概述
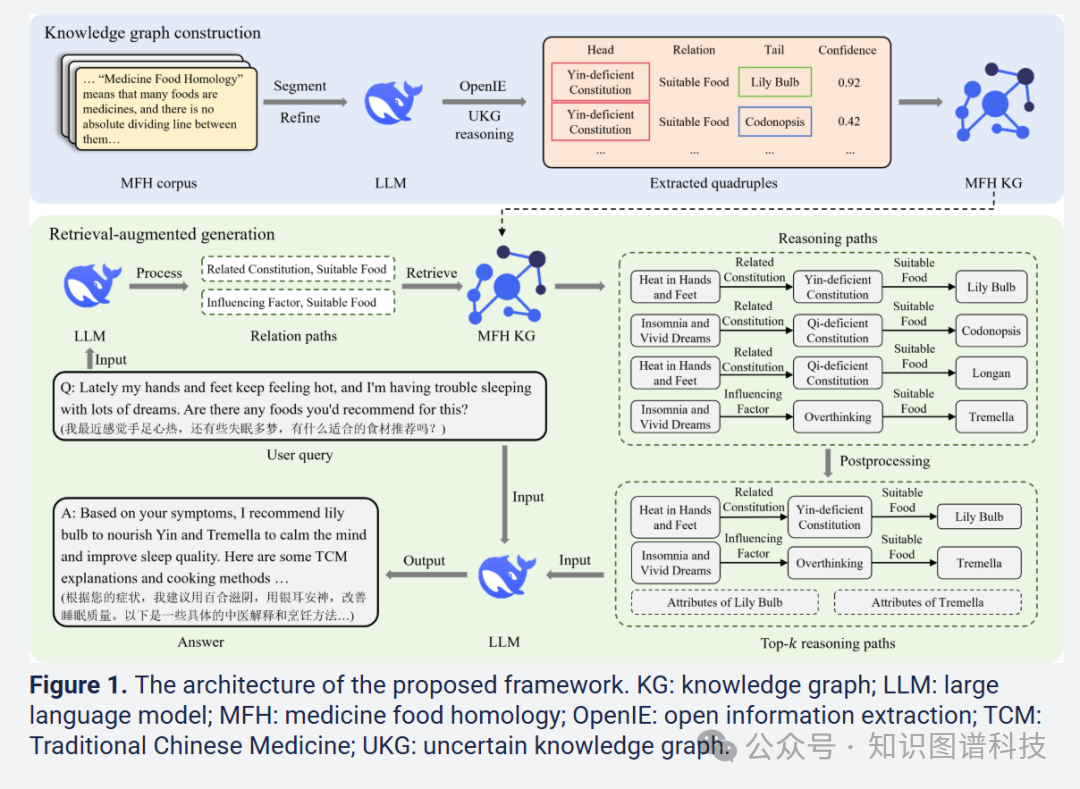
本研究提出的Yaoshi-RAG框架是一个专门设计的RAG框架,旨在增强大语言模型基于药食同源原理生成循证膳食推荐的能力。该框架包含两个核心模块:
-
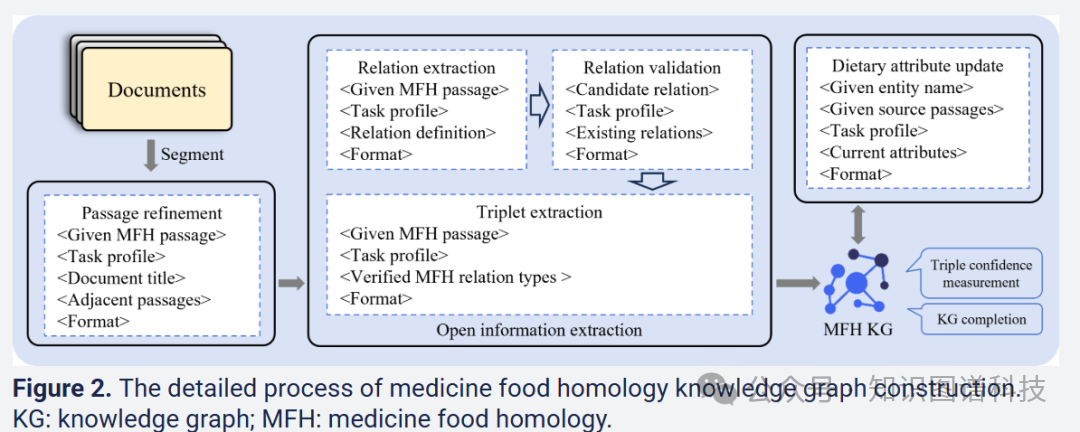
知识图谱构建模块:通过多源数据编译综合语料库,使用LLM驱动的开放信息提取技术构建药食同源知识图谱,并应用不确定知识图谱推理来测量提取三元组的置信度并完成缺失的三元组。
-
检索增强生成模块:在给定用户查询时,框架首先识别并链接查询实体到药食同源知识图谱,然后构建关系路径以便检索推理路径,随后通过后处理(包括排序和过滤)来提取最相关的推理路径,从而提高检索准确性 。
数据来源与知识图谱构建
研究团队系统性地构建了一个包含1359个相关文档的语料库,涵盖古典文献、现代中医文献、食品和草药信息、监管文件、研究论文和中医方剂等多个来源。具体分布如下:
-
古典文献:75篇
-
现代中医文献:228篇
-
食品和草药信息:400篇
-
监管文件:42篇
-
研究论文:432篇
-
中医方剂:182篇

[表格1:1359个文档的统计分布]
为了提高实体-关系三元组提取的效率和准确性,每个文档被分割成300个标记的段落,然后通过精心设计的提示输入到LLMs中,以解决代词指代问题并过滤掉无关内容。
实验结果与性能评估
知识图谱构建成果
构建完成的药食同源知识图谱包含24,984个实体、22种关系和29,292个三元组。这一规模庞大的知识图谱为后续的检索增强生成提供了丰富的知识基础。
模型性能比较
研究团队评估了多个主流大语言模型,包括GPT-4、LLaMA2-Chat-7B、Qwen2.5-7B和DeepSeek-R1。实验结果表明,集成药食同源知识图谱显著提高了LLMs的性能,平均Hits@1提升14.5%,F1分数提升8.7%。
在所有评估的LLMs中,DeepSeek-R1取得了最佳性能,Hits@1达到84.2%,F1分数达到71.5%。人工评估进一步验证了这些结果,确认Yaoshi-RAG在所有评估质量维度上始终优于基线模型。
评估方法
研究采用了自动化评估和人工评估相结合的方式。自动化评估使用了Hits@1和F1分数两个指标:
-
Hits@1测量排名最高的预测推荐与真实答案匹配的查询比例
-
F1分数捕获精确度和召回率的调和平均值,提供平衡的评估
人工评估则弥补了自动化评估的局限性,特别是在评估推荐的有效性、用户接受度和可解释性方面。
答案生成与提示工程
研究团队使用提示工程技术来提高LLM生成答案的准确性和相关性。提示模板包含四个关键组件:
-
任务规范
-
用户查询
-
检索到的推理路径
-
食品和菜品实体的属性

这种结构化的提示促进了外部知识的整合,提高了LLMs对药食同源原理的理解,支持生成更准确的响应。

技术优势与创新点
关键贡献
本研究的主要贡献包括:
-
一个集成框架,利用知识图谱增强的LLMs生成个性化和循证的药食同源膳食推荐
-
一种LLM驱动的开放信息提取方法,用于从异构多源数据自动构建专门针对中医药食同源的不确定知识图谱
-
对几种主流LLMs在药食同源膳食推荐生成方面的系统评估
-
实验结果和案例研究,证明所提出框架在提供个性化和专业药食同源膳食推荐方面的能力
技术创新
通过编码领域特定知识并解决与药食同源相关的不确定性,药食同源知识图谱使LLMs能够提供更个性化、循证和可靠的膳食推荐。通过测量置信度分数,可以更好地管理药食同源原理中的固有不确定性,优先考虑可靠的关系,同时减轻不太可信关系的影响。
研究局限性与未来方向
当前局限性
研究团队诚实地承认了几个局限性:
-
药食同源知识图谱使用开放信息提取构建,可能引入不准确性,无法涵盖药食同源原理的所有知识
-
研究没有专门针对关系路径生成对LLMs进行微调,这可能限制了框架的检索有效性,特别是对于涉及多种症状或条件的复杂案例
未来发展计划
研究团队计划在未来重点关注以下几个方向:
-
实施更有效的知识提取方法
-
通过额外的药食同源文献扩展知识图谱
-
探索优化的检索策略
-
微调开源LLMs以进一步提高生成膳食推荐的准确性和可靠性
结论与意义
本研究展示了Yaoshi-RAG这一新框架,通过整合不确定知识图谱增强了LLMs在生成药食同源膳食推荐方面的能力。该框架利用多步LLM调用进行开放信息提取,自动构建药食同源知识图谱,结合不确定知识图谱推理来测量现有三元组的置信度并完成缺失的三元组。
实验评估证明,DeepSeek-R1是药食同源膳食推荐生成的最佳基础模型。该框架促进了适应个人健康状况和症状需求的膳食推荐,同时考虑多样化的食材和菜品,并提供基于药食同源原理的全面解释。
这项研究不仅为传统中医智慧与先进语言模型的结合提供了有效途径,还为个性化医疗保健和精准营养领域的发展做出了重要贡献。通过将古老的中医药食同源理念与现代人工智能技术相结合,为实现更加智能化、个性化的健康管理开辟了新的可能性。
标签: #药食同源 #知识图谱 #大语言模型 #RAG #中医智能化 #KnowledgeGraph
欢迎加入「知识图谱增强大模型产学研」知识星球,获取最新产学研相关"知识图谱+大模型"相关论文、政府企业落地案例、避坑指南、电子书、文章等,行业重点是医疗护理、医药大健康、工业能源制造领域,也会跟踪AI4S科学研究相关内容,以及Palantir、OpenAI、微软、Writer、Glean、OpenEvidence等相关公司进展。
