羟氯喹通过抑制抗磷脂综合征诱导的绒毛外滋养细胞过度自噬
在妊娠过程中,滋养细胞的分化与功能执行是维持正常妊娠的关键环节:细胞滋养细胞(CTB)可向两个方向分化,一是融合形成合体滋养细胞(STB),构成胎盘屏障并分泌 β- 人绒毛膜促性腺激素(β-hCG)等妊娠维持所需激素;二是分化为绒毛外滋养细胞(EVT),后者进一步分为间质型 EVT(iEVT)与血管内型 EVT(enEVT),其中 enEVT 可侵袭子宫螺旋动脉,替代血管内皮细胞并降解血管平滑肌,使螺旋动脉从高阻力、低容量的收缩状态转变为低阻力、高容量的舒张状态,为胎儿发育提供充足血供。若 EVT 的侵袭能力不足或螺旋动脉重塑不充分,将直接导致胎盘血供障碍,成为 APS 相关 RM 的重要病理基础。
研究显示,APS 孕妇使用 HCQ 后,活产率显著提升,子痫前期、胎盘功能不全及 RM 的发生率降低,但 HCQ 改善 APS 相关不良妊娠结局的具体分子机制尚未明确。已知 HCQ 可通过蓄积于细胞质中调控细胞自噬稳态,而自噬作为真核细胞应对应激(如缺氧、营养缺乏、炎症刺激)的重要生理过程,在滋养细胞增殖、分化及侵袭中发挥双重作用 —— 适度自噬可维持细胞内环境稳定,过度自噬则可能诱导非凋亡性程序性细胞死亡,导致细胞功能障碍。基于此,本研究围绕母胎界面滋养细胞功能、自噬调控及 HCQ 的干预作用展开,旨在阐明 APS 诱导 EVT 功能异常的机制及 HCQ 的调控靶点,为 APS 相关妊娠并发症的研究提供新的实验依据。
本研究的外周血样本采集后置于无菌促凝管,4℃静置自然凝固,3000rpm 离心 30 分钟分离血清,实验前经 56℃水浴 30 分钟灭活,-20℃保存备用。此外,收集胎盘绒毛与蜕膜组织,采集后 1 小时内置于冰浴 PBS 中,随后进行固定处理。
石蜡切片制备过程中,新鲜收集的绒毛与蜕膜组织迅速放入 4% 多聚甲醛(PFA),4℃固定 24-48 小时,PBS 洗涤后经梯度乙醇脱水(50%、70%、80%、95%、100%)、二甲苯透明,石蜡定向包埋,采用石蜡切片机连续切片(厚度 5μm),展片烘烤后室温保存。免疫组化实验中,石蜡切片经二甲苯脱蜡、梯度乙醇水化,3% 过氧化氢灭活内源性过氧化物酶,柠檬酸钠二水合物修复液加热抗原修复,3% 胎牛血清封闭后,加入一抗4℃孵育过夜,次日 PBS 洗涤后加入 HRP 标记二抗室温孵育,二氨基联苯胺显色,流水终止后苏木素染核,脱水封片, Olympus DP72 显微镜采集图像。
细胞实验选用人绒毛膜毛细血管滋养细胞系 HTR8/SVneo 与绒毛膜癌细胞系 BeWo,前者模拟 EVT 的侵袭功能,后者用于模拟 CTB 向 STB 的融合分化过程。HTR8/SVneo 细胞培养于含 10% 胎牛血清的 RPMI-1640 培养基,置于 37℃、5% CO₂培养箱;BeWo 细胞培养于含 10% 胎牛血清的混合培养基(45% 含谷氨酰胺与丙酮酸盐的 DMEM+45% Ham’s F-12 K 培养基),同样条件下培养。APS 血清细胞模型构建:取对数生长期细胞,分别用含 10% 胎牛血清、10% 正常对照血清或 10% APS-RM 血清的培养基处理 48 小时;BeWo 细胞需先经 20mM Forskolin(FSK,DMSO 稀释,1:1000)诱导融合,通过免疫荧光检测 E - 钙粘蛋白分布验证融合效果后,再进行血清处理。所用羟氯喹(HCQ)购自 AbMole(货号 M5159),用 PBS 配制为 100μg/ml 浓度储存,经 0.22μm 滤膜过滤除菌,最终以 0.1μg/ml 浓度对血清处理后的细胞进行干预,观察其对细胞功能的影响。
Western blot 实验中,用含 1mmol/L Na₃VO₄与 1% 蛋白酶抑制剂(AbMole)的 RIPA 裂解液提取细胞总蛋白,通过 BOSTER BCA 试剂盒定量蛋白浓度,根据目的蛋白分子量,取 10μg 蛋白进行 10%–15% SDS-PAGE 电泳,湿转至 PVDF 膜,5% 脱脂牛奶室温封闭 1 小时后,加入一抗4℃孵育过夜,次日 PBS 洗涤后加入 HRP 标记二抗室温孵育 2 小时,采用化学发光底物显影,Syngene GeneGnome XRQ 成像系统采集图像,ImageJ 软件分析目的条带灰度值,以 β-actin 作为内参计算相对表达量。
Transwell 实验用于检测细胞侵袭能力:在 8μm 微孔膜 Transwell 小室上室铺覆 1μg/30μl 去生长因子 Matrigel,37℃孵育 4 小时使其凝固;将各处理组 HTR8/SVneo 细胞消化后,用含 1% 胎牛血清的培养基重悬,每室接种 1×10⁵个细胞,下室加入 600μl 含 10% 胎牛血清的培养基,37℃、5% CO₂孵育 32 小时后,4% 多聚甲醛固定,结晶紫染色,棉签擦拭上室未侵袭细胞,干燥后每室随机选取 5 个 20 倍视野,ImageJ 软件计数侵袭细胞数。同时,将同等数量细胞接种于 96 孔板(3 复孔 / 组),同条件孵育后加入 10μl / 孔 CCK8 试剂(AbMole),孵育 2 小时后酶标仪检测 450nm 吸光度,校准各组细胞增殖差异对侵袭结果的影响。
管形成实验用于评估细胞血管样结构形成能力:96 孔板每孔加入 40μl 去生长因子 Matrigel,37℃孵育 30 分钟凝固;各处理组 HTR8/SVneo 细胞消化后,用含 10% 胎牛血清的培养基重悬至 3×10⁴个细胞 / 100μl,每孔接种 100μl 细胞悬液(3 复孔 / 组),37℃孵育 8 小时后,光学显微镜 4 倍视野下拍照,采用 ImageJ 软件 Angiogenesis Analyser 插件定量分析管腔连接数、网格数及总分支长度。
为明确 APS 中 aPL 的作用靶点,本研究首先通过免疫荧光与免疫组化分析 β₂GP-I 抗原在早孕期母胎界面的分布 ——β₂GP-I 是 aβ₂GP-I 的特异性靶抗原,其表达定位直接决定 aPL 的作用范围。以 KRT7 标记所有类型滋养细胞(CTB、STB、EVT),结果显示,正常早孕期绒毛组织中的 STB、CTB 及蜕膜组织中的 EVT 均表达 β₂GP-I 抗原,免疫荧光半定量分析未发现正常组与 APS-RM 组滋养细胞 β₂GP-I 表达存在显著差异,提示母胎界面所有类型滋养细胞均可能是 aβ₂GP-I 的潜在作用对象,但 β₂GP-I 的表达量并非 APS 病理损伤的关键影响因素。
进一步比较正常组与 APS-RM 组滋养细胞功能差异:绒毛组织中 CTB 与 STB 构成胎盘激素分泌的核心单元,其中 STB 分泌的 β-hCG 是维持妊娠的关键激素。通过 KRT7 标记滋养细胞、β-hCG 标记 STB,结果显示两组绒毛组织结构无显著差异,且 STB 均能正常表达 β-hCG;体外 BeWo 细胞模型中,正常血清与 APS-RM 血清处理后,RT-PCR 检测的 β-hCG(HCGB)mRNA 表达无显著差异,提示 APS-RM 血清对绒毛滋养细胞(CTB、STB)的分泌功能无明显影响,绒毛滋养细胞并非 APS 导致不良妊娠结局的主要作用靶标。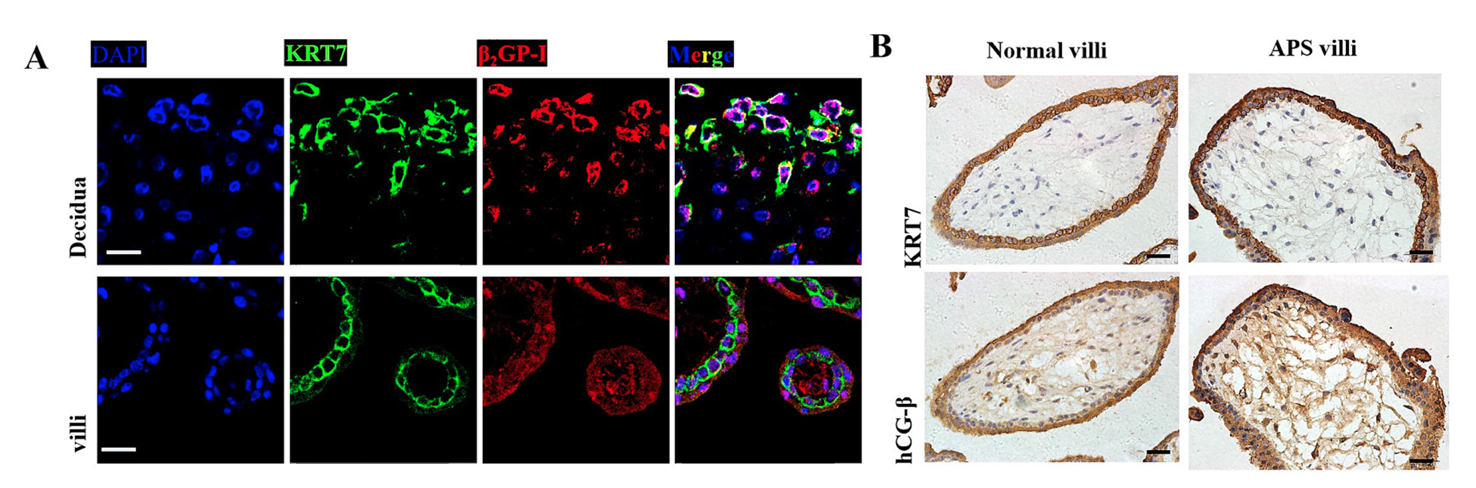
EVT 的侵袭与螺旋动脉重塑功能是评估胎盘发育的核心指标,本研究以 KRT7 标记 EVT、CD31 标记血管内皮细胞,根据血管壁细胞构成将子宫螺旋动脉分为未重塑(Un-Rem,血管壁仍为内皮细胞与平滑肌细胞)、活跃重塑(Act-Rem,EVT 开始替代内皮细胞)与完全重塑(Fully-Rem,EVT 完全替代内皮细胞,平滑肌层降解)三种状态。结果显示,APS-RM 组蜕膜组织中 EVT 对血管内皮细胞的替代显著受限,完全重塑螺旋动脉比例(4.97±5.46%)显著低于正常组(20.65±11.24%,P=0.04),未重塑螺旋动脉比例(65.38±7.55%)显著高于正常组(22.80±6.14%,P<0.001),证实 APS-RM 存在明显的子宫螺旋动脉重塑不足。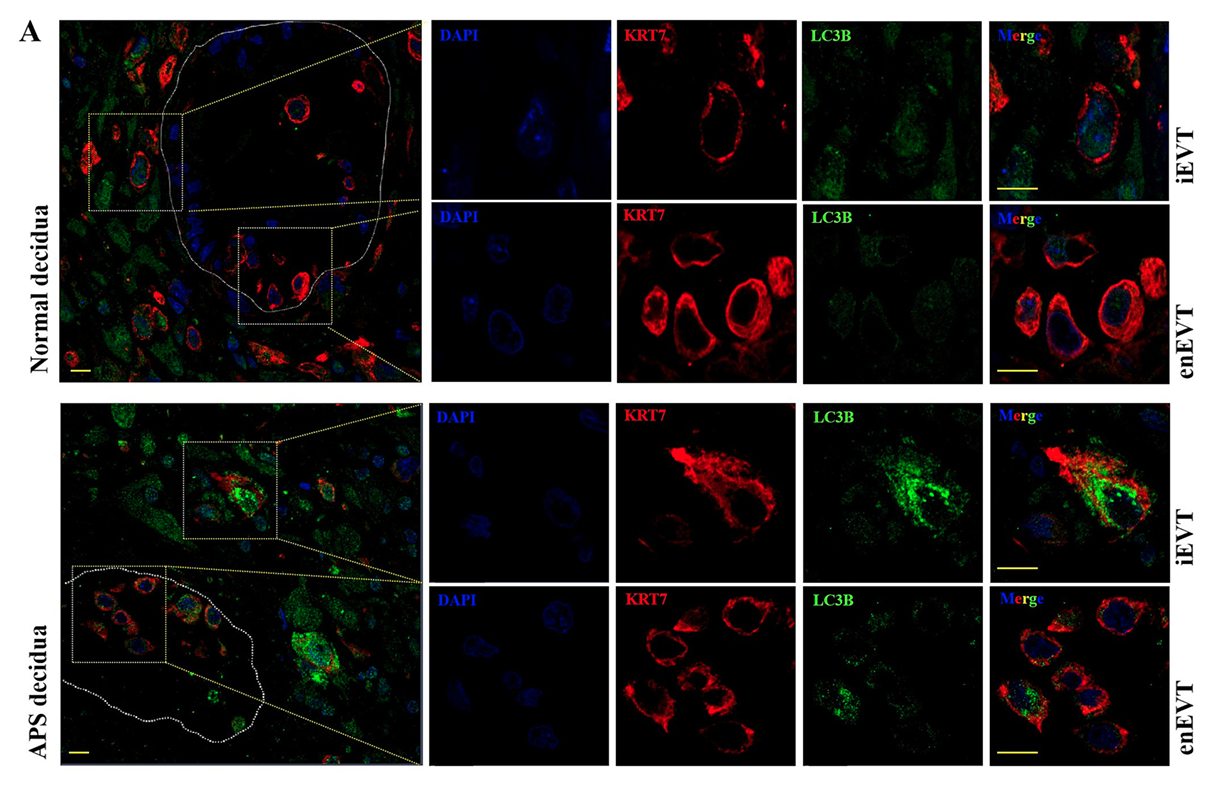
体外 HTR8/SVneo 细胞模型(模拟 EVT 功能)进一步验证 APS 对 EVT 功能的影响:Western blot 结果显示,APS-RM 血清处理后,EVT 侵袭正向调控因子 MMP2、MMP9 蛋白表达显著降低,负向调控因子 TIMP1、TIMP2 蛋白表达显著升高;RT-PCR 结果显示,侵袭负向调控因子 TIMP1、TIMP2、PAI1、KISS1 mRNA 表达升高,正向调控因子 MMPs、CUL3 mRNA 表达降低;Transwell 实验显示,APS-RM 血清处理组侵袭细胞数显著少于正常血清组;管形成实验显示,APS-RM 血清处理组细胞的管腔连接数、网格数及总分支长度均显著减少,上述结果从分子水平与功能水平证实,APS 主要通过抑制 EVT 的侵袭与血管样结构形成能力,导致螺旋动脉重塑不足,进而影响胎盘血供。
鉴于 HCQ 具有自噬抑制效应,且自噬异常与滋养细胞功能障碍密切相关,本研究进一步分析 APS 对 EVT 自噬水平的影响:自噬标志分子 LC3B 在自噬早期会从胞质型 LC3B-I(15kDa)转化为自噬体结合型 LC3B-II(14kDa),LC3B-II/LC3B-I 比值是评估自噬活性的经典指标;p62(SQSTM1)作为自噬底物,其表达水平与自噬活性呈负相关。免疫荧光结果显示,正常组蜕膜 EVT 胞质中几乎无 LC3B 阳性自噬体,而 APS-RM 组 EVT 胞质中可见大量 LC3B 阳性颗粒;Western blot 结果显示,APS-RM 血清处理的 HTR8/SVneo 细胞 LC3B-II/LC3B-I 比值显著高于正常血清组,p62 蛋白表达显著低于正常血清组,提示 APS 可诱导 EVT 过度自噬。
为排除凋亡对自噬结果的干扰,本研究检测了 EVT 凋亡水平:免疫组化显示两组蜕膜 EVT 中 Cleaved Caspase-3 阳性信号无显著差异;RT-PCR 检测显示 APS-RM 血清处理组凋亡相关分子(Cleaved Caspase-3、Caspase-9)mRNA 表达与正常组无显著差异,且与嘌呤霉素诱导的阳性对照相比,APS-RM 血清未显著增加细胞凋亡率,证实 APS 诱导的 EVT 功能障碍主要由过度自噬而非凋亡引起。
基于上述发现,本研究进一步验证 HCQ 对 APS 诱导的 EVT 功能异常的挽救作用:参考既往研究,HCQ 在体外细胞实验中的最高非细胞毒性浓度为 1μg/ml,且孕期 APS 孕妇外周血 HCQ 平均浓度约为 105ng/ml,考虑到 HCQ 可通过胎盘屏障,母胎界面浓度与外周血相当,故选择 0.1μg/ml 作为体外干预浓度。Western blot 结果显示,加入 HCQ 后,APS-RM 血清处理的 HTR8/SVneo 细胞 p62 蛋白表达显著升高,LC3B-II/LC3B-I 比值显著降低,表明 HCQ 可有效抑制 APS 诱导的 EVT 过度自噬;同时,HCQ 干预后,MMP2 蛋白表达显著升高,TIMP2 蛋白表达显著降低,MMP9 与 TIMP1 表达也呈现恢复趋势,提示 HCQ 可通过调节侵袭相关分子表达改善 EVT 功能。
功能学实验进一步证实,HCQ 干预可显著增加 APS-RM 血清处理组 HTR8/SVneo 细胞的 Transwell 侵袭细胞数,提升管形成实验中的管腔连接数、网格数及总分支长度,且 HCQ 对正常血清处理的 EVT 自噬与侵袭功能无显著影响,表明 HCQ 的调控作用具有病理状态依赖性,仅针对 APS 诱导的过度自噬与功能障碍发挥挽救效应。此外,细胞形态观察与 CCK8 检测显示,各组细胞生长速率无显著差异,排除了 HCQ 对细胞增殖的非特异性影响。
本研究通过体内外实验首次证实,APS 血清中的 aPL 可通过诱导 EVT 过度自噬,抑制 EVT 的侵袭与血管样结构形成能力,导致子宫螺旋动脉重塑不足,进而引发不良妊娠结局;而 AbMole 品牌的 HCQ 可通过抑制 EVT 过度自噬,恢复侵袭相关分子(MMP2、MMP9、TIMP1、TIMP2)的平衡表达,挽救 EVT 的侵袭与管形成功能,为 HCQ 改善 APS 相关不良妊娠结局的临床效应提供了分子机制解释。
从生理机制来看,EVT 的适度自噬可通过清除受损细胞器、维持细胞稳态支持其侵袭功能,但 APS 中的 aPL 可能通过与 EVT 表面 β₂GP-I 结合,激活细胞应激信号,打破自噬平衡,导致过度自噬;HCQ 作为经典自噬抑制剂,可能通过干扰自噬体与溶酶体融合,减少自噬底物降解,从而逆转过度自噬对 EVT 功能的抑制。值得注意的是,本研究发现 APS 对绒毛滋养细胞(CTB、STB)的分泌功能无显著影响,进一步明确了 EVT 是 APS 在母胎界面的核心作用靶标,为后续研究提供了精准靶点。
本研究仍存在一定局限:未构建 APS 动物模型验证 HCQ 在体内的自噬调控效应,且未深入探究 aPL 诱导 EVT 过度自噬的上游信号通路(如 NF-κB、mTOR 等)。后续研究可通过构建 aβ₂GP-I 被动转移的 APS 小鼠模型,结合自噬相关基因敲除 / 过表达策略,进一步验证自噬在 APS 病理过程中的因果作用;同时,可通过免疫共沉淀、磷酸化蛋白组学等技术,挖掘 aPL-β₂GP-I 复合物激活的自噬调控通路,为 APS 相关妊娠并发症的研究提供更全面的分子机制支撑。
在实验过程中,AbMole 品牌的 HCQ(货号 M5159)展现出稳定的生物学活性,其配制的工作液经 0.22μm 滤膜过滤后无微生物污染,且在 0.1μg/ml 浓度下可特异性抑制过度自噬而不影响正常细胞功能,为自噬相关体外实验提供了可靠的试剂支持,也为后续类似研究的试剂选择提供了参考依据。
