利用核壳生物支架调控纤维 - 成骨稳态【AbMole】
关键骨缺损指因创伤、肿瘤、感染或先天性疾病后遗症等导致的,无法通过自身修复机制愈合的最小骨缺损,其修复一直是骨科领域的重大挑战。近年来,国际上采用组织工程策略来弥补这一缺陷,旨在制造人工骨移植物或骨生长因子以满足日益增长的临床需求,然而,当前的骨组织再生策略通常只关注骨组织本身,却忽视了关键骨缺损区域早期纤维组织过度生长阻碍骨再生这一问题。
在关键骨缺损区域的骨再生过程中,骨缺损区域纤维组织的生长速度较快,而骨组织的生长速度较慢,新骨组织和新纤维组织的生长速度需维持相对平衡状态才能有效促进正常骨组织再生。若这种平衡被打破,就会导致相应的病理状态,即如果纤维细胞生长过于旺盛,大量纤维组织会填充骨缺损,最终表现为骨折愈合延迟甚至骨不连。为避免过度外在纤维化过程导致的骨不连,本研究设计并制备了由人工骨膜和成骨中心组成的生物支架,该支架能够防止过度纤维化,并促进血管和骨骼的再生。
聚己内酯(PCL)是一种具有良好生物安全性的高分子量材料,已获 FDA 批准用于临床。静电纺丝技术是在强电场中通过射流纺丝聚合物溶液,产生纳米级直径聚合物长丝的技术。通过静电纺丝技术制备的 PCL 纳米纤维具有良好的疏水性,能有效阻断细胞的迁移和占据,物理性阻断外源性成纤维细胞的生长。此外,成纤维细胞活化蛋白抑制剂(FAPI)是成纤维细胞的生长抑制剂,在关键骨缺损区域,FAPI 能有效抑制成纤维细胞生长,促进骨形成。将 FAPI 与 PCL 混合制备的静电纺丝纤维不仅能在物理层面隔离外源性成纤维细胞的生长,还能通过持续释放 FAPI 抑制内源性纤维组织的生长,为成骨修复创造良好的内部环境,本研究中所使用的 FAPI - 4 试剂购自 AbMole。
在骨修复和重塑过程中,H 型血管生成与成骨密切相关。H 型血管是骨中一种特殊的血管亚型,在骨再生中发挥重要作用,其特征是内皮细胞中 CD31 和内皮粘蛋白(Emcn)呈强阳性。血小板衍生生长因子 - BB(PDGF - BB)和 Slit 引导配体 3(Slit3)是 H 型血管诱导的 “血管生成 - 成骨偶联” 效应的重要正向调节因子。Slit3 是来源于成骨细胞的促血管生成因子,受大锌指蛋白 3(SHN - 3)调控,下调 SHN - 3 的表达可增强成骨细胞分泌 Slit3 的能力。目前 Slit3 蛋白的作用方式多为直接递送,但由于其生物半衰期极短,通常需要大剂量或重复递送以维持其有效浓度,这不仅增加了成本,还可能导致异位骨化、癌症风险增加、低血压和水肿等副作用。基因递送可通过靶向骨缺损部位的细胞促进相关蛋白的表达,并随时间持续产生靶蛋白,从而实现长期效应。聚酰胺(PAMAM)树状大分子在基因递送和转染中越来越受到青睐,有报道称胍基苯甲酸(GBA)修饰的第五代 PAMAM(G5 - GBA)具有高细胞内摄取和低细胞毒性的优势。因此,本研究采用编码敲低 SHN - 3 的质粒与 G5 - GBA 结合形成复合物,该复合物可转染成骨细胞以持续产生 Slit3 蛋白。为保护基因免受免疫系统攻击以及血清核酸酶或蛋白酶降解等细胞外屏障的影响,需要选择具有生物安全性和细胞活性的基质作为基因载体。
甲基丙烯酸酐明胶(GelMA)水凝胶因其优异的生物相容性、高孔隙率和细胞外基质结构,被认为是一种优良的生物材料支架。此外,它还保留了明胶细胞相互作用促进基团的 RGD 序列和酶降解性,从而改善细胞粘附、促进细胞生长和增殖、调节细胞活力并促进血管生长。甲基丙烯酸透明质酸水凝胶(HAMA)具有良好的生物相容性和机械强度。研究发现,GelMA 和 HAMA 共交联的复合水凝胶具有低溶胀率、高机械强度和比纯 GelMA 水凝胶更好的生物相容性。因此,GelMA - HAMA 支持的重组质粒能很好地转染成骨细胞,促进靶细胞的粘附和增殖,并提供良好的机械性能。
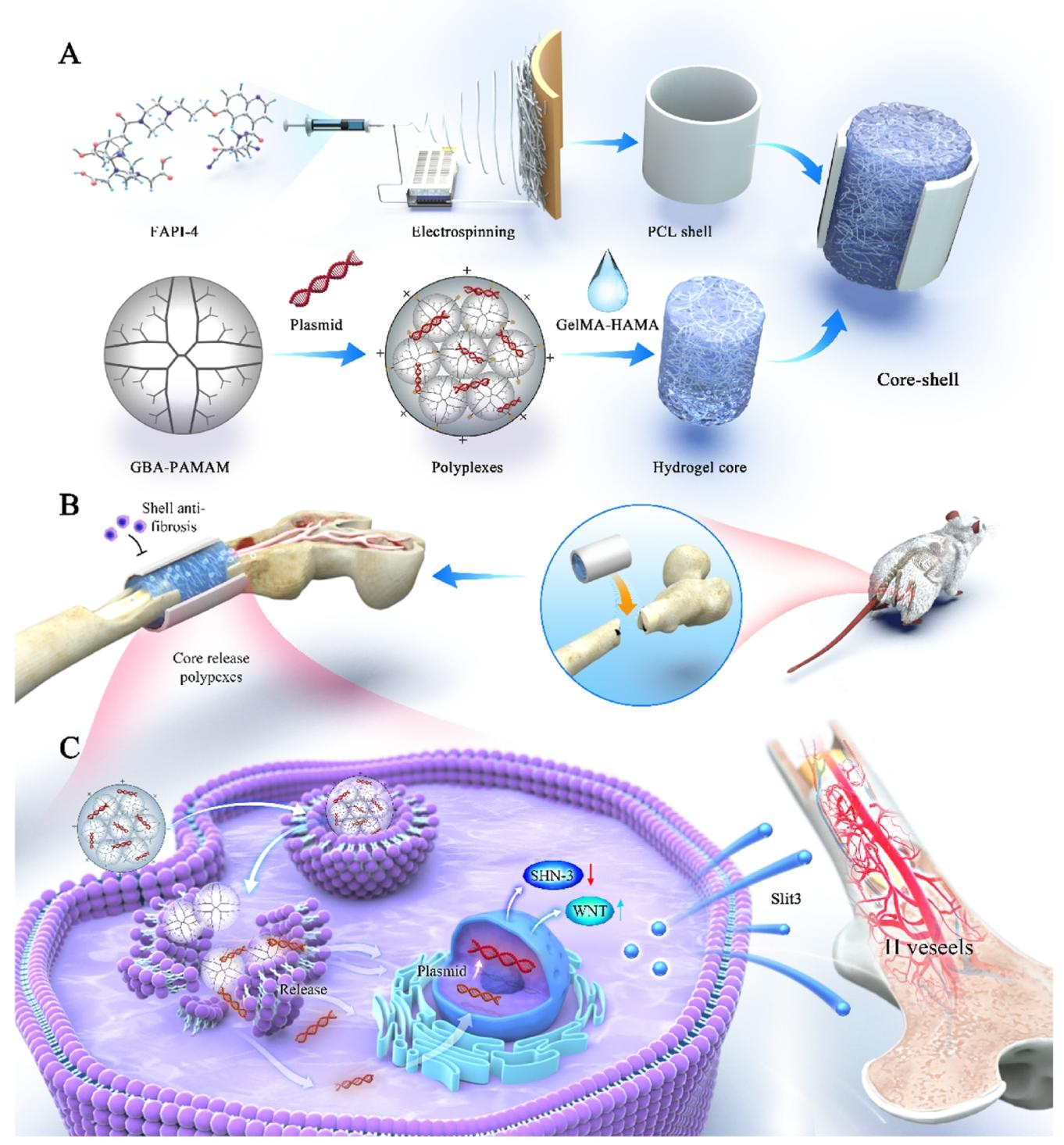
本研究通过静电纺丝和光固化技术将 FAPI 和 GH - GBA@pk SHN - 3 结合到核壳支架中,构建了一个兼具抗纤维化活性并促进 H 型血管化和骨再生的骨单位再生系统。具体而言,该支架由载有 FAPI 的 PCL 静电纺纳米纤维 “壳” 和载有 SHN - 3 基因沉默剂的 GelMA - HAMA 水凝胶 “核” 组成。通过对支架的物理性质、释药行为以及体内外成骨能力的系统表征和生物学验证,证实了调节骨再生过程中纤维生成和骨化的动态过程是治疗关键骨缺损的关键。此外,壳层的静电纺纤维为核层支架创造了良好的内部环境,从而促进成骨修复。在大鼠股骨关键骨缺损模型中,空白对照组的骨缺损处骨皮质不连续,骨缺损被大量纤维组织填充,而 PCL - FAPI/GH - GBA@pkSHN - 3 支架处理组实现了骨缺损的有效修复。本研究旨在为有效且安全的生物活性支架的设计和制造提供新思路,并为关键骨缺损的骨再生提供一种有效的方案。
材料准备方面,聚己内酯(分子量 80,000)、GelMA 和 HAMA、G5 - PAMAM、环状质粒(GFP)构建、FAPI - 4 试剂(AbMole)以及细胞培养试剂、各类染色试剂盒、PCR 和蛋白质印迹相关试剂、转染试剂、ELISA 试剂盒、标记试剂盒和抗体等均按实验需求准备。
核壳结构的制备与表征过程如下:将 0.5g PCL 溶解在 4.5mL 氯仿溶剂中制备 PCL 静电纺丝溶液,并加入 0.1g 二甲基甲酰胺平衡溶液。通过静电纺丝制备 PCL 纤维,在溶解 PCL 的过程中直接加入 FAPI,根据 FAPI/(FAPI + PCL) 质量分数建立不同的载药组,载药组设置为空白组 v/w = 0,0.5‰组 v/w = 0.5‰,1‰组 v/w = 1‰,2‰组 v/w = 2‰。将悬浮液转移到 10mL 注射器针头中,设置高压电极和接收器的电压为 18kV,收集距离为 20cm,流速控制在 2.5mL/h。2 小时后,在铝箔上收集制备的纤维膜,并在真空下干燥过夜。按照先前报道合成 G5 - GBA,通过控制质粒与 G5 - GBA 的 N/P 比(0,1,2,4,…20)制备不同的纳米聚合物溶液。取商用 GelMA 和 HAMA 水凝胶,按 1:1 比例加入纯水浴中溶解(37℃,20% w/v);完全溶解后,加入 0.5% w/v 的苯基(2,4,6 - 三甲基苯甲酰基)次膦酸锂和纳米聚合物,在 405nm 波长的紫外光下固定成凝胶。将 PCL 膜卷成圆柱体并置于特定的圆柱形模具中,水凝胶在紫外光(405nm,30s)下固化形成核壳结构。对样品进行处理后,在扫描电子显微镜下观察 PCL 静电纺纤维和水凝胶的微观形态并分析元素组成,通过 X 射线能谱仪对元素组成进行更精确的定量分析,使用 Avatar 380 红外光谱仪记录材料的傅里叶变换红外(ATR - FTIR)光谱以分析 PCL 静电纺纤维的化学组成和结构,使用水接触角仪测量 PCL 静电纺纤维的水接触角变化,通过 1H NMR 评估水凝胶和 G5 - GBA 的化学修饰,通过透射电子显微镜观察 GBA@pk SHN - 3 复合物的形态,使用 Malvern Zetasizer Nano ZS90 在 25℃下测量 GBA@pk SHN - 3 复合物的粒径和 zeta 电位。
药物释放实验中,制备含 FAPI 的标准溶液,通过高效液相色谱(HPLC)测量吸光度和峰面积,绘制药物浓度的曲线函数。将每个载药支架切成质量为 50 - 100mg 的隔膜,将切好的隔膜放入 2mL 微量离心管中,每管加入 1mL PBS 溶液,置于 37℃的摇床培养箱中。在特定时间节点(1 - 14 天),取出 100μL 溶液并加入等体积的 PBS 溶液,根据每个样品的峰面积计算药物浓度。
细胞实验所用细胞包括成骨前体细胞(MC3T3 - E1)、大鼠成纤维细胞(RAT2)和人脐静脉内皮细胞(HUVECs),所有细胞均培养至第 3 - 5 代用于后续实验。细胞培养基包含 88% 的细胞基础培养基、10% 的胎牛血清和 1% 的青霉素 - 链霉素,细胞在 37℃、5% CO2 和 95% 相对湿度的培养箱中培养,每 3 天更换一次培养基,当细胞达到 80% 贴壁时,用胰蛋白酶消化传代备用。
细胞计数试剂盒 - 8(CCK - 8)测定中,将成纤维细胞和成骨前体细胞分别以 5×10⁴个细胞 / 孔的密度与 PCL 静电纺纤维和 GBA@pk SHN - 3 在 12 孔板中共培养,在 1、3、5 和 7 天后使用 CCK - 8 通过酶标仪测定细胞增殖,测量 450nm 处的吸光度并计算细胞增殖率,实验一式三份。
死活染色实验中,将成纤维细胞和成骨前体细胞分别以 5×10⁴个细胞 / 孔的密度与 PCL 静电纺纤维和 GBA@pk SHN - 3 共培养,然后使用死活染色试剂盒染色,在荧光显微镜下观察,使用 ImageJ 软件分析测量结果,实验一式三份。
抗成纤维细胞粘附实验中,将 PCL 静电纺纤维切成合适大小,置于 Transwell 板的上室,完全覆盖聚碳酸酯膜。将大鼠成纤维细胞(RAT2)以不同亚组接种在 Transwell 上室,密度为 5×10⁴个细胞 / 孔。培养 48 小时后,用 PBS 溶液清洗孔三次,固定,用结晶紫染色,取出聚碳酸酯(PC)膜观察 PCL 静电纺丝对成纤维细胞的透射效果,实验一式三份。将纳米纤维膜上的细胞固定,用罗丹明和 DAPI 孵育,进行细胞骨架和核染色以观察细胞形态和扩散情况,在共聚焦激光扫描显微镜下观察细胞。
细胞免疫荧光实验中,将 RAT2 和 MC3T3 - E1 细胞以 5×10⁴个细胞 / 孔的密度接种到不同处理组中。RAT2 细胞用 PBS、FAPI - 4(2.2μg / 孔)、PCL 和 PCL - FAPI 处理,观察 vinculin 蛋白和 TGF - β1 蛋白的表达;HUVECs 用 PBS、DFO(50μg / 孔)和含 Slit3 的半培养基处理,观察 CD31 蛋白和 Emcn 蛋白的表达;MC3T3 - E1 细胞用地塞米松(10μg / 孔)、PBS、特立帕肽(10μg / 孔)和 pasimd(1μg / 孔)处理,观察胶原蛋白 - 1 蛋白的表达。培养 48 小时后,用 PBS 洗涤细胞三次,在室温下用 4% 多聚甲醛固定 20 分钟,用 0.5% Triton X - 100 通透 20 分钟,用驴血清封闭 30 分钟,然后在 4℃下与指定的一抗孵育过夜,最后在暗处与荧光标记的二抗孵育 1 小时,用 DAPI 染色细胞核后,通过共聚焦激光显微镜系统获取荧光图像。
RT - qPCR 实验中,为检测纤维化相关基因的 mRNA 表达水平,在 FAPI 干预 3 天后,从成纤维细胞中提取总 RNA。测定 RNA 浓度,使用逆转录试剂盒将总 RNA 逆转录为 mRNA。然后,根据预先设计的靶基因引物,使用基因扩增试剂盒扩增并定量靶基因表达,使用 GraphPad 软件进行数据分析,实验一式三份。
蛋白质印迹实验中,将第 3 代 RAT2 细胞以 5×10⁵个细胞 / 孔接种在 6 孔板上,在不同干预下共培养。诱导 10 天后,使用总蛋白提取试剂盒测定各组的蛋白质浓度,上清液在 4℃、12000g 下离心 10 分钟。然后使用 4 - 20% 十二烷基硫酸钠 - 聚丙烯酰胺凝胶电泳分离蛋白质,并转移到硝酸纤维素膜上。将膜封闭 1 小时,然后在 4℃下与一抗(TGF - β1 和 Gapdh)孵育过夜。用含 0.1% 吐温 20 的 Tris 缓冲盐水(PBST)洗涤六次,每次 30 分钟,再孵育 1 小时后,用超敏增强化学发光试剂盒检测免疫反应条带,实验一式三份。
琼脂糖凝胶电泳实验中,通过琼脂糖凝胶电泳(1%,v/w)检测 GBA@pkSHN - 3 质粒的结合能力。在焦碳酸二乙酯处理的水中制备不同 N/P 比(1 - 20)的 GBA@pkSHN - 3 纳米聚合物。设置组别、时间和电压(80kV),使用自动凝胶成像系统分析不同 N/P 比组的核酸显带。
细胞转染和流式细胞术实验中,为研究 GBA@pkSHN - 3 对 MC3T3 - E1 细胞的转染效率,转染前将 MC3T3 - E1 细胞以 5×10⁵个细胞 / 孔接种在 6 孔板中。达到 70% 汇合度后,用 G5 - PAMAM、G5 - GBA 和商用试剂 LipofectamineTM3000 转染成骨前体细胞 24 小时。然后,在明场显微镜下拍摄各组细胞中绿色荧光蛋白(GFP)的表达。使用流式细胞术测量全细胞中 GFP 荧光细胞的比例,分析转染效率,使用 FlowJo 软件分析数据,实验一式三份。
质粒 / 细胞荧光共定位实验中,为研究不同转染试剂在 MC3T3 - E1 摄取中的微观形态,使用 Label IT 核酸标记试剂盒(cy3 试剂盒)用荧光素标记质粒,转染 4 小时后固定,然后用 DAPI 和 FITC - 鬼笔环肽双染。在激光共聚焦显微镜下观察细胞,使用 ImageJ 进行测量,实验一式三份。
ELISA 实验中,为分析 MC3T3 - E1 细胞转染质粒后 Slit3 蛋白分泌的变化,收集质粒干预后的成骨前体细胞的培养基,离心后收集上清液并冷冻备用。每孔加入约 100μL 标准品或样品,密封平板并在 37℃下孵育 90 分钟。用洗涤缓冲液洗涤两次后,每孔加入 100μL 生物素标记的抗体工作液,密封平板并在 37℃下孵育 60 分钟。洗涤细胞三次,每次浸泡 1 分钟。然后,每孔加入 100μL HRP - 链霉亲和素结合物(SABC)工作液,密封平板并在 37℃下孵育 30 分钟。洗涤细胞五次,每次浸泡 1 分钟。接下来,加入 90μL TMB 底物溶液,密封平板并在 37℃下孵育 10 - 20 分钟。加入 50μL 终止溶液后,在紫外分光光度计下测量 450nm 处的吸光度,实验一式三份。
HUVECs 划痕实验、迁移实验和管形成实验中,为分析 slit3 蛋白对内皮细胞迁移能力的影响,将 HUVECs 以 5×10⁵个细胞 / 孔的密度接种在 6 孔板中,当细胞达到 100% 汇合时,用 1000μL 移液管的无菌尖端在每个孔的底部划一条直线划痕。每孔用 PBS 洗涤两次,细胞用不同的干预处理,在 0、24 和 48 小时后拍照。将 HUVECs 以 2×10⁴个细胞 / 孔的密度接种到 Transwell - 24 孔板中,在不同干预因素处理下分析内皮细胞的迁移能力。取出 PC 膜后,在显微镜下观察并拍照,使用 ImageJ 软件进行定量分析,实验一式三份。将 HUVECs 在铺有 Matrigel™的 48 孔板中孵育,密度为 2×10⁴个细胞 / 孔,使用 1:1 比例的用过的培养基和新鲜培养基。培养 24 小时后,用 Calcein - AM 染色每组形成的小管,通过荧光显微镜观察图像,使用 ImageJ 软件进行定量分析。
茜素红和 ALP 实验中,为分析基因干预后成骨祖细胞的成骨表达和矿化能力,将 MC3T3 - E1 以 5×10⁵个细胞 / 孔的密度接种在 6 孔板上。经过不同的干预处理后,在特定时间用 4% 多聚甲醛固定细胞,用茜素红试剂盒和 ALP 试剂盒染色,反复冲洗后,在光学显微镜下观察。
转录组测序(RNA - seq)和生物信息学分析中,根据制造商的说明,使用 TRIzol 试剂从转染的 MC3T3 - E1 细胞中提取总 RNA。评估 RNA 纯度和定量,使用 Agilent 2100 生物分析仪评估 RNA 完整性。使用 VAHTS Universal V6 RNA - seq Library Prep Kit 根据制造商的说明构建 cDNA 文库。在上海奥易生物技术有限公司的 llumina Novaseq 6000 测序平台对文库进行测序。使用 Fastp 软件处理 FASTQ 格式的原始读数,去除低质量读数后获得干净读数用于后续数据分析。使用 DESeq2 软件进行差异表达基因分析,其中满足 q 值 <0.05 且折叠变化> 2 或折叠变化 < 0.5 阈值的基因被定义为差异表达基因(DEGs)。随后,基于超几何分布算法,对 DEGs 进行 GO 和 KEGG Pathway 等数据库的富集分析,筛选具有显著富集功能的条目。使用 R(v 3.2.0)绘制柱形图、弦图或富集分析圈图,以识别具有显著富集功能的条目。
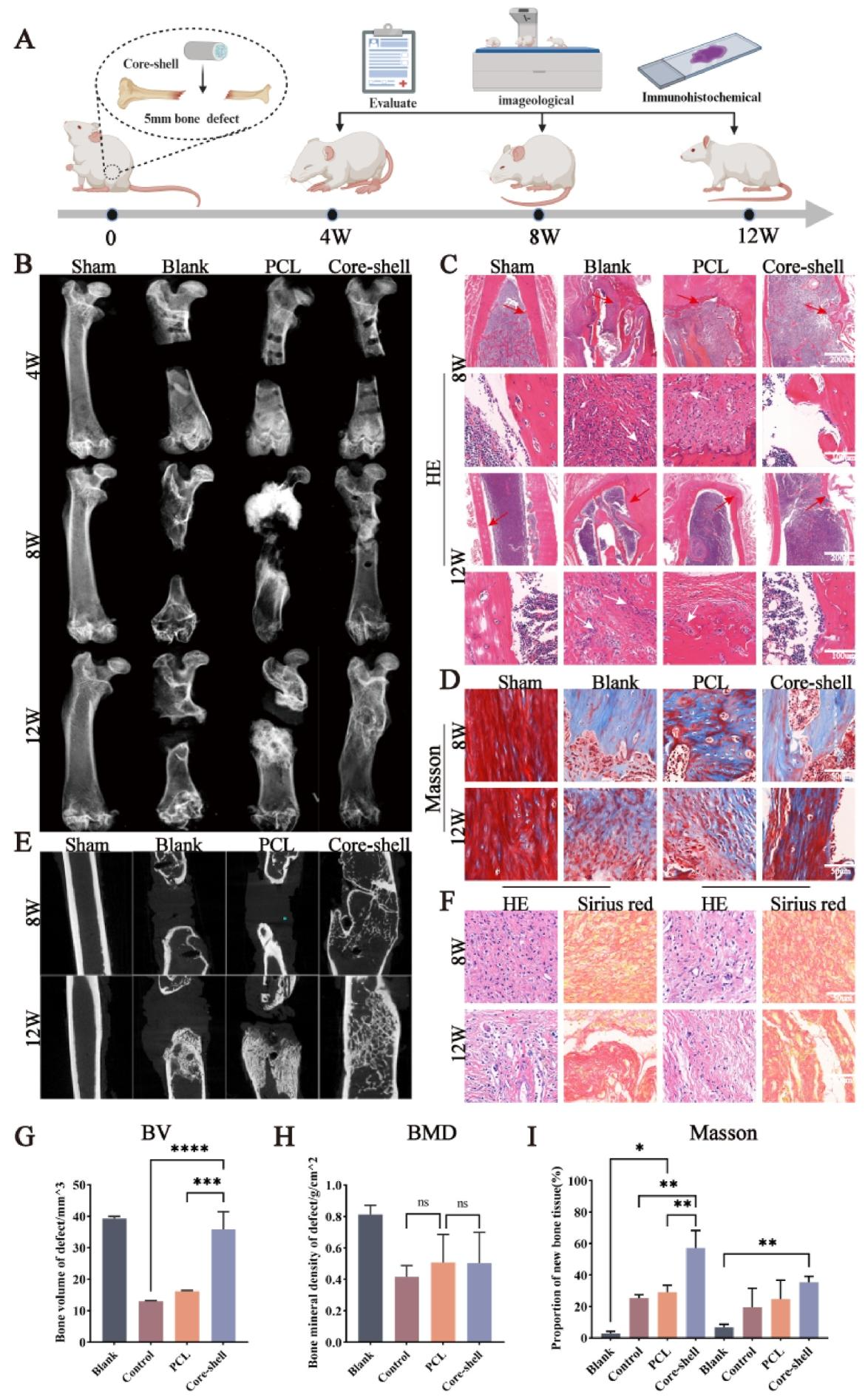
体内实验中,本研究涉及的所有动物实验均经川北医学院附属医院动物实验中心伦理委员会批准(伦理批准号:2021 - 26)。将 36 只 6 - 8 周龄的 Sprague - Dawley(SD)大鼠随机分为以下四组(n = 9 只 / 组):假手术组、空白对照组、PCL 组和核壳支架组。在戊巴比妥钠麻醉(20mg/kg)下,备皮消毒,切开皮肤,分离软组织以暴露股骨。使用线锯在股骨干上制造 5mm 的骨缺损,并用钛合金板和螺钉固定缺损处。根据实验组别,每组植入不同的支架。假手术组不制造骨缺损,空白组不植入生物支架,PCL 组用 7 - 8mm 的 PCL 膜覆盖骨缺损区域,边缘用手术缝合线固定,核壳组用核壳支架填充骨缺损区域。完整的核壳支架直径约 3mm,内部水凝胶核心长度约 5mm,支架外层的 PCL 膜比水凝胶边缘延伸 1 - 2mm,以覆盖缺损的骨折端和与水凝胶连接的区域。每个核壳支架含有 2.2μg FAPI 和 1μg 质粒。术后 4、8 和 12 周,通过过量戊巴比妥钠麻醉处死 SD 大鼠,在无菌条件下迅速取出股骨、肝脏和肾脏,用 4% 多聚甲醛溶液固定备用。
Micro - computed tomography 评估(Micro - CT)中,术后 4、8 和 12 周处死大鼠,将收集的股骨用 4% 多聚甲醛固定,用 Micro - CT 系统扫描。每个样品以 18μm 像素分辨率、100kV 电压和 80μA 电流扫描。使用 Dataviewer 和 CTAn 软件生成的 3D - CT 模型,选择皮质骨缺损区域作为感兴趣区域(ROI),分析比较各组的新骨相关指标(BV、BMD)。
组织切片免疫荧光实验中,收集包括缺损区域的完整股骨样本,固定,脱钙,将脱钙的骨嵌入 8%(w/v)明胶、20% 蔗糖和 2% 聚乙烯吡咯烷酮的混合物中进行组织固定。使用低温恒温器获得 70μm 厚的冷冻切片。孵育前,骨切片用 0.3%(v/v)Triton X - 100 渗透 10 分钟,用 5%(vol/vol)FBS 白蛋白溶液封闭非特异性抗原 60 分钟。切片在 4℃下用 3% BSA 稀释的一抗孵育过夜,用 PBS 洗涤切片三次,每次 5 分钟,用 3% BSA 稀释的相应二抗在 25℃下孵育 75 分钟,最后将切片放在封固剂中,盖上盖玻片,使用荧光显微镜观察并获取图像,使用 ImageJ 软件分析每个标本中 H 型血管的阳性面积。
统计分析中,所有统计分析均使用 SPSS23.0 和 GraphPad Prism 9 进行。两组之间的统计差异采用独立样本 t 检验,多个数据集采用单因素方差分析(ANOVA)。数据以平均值 ± 标准差(SD)表示,当 P<0.05 时,差异被认为具有统计学意义。
实验结果显示,核壳支架及其组成部分的物理性质方面,PCL 静电纺纳米纤维的直径集中在 200 - 500nm 范围内,具有良好的各向异性,能很好地阻止细胞和组织的生长。在核壳支架中,静电纺丝和水凝胶通过物理渗透很好地结合,静电纺丝和水凝胶的界面之间没有分离。通过映射、扫描和 XPS 分析纳米纤维膜上不同元素的含量,在纳米纤维膜表面可以看到元素 F,证明药物 FAPI - 4 成功负载在静电纺纳米纤维膜上。使用傅里叶红外光谱发现不同的载药比例对静电纺丝表面的官能团没有影响。水接触角测量仪的数据显示,最大载药比例的 PCL 膜的水接触角(110±0.8°)小于单纯的 PCL 膜支架(120±0.4°),但总体变化不大,仍保持良好的疏水性。通过 HPLC 测量静电纺膜中 FAPI - 4 的释放曲线,FAPI - 4 的累积释放在 2 周内达到 > 90%。通过 SEM 观察水凝胶的微观结构,水凝胶由 GelMA、HAMA 和 GelMA - HAMA 组成,不同成分的水凝胶具有不同的空隙,GelMA 水凝胶的孔隙较大,而 GelMA - HAMA 水凝胶的孔隙较小,经测量分析,GelMA - HAMA 水凝胶的孔径集中在 50μm 左右。通过 1H NMR 光谱证实了 GelMA - HAMA 的成功制备并保留了甲基丙烯酸酯功能分子。
生物相容性方面,将成纤维细胞接种在 PCL 膜表面共培养,以研究 PCL 膜的疏水表面对细胞活力的影响。当成纤维细胞在不同载药比例的静电纺膜上共培养时,活细胞数量增加,几乎没有死细胞,表明 PCL 静电纺膜具有良好的生物相容性。在共聚焦激光扫描显微镜下观察纳米纤维膜上细胞的 3D 层扫描图像,成纤维细胞生长到静电纺丝内部,并表现出细胞形态的变化。随着静电纺丝中载药量的增加,成纤维细胞的增殖率受到抑制。为了平衡支架的生物学作用和生物相容性,选择载药量为 1‰的静电纺丝膜进行后续实验。将不同 N/P 比的复合物与成骨前体细胞共培养,共培养完成后,对细胞进行活细胞染色,在荧光显微镜下观察,结果显示随着 N/P 比的增加,复合物的毒性增加。同时,较高 N/P 比的复合物对成骨前体细胞的增殖影响较大。为了平衡支架的生物学作用和生物相容性,选择 N/P 比为 12 的复合物进行后续实验。
细胞抗纤维化实验中,PCL 静电纺丝的物理屏障作用通过体外建立成纤维细胞迁移模型模拟 PCL 膜对成纤维细胞的阻断作用,在有 PCL 静电纺膜屏障的 Transwell 小室中,几乎没有细胞能够通过膜屏障,这是由于纳米纤维的微纳米孔隙和致密结构所致。在没有 PCL 纳米纤维膜屏障的 Transwell 小室中,成纤维细胞可以很容易地通过 PC 膜。对各组 PC 膜上的细胞数量进行统计分析,差异具有统计学意义。将成纤维细胞接种在静电纺丝膜上共培养,2 天后,对静电纺丝膜进行活细胞染色,在共聚焦激光扫描显微镜下观察,细胞似乎集中在 PCL 纳米纤维膜的表面,难以进入更深的纤维膜内部。
PCL 静电纺丝抑制纤维组织形成相关基因和蛋白的表达,对各处理组的 vinculin 和 TGF - β1 蛋白进行染色发现,空白组的成纤维细胞增殖水平最高,细胞形态最佳,成纤维细胞的表达最丰富。在 PCL - FAPI 组中,细胞形态不规则,细胞数量受到抑制,粘着斑和 TGF - β1 抗体的表达最弱。各组之间的荧光面积和强度存在统计学差异。在空白组和 PCL - FAPI 组中进行 RT - PCR 和蛋白质印迹,PCL - FAPI 组中 TGF - β1、Smad1 等成纤维细胞相关基因或蛋白的表达显著降低,这种表达差异具有统计学意义。
复合物的转染过程以及成骨和血管生成方面,改性阳离子聚合物 G5 - PAMAM 结合质粒的示意图显示,当 N/P 比 > 4 时,TEM 下可观察到 1 个均匀的圆形复合物。此外,1% 琼脂糖凝胶电泳显示 4 级通道后通道中几乎没有核酸显带,因为阳离子聚合物与 DNA 片段结合良好,很少有核酸片段逃逸。动态光散射仪测量验证了复合物的粒径测量和 Zeta 电位变化。使用不同的转染试剂(LipofectamineTM3000、G5 - PAMAM、GBA - G5)结合质粒转染成骨前体细胞,2 天后,在荧光显微镜下记录 GFP 蛋白的表达,通过流式细胞术鉴定 GFP 阳性细胞的表达比例。可以看出,用改性 GBA - G5 转染的 MC3T3 - E1 细胞具有最高的 GFP 荧光蛋白密度和最高比例的 GFP 阳性细胞。统计分析显示,Lipofectamine、G5 - PAMAM 和 GBA - G5 的平均转染效率分别为 10%、15% 和 20%,GBA - G5 具有最强的转染效率,这是由于改性胍基具有很强的破膜作用。为了探索各种转染试剂递送的质粒的微观外观,用 Cy3 荧光素标记质粒的末端,转染 4 小时后,质粒集中在细胞周围,用 GBA - G5 转染的质粒具有良好的破膜效果,并被细胞有效摄取。
敲低 SHN - 3 基因的细胞中基因的变化,使用大鼠同源 Slit3 蛋白 ELISA 试剂盒测量转染细胞培养基中 Slit3 蛋白的表达,敲除细胞分泌更多的 Slit3 蛋白。用 RT - qPCR 检测敲除细胞中 SHN - 3 基因的表达,其表达显著降低。
Slit3 蛋白促进 H 型血管生长,为分析 Slit3 蛋白对血管内皮生长的影响,用转染的细胞培养基(半交换液)干预 HUVECs,分析其对血管内皮细胞迁移和管形成的影响,Slit3 蛋白干预后血管内皮细胞的迁移和管形成能力增强,与空白组相比差异具有统计学意义。为了分析内皮细胞中 H 型血管生长的特征性表达,对干预后的这些细胞进行 CD31 和 Emcn 抗体染色,未干预因素处理的细胞中这些抗体的表达较弱,去铁胺(DFO)处理的细胞中 CD31 的表达较强,Slit3 处理的细胞中 CD31 和 Emcn 的表达较强,荧光面积和荧光强度的分析显示差异具有统计学意义。
基因敲除细胞的成骨和矿化能力增强,对各处理组成骨前体细胞的 I 型胶原蛋白进行染色,地塞米松干预细胞中 I 型胶原蛋白的表达受到抑制,特立帕肽处理的细胞和敲除细胞中 I 型胶原蛋白的表达增强。对空白组和敲除基因细胞进行茜素红和 ALP 染色,结果显示敲除基因细胞中的钙沉积和 ALP 表达增强。
鸣谢:FAPI-4 | 2374782-02-0 | AbMole
RNA - seq 分析敲除细胞中成骨、矿化和血管营养因子分泌的基因变化,通过对敲除的成骨前体细胞的基因进行测序,GO 细胞功能分析发现与骨骼系统发育、骨重塑中的骨化、血管发育和 Wnt 信号相关,通路相关基因的上调存在显著差异。对差异基因的 KEGG 通路富集进一步分析显示,Wnt 信号通路位于差异基因富集通路的前 10 位。促血管生成因子表达的检测显示,只有 Slit3 基因在敲除细胞中表现出较高且稳定的水平。上述数据表明,敲除后的成骨祖细胞增强了与 Wnt 信号通路相关的成骨和矿化能力,并增强了成骨祖细胞的 slit3 分泌能力。
支架的体内成骨能力方面,所有 SD 大鼠随机分为 4 组:假手术组、空白对照组、PCL 膜组和核壳组。适应性喂养 1 周后,四组大鼠均接受手术,在股骨诱导 5mm 的关键骨缺损。支架植入后,在 4、8 和 12 周进行安乐死。大鼠股骨的放射学和 micro - CT 结果显示,在每个时间点,与空白组相比,核壳组的新骨组织体积显著增加,此外,新骨的骨体积(BV)和骨矿物质密度(BMD)增加,这些结果与体外实验结果一致。
通过组织切片进一步确定体内抗纤维化和促进骨再生的作用,在植入固体支架的两组大体组织样本中,有一些膜组织残留,但未发现水凝胶残留。SD 大鼠股骨骨缺损的苏木精和伊红(H&E)染色结果显示,空白组和 PCL 组的股骨断端在 8 周后闭合,骨再生过程暂停,因为骨折端的软组织阻碍了骨修复过程。空白组和 PCL 组的骨缺损在各个时期都比核壳组产生更多的新纤维组织,Masson 三色染色的结果证实了这一点,核壳组的股骨关键缺损在 8 周时达到骨愈合。
通过组织免疫荧光观察大鼠股骨新骨中 H 型血管的再生,4 周时,空白组和 PCL 组的骨再生组织中分布着散在的 H 型血管,8 周时,骨再生组织中 H 型血管的表达降低。在 4 周和 8 周时,核壳组的 H 型血管均高于对照组、空白组和 PCL 组。
通过对四组 SD 大鼠的主要器官(肝脏和肾脏)进行 H&E 和 Masson 三色染色观察,进一步验证 PCL 复合支架植入大鼠的生物安全性,在研究结束时,任何器官均未发现坏死和 / 或炎症等明显的病理变化,基于这些结果,本研究得出核壳支架在体内具有良好的生物相容性的结论。
综上所述,本研究构建了一种基于抗纤维化和促进 H 型血管化的多功能核壳生物支架,即 PCL - FAPI/GH - GBA@pkSHN - 3。该生物支架的 PCL - FAPI 部分能够降低骨缺损区域纤维的生长速度,阻止骨缺损周围软组织的生长,避免外源性纤维对骨再生的影响。支架中的 GBA@plasmid - knockdown SHN - 3 可以增强成骨前体细胞的矿化和成骨能力,促进骨再生组织的 H 型血管化等功能。本研究结果表明,纤维 - 成骨稳态调节理论以及基于该理论构建的生物支架有望成为促进关键骨缺损骨组织再生的新策略。
