标注可用于IP≠实战可用——超50%的IP抗体实际效果欠佳,如何实现0风险IP实验?
一、超过50%的IP抗体实际表现不尽如人意
2008年,一项大规模基于抗体的蛋白质组表达谱研究从51家不同抗体供应商处共收集了5436种外部抗体,并对其进行了后续验证。结果显示,其中仅有1410种单克隆抗体和1316种多克隆抗体通过了基于蛋白质印迹法(Western Blot)和组织微阵列免疫组织化学法(IHC)的标准化验证占比50%。
2023年,Riham Ayoubi等研究人员利用亲本及敲除细胞系,对65种蛋白质对应的614种商业抗体,进行了系统性性能评估。在免疫沉淀(IP)实验中,多克隆抗体、单克隆抗体和重组抗体的靶蛋白检测率分别为39%、32%和54%。
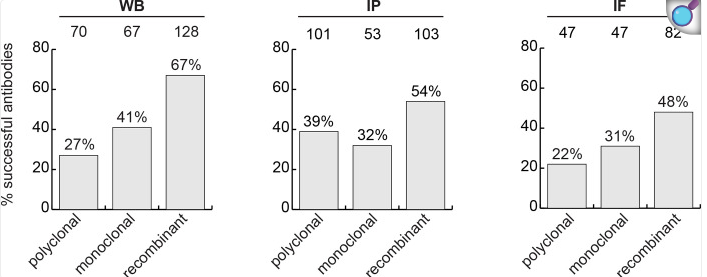
2024年,Nature以新闻报道形式指出,博士后Carl Laflamme测试了16种商用抗体,这些抗体均声称可识别其目标蛋白——由C9ORF72基因编码的蛋白。然而实际验证中,仅有3种抗体表现良好。(引人深思的是:当时没有一篇已发表研究使用了这三种有效抗体,反而有15篇累计引用超过3000的论文所使用的抗体,在实际测试中无法识别目标蛋白。)
抗体验证常用策略
❶ 使用特异性去除目标蛋白的阴性样本(如CRISPR-Cas9敲除样本)作为对照;
❷ 采用不依赖抗体的正交验证手段,如质谱中的PRM靶向检测;
❸ 利用识别不同抗原表位的独立抗体,在表达水平不同的多种样本中进行交叉验证;
❹ 将目标蛋白与标签融合表达,采用标签抗体或荧光检测评估其特异性;
❺ 结合免疫沉淀与质谱分析(IP-MS),根据目标蛋白是否被显著富集来评估抗体特异性。
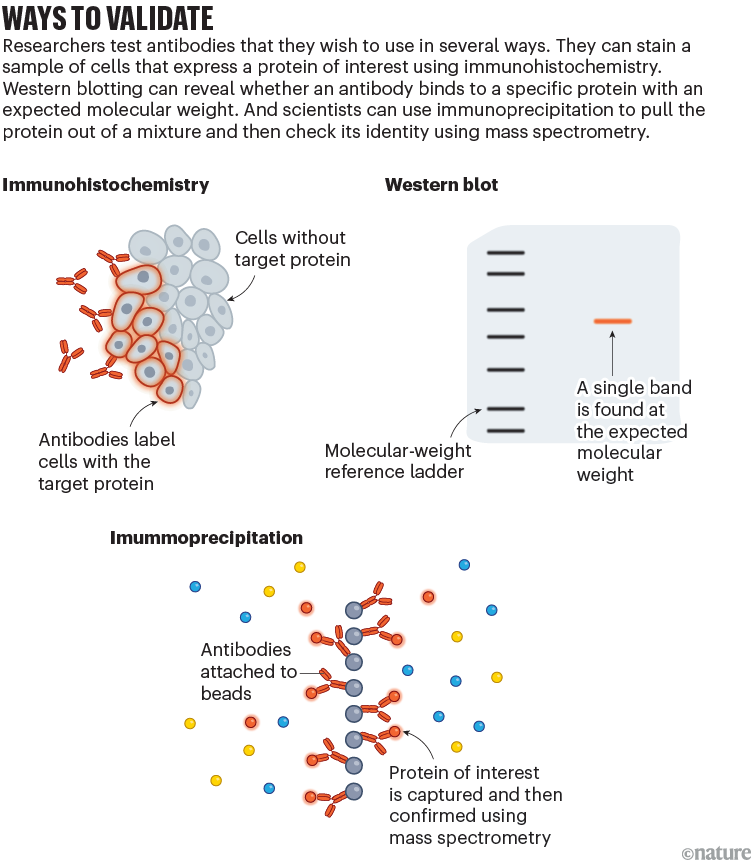
二、WB不能全面评估IP抗体质量的原因
在完成IP实验后,有经验的研究者通常会使用目标蛋白抗体对IP产物进行WB分析,以评估实验效果。通常至少设置三个泳道:input组(细胞/组织裂解液)、IP组以及对照组(IgG/空载组,依据实验组)。一般认为,若input与IP泳道出现清晰的单一目标条带,且与对照组存在明显差异,则表明抗体效果良好。
然而,符合该理想标准的情况并不多见。更值得注意的是,即便WB结果理想,IP产物经质谱检测后未检出诱饵蛋白的现象也时有发生。这是因为仅凭WB并不能全面评估抗体在IP实验中的表现。因此,我们通常建议研究者在WB中只要可见目标条带即可推进后续验证,无需苛求完美条带。
具体原因如下:
❶ WB结果易受抗体轻重链条带干扰;
❷ 条带可能来源于分子量相近的非目标蛋白;
❸ WB通常在蛋白质变性条件下进行,抗原呈非天然构象,无法反映生理状态或IP结合情况;
❹ WB具有抗体级联放大效应,即使目标条带可见,其实际含量可能极低,IP实验中并未实现有效富集。此时建议辅以考/银染结果,确认是否存在明显目标条带且与对照差异显著。
三、如何实现IP实验“0风险”?
作为一家专业的质谱服务公司,我们已为全国数百个课题组提供IP实验支持。服务数据显示,不同课题组之间的实验效率存在显著差异:首次独立开展IP实验即获得理想结果的研究者不足半数。尽管有研究材料与目标各不相同,但缺乏经验仍是主要原因。绝大多数研究者在专业指导下通过实验优化,最终都可以成功获取可靠数据。IP实验的主要风险包括未能获得有效数据,以及在低质量数据基础上持续投入资源。解决之道在于实验前的系统性质控与实验后的数据评价。
1. 经费投入未能获得有效数据
能够及时识别实验问题,从某种角度而言是“幸事”,至少可避免在未知无效的情况下继续投入(此类情况在实际中屡见不鲜)。问题通常来源于实验体系不合理,以及难以控制的抗体质量问题(为主要因素)。
我们已发布大量文章与视频资料,系统介绍IP-MS实验设计、材料选择、操作流程及样本准备等关键环节,显著降低了因人为因素导致的实验失败。相关内容收录于“谱度众合”公众号的“IP-MS蛋白互作组研究合集”,在此不再赘述。
抗体性能的不确定性是主要风险源。为此,我们推出基于质谱检测的免费IP效果预评估服务(事实上,高水平课题组在正式筛选前通常会自费进行此类评估)。若评估结果合格,则正式筛选实验极有可能获得高质量数据;若未通过评估,则可依据质谱反馈调整实验方案,从而确保经费投入能够获得有价值的结果。

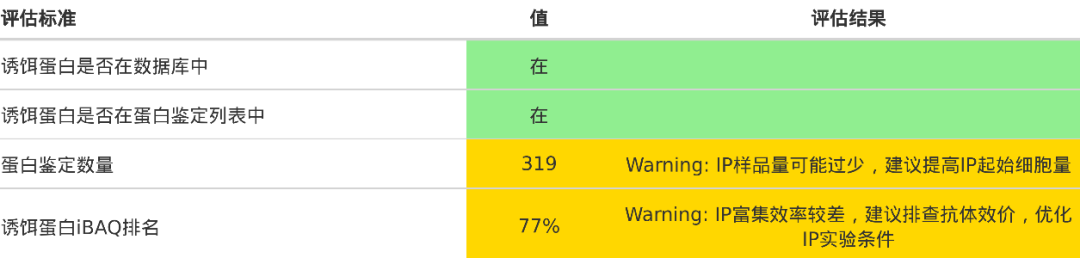
2.长期验证无果
与项目整体外包不同,多数质谱检测公司仅对数据产出负责,其质控多集中于数据量、重复性等基础指标。由于IP实验样本组成相对简单、数量有限,常规质控往往易于达标,导致大量质控“合格”但实际无法使用的数据被交付。因此,不能仅依赖常规质控标准。
我们曾多次遇到客户反馈:“后续的结合与功能实验均无法验证!”经深入分析其数据,发现问题多样,涉及抗体特异性、实验方法、筛选策略等。这些数据在我们看来毫无价值,但客户却已在其上耗费近半年时间及大量试剂经费。
对低质量数据必须做到及早识别。我们针对研究目的更新了项目报告结构,在结果第一部分即对数据质量进行科学评价(需客户提供实验目的及诱饵蛋白信息等)。若数据评估为“理想”,且实验设计与样本准备符合建议要求,根据我们的经验,在报告推荐的前10个候选蛋白中,至少有5个可被后续实验验证具有结合能力。

我们为研究者总结出以下几点经验(适用于多数实验场景):
❶ 对获取的数据必须进行科学评估,确认可靠后再投入使用,无论数据来源如何;
❷ 高度重视筛选实验的数据质量,盲目推进只会造成时间与经费的更大浪费;
❸ 尽可能向检测机构说明研究目的,以便其选择最优实验策略并进行有效数据评估;如无法实现,研究者需自行深入研究实验策略。
四、替代性实验策略
在实际研究中,常面临诸多限制,如缺乏高质量抗体、目标蛋白表达量低、需在内源性表达背景下研究、原代细胞难以培养或进行基因编辑,以及需在动物或人体临床组织/体液中开展研究等。以下推荐几种适用于互作蛋白高通量筛选的实验方案:
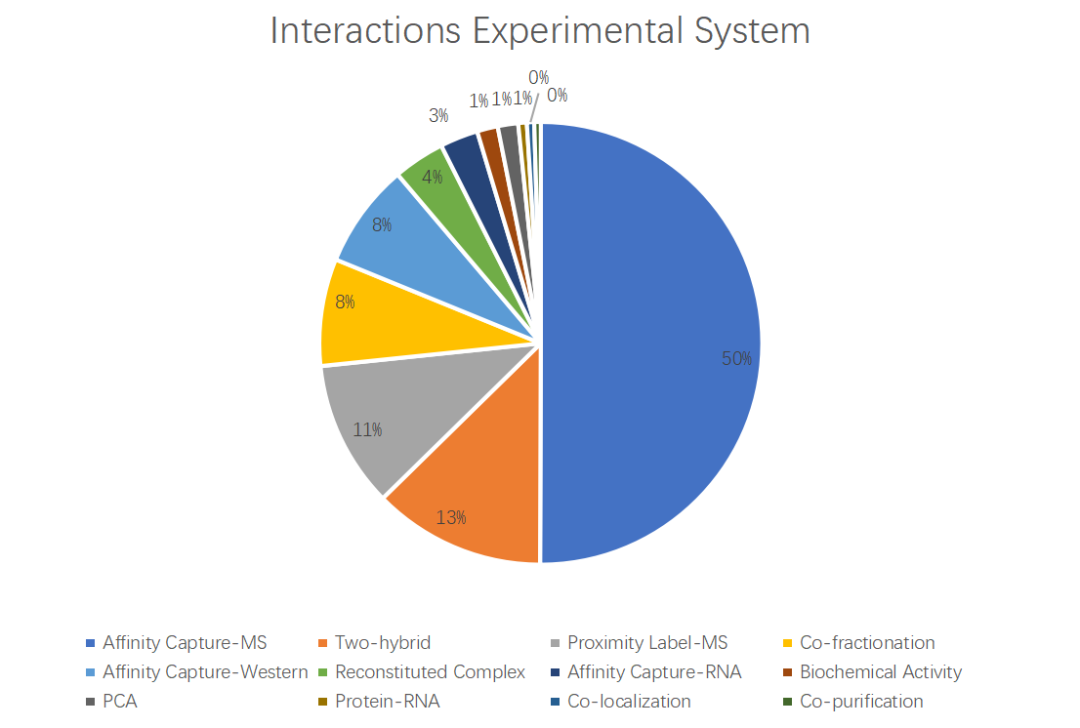
数据来源于BioGRID 2024更新数据
1.标签抗体IP
当目标蛋白抗体质量不佳或表达水平较低时,可优先考虑将其与标签融合表达,并利用成熟的标签抗体进行免疫共沉淀。例如,在工具细胞中瞬时表达Flag标签蛋白是目前最常用且便捷的互作研究策略。
常用表位标签包括Flag、HA、Myc、V5、His等,其分子量较小,理论上对目标蛋白的结构与功能影响有限。此外,还有结构域标签如GFP、YFP、GST、MBP等,其分子量通常较大,优势在于可在亲和纯化同时实现其他功能(如免疫荧光定位)。
2.PL-MS邻近标记技术
若目标蛋白抗体质量不理想,或需研究原位表达、弱结合或瞬时互作,可考虑使用PL-MS技术,感兴趣的老师可以点击左侧产品主页链接了解详情。邻近标记技术是近年来发展最迅速的蛋白互作研究工具之一,其优势在于能够捕捉传统方法难以捕获的瞬时/微弱相互作用。链霉亲和素以其高亲和力与高兼容性,可有效富集膜蛋白及不溶性蛋白复合物。若能在原位插入表达,则可在接近生理状态的条件下解析蛋白互作网络。
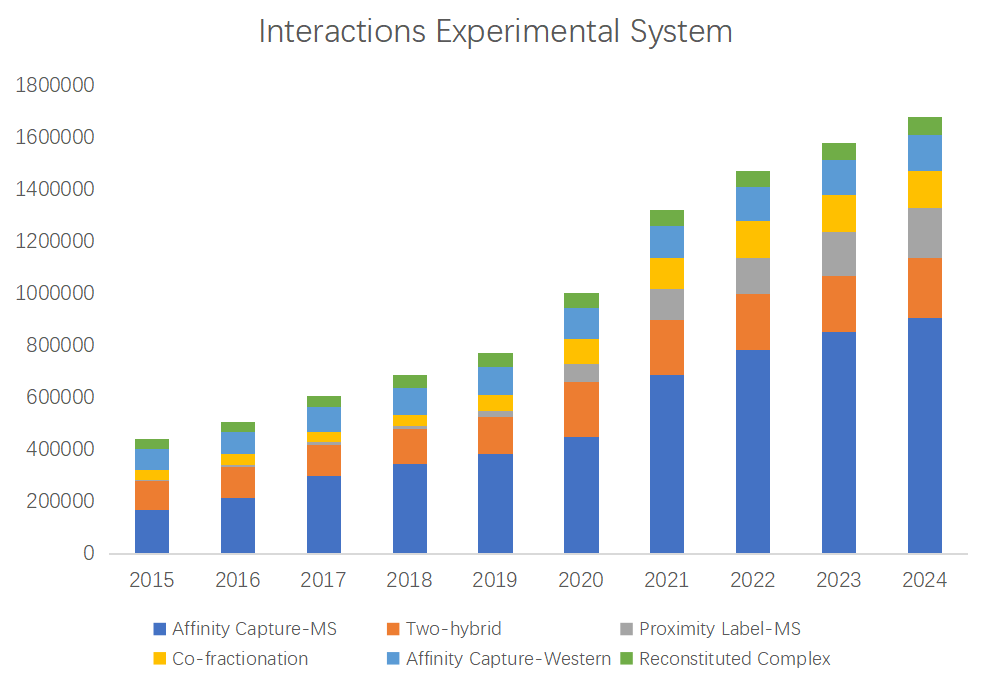
数据来源于BioGRID
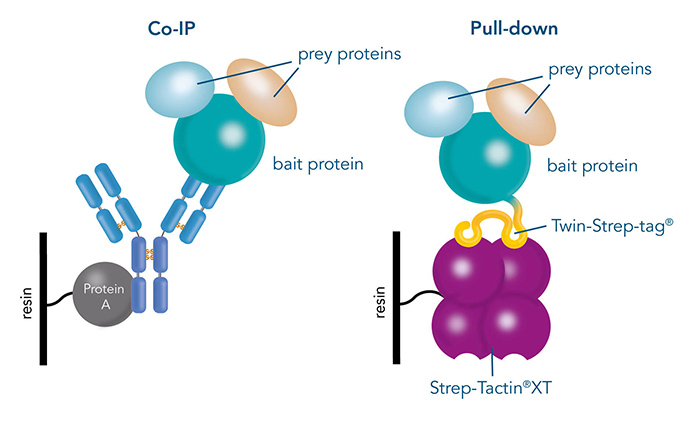
3.Strep Pull down蛋白互作筛选
在目标蛋白抗体效果不佳,且实验材料为难以基因编辑的动物/临床组织、体液样本时,可选择在体外融合表达Twin-Strep-tag标签,纯化后与样本共孵育,再结合质谱进行筛选。
Strep纯化系统具有高亲和力、高特异性、高兼容性、低背景及标签小等优点。相较于GST Pull down、His Pull down等蛋白纯化技术,其背景更干净,特异性更高。
总结
科研实验之路充满挑战!要在成本可控的前提下成功完成研究,不仅需要一个致力于解决科学问题的专业团队,更需要一套具有温度的服务体系。谱度众合始终以协助客户解决具体科学问题为产品开发核心,通过系统在样本准备、样本前处理、质谱检测、数据分析以及服务政策上,全方位支持研究目标的实现。这也使得我们所提供的数据在实用性与可靠性方面显著优于同行。依从谱度众合的IP-MS蛋白互作组研究解决方案,绝大多数客户均能以可控风险高效达成研究目标。
参考文献:
-
1.A Genecentric Human Protein Atlas for Expression Profiles Based on Antibodies.MCP October 2008
https://www.mcponline.org/article/S1535-9476(20)31283-4/fulltext
-
2、 Scaling of an antibody validation procedure enables quantification of antibody performance in major research applications
https://pmc.ncbi.nlm.nih.gov/articles/PMC10312534/
-
3、 Improving the integrity and reproducibility of research that uses antibodies: a technical, data sharing, behavioral and policy challenge
https://pmc.ncbi.nlm.nih.gov/articles/PMC10936606/
-
4、 The antibodies don’t work! The race to rid labs of molecules that ruin experiments. Nature 06 November 2024
https://www.nature.com/articles/d41586-024-03590-0
