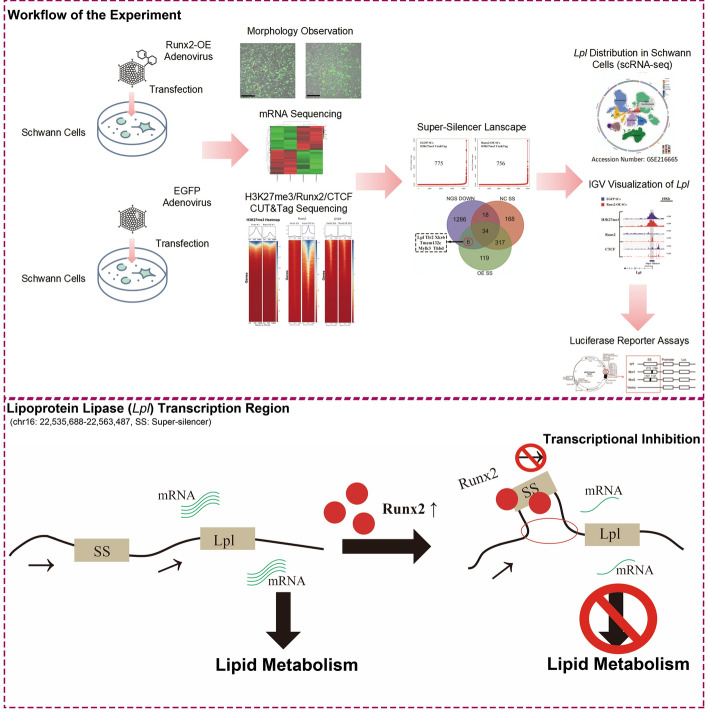
Cell Mol Biol Lett|Runx2诱导超级沉默子形成下调Lpl表达:重塑雪旺细胞脂质代谢的新机制
分享一篇围绕外周神经损伤再生机制的研究,作者发现Runx2在损伤早期显著上调,并通过在Lpl调控区形成H3K27me3依赖的超级沉默子(Super-Silencer)抑制Lpl转录,导致雪旺细胞(SCs)脂质代谢紊乱与功能重塑。

- 标题:Runx2通过超级沉默子形成下调Lpl表达,从而改变神经损伤后朱施万细胞的脂质代谢
- DOI:10.1186/s11658-025-00796-6
摘要
本研究揭示了Runx2在调控雪旺细胞(Schwann cells, SCs)表型转化中的表观遗传机制。研究者通过构建Runx2过表达腺病毒载体并在大鼠坐骨神经挤压伤模型中验证,发现损伤后4天与7天的再生区域存在Runx2阳性SC。进一步利用转录组分析、CUT&Tag测序及单细胞RNA测序(GSE216665)整合分析发现,Runx2过表达显著干扰SC的脂质代谢通路。机制上,Runx2通过在Lpl基因调控区形成超级沉默子(super-silencer),抑制其转录活性,从而导致Lpl表达下调。双荧光素酶实验证实了该调控关系。综上,Runx2通过表观遗传机制介导脂质代谢基因的转录沉默,从而影响SC的代谢状态与再生行为,为神经损伤修复提供了新的分子靶点。
结果
神经损伤后Runx2表达上调及其在Runx2-OE雪旺细胞中的转录调控特征
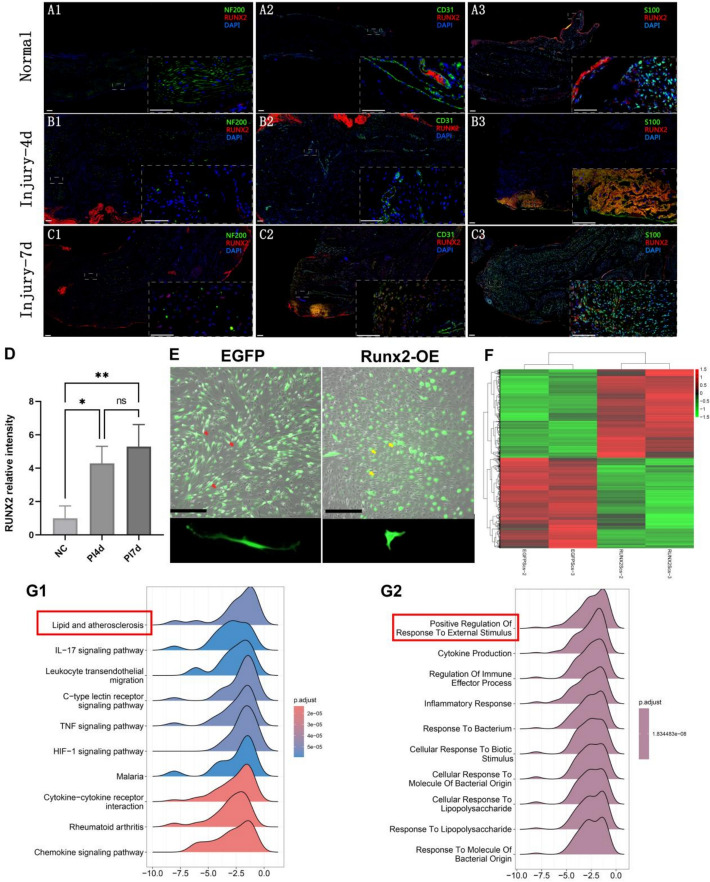
免疫荧光结果显示,周围神经挤压伤早期(PI4d、PI7d)雪旺细胞(SCs)内的Runx2表达显著升高,并与S100阳性区域明显共定位(图1a–d),提示Runx2在损伤后SCs活化过程中起重要作用。体外观察发现,Runx2过表达(Runx2-OE)后SC形态由典型的双极细长状(He SCs)转变为圆形并伴短突起(Zhu SCs)(图1e)。Smart-seq转录组分析鉴定出Runx2-OE SCs中1317个基因上调、1345个基因下调,其中Runx2、Notch、Mki67、Pten显著上调,而Il1rl1、Lpl、Egfr等下调(图1f)。GSEA分析进一步揭示,Runx2-OE SCs与**脂质与动脉粥样硬化通路(NES=−2.10)及HIF-1信号通路(NES=−2.16)呈负相关,而与外界刺激响应(NES=−2.27)和炎症反应调节(NES=−2.34)**呈正相关(图1G1、G2),提示Runx2可能通过重塑脂质代谢与免疫反应通路来调控SCs的表型转化与再生功能。
Runx2-OE雪旺细胞中关键转录因子Runx2与CTCF的表观结合特征分析
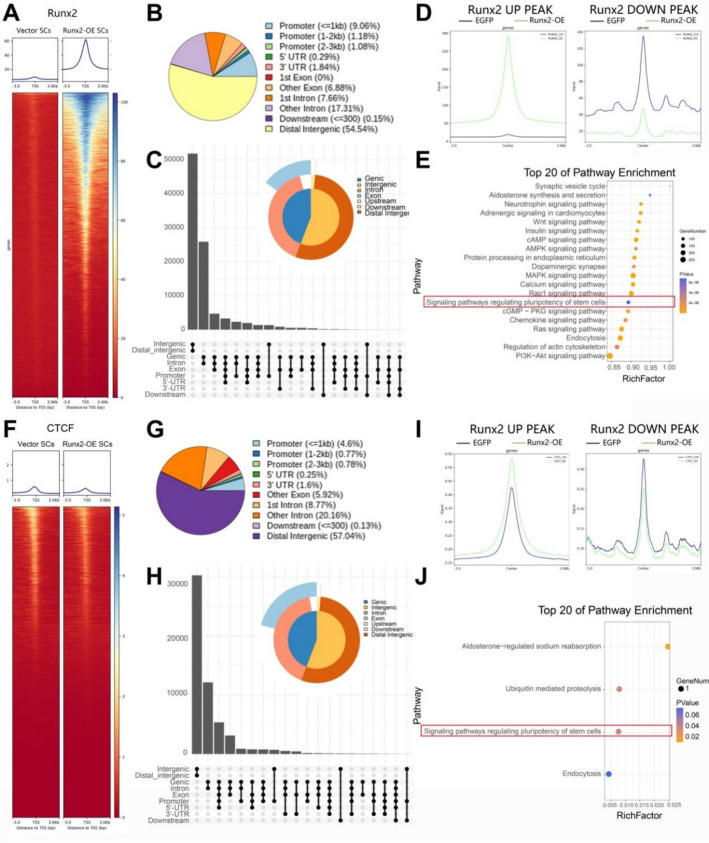
通过CUT&Tag-seq对Runx2-OE SCs中Runx2与CTCF结合谱进行解析发现,Runx2信号主要富集于转录起始位点(TSS),其中约11.32%分布于启动子区域(图2a–b),且在Runx2上调区域的峰强度明显高于对照组(图2d)。富集分析显示,上调峰显著参与突触小泡循环、神经营养因子信号、WNT、cAMP及PI3K-AKT通路等(图2e),提示Runx2可能通过多信号轴调节SC可塑性。相比之下,CTCF在TSS区域的结合峰数量无显著差异(图2f),仅6.15%的峰位于启动子区域(图2g)。然而,在Runx2上调的峰区中,OE组的CTCF信号显著增强(图2i),暗示Runx2与CTCF存在协同调控关系。其上调峰富集于醛固酮调节的钠重吸收、泛素介导的蛋白水解及干细胞多能性信号通路等(图2j),表明Runx2可能通过与CTCF的互作参与SCs的转录组重塑与功能调节。
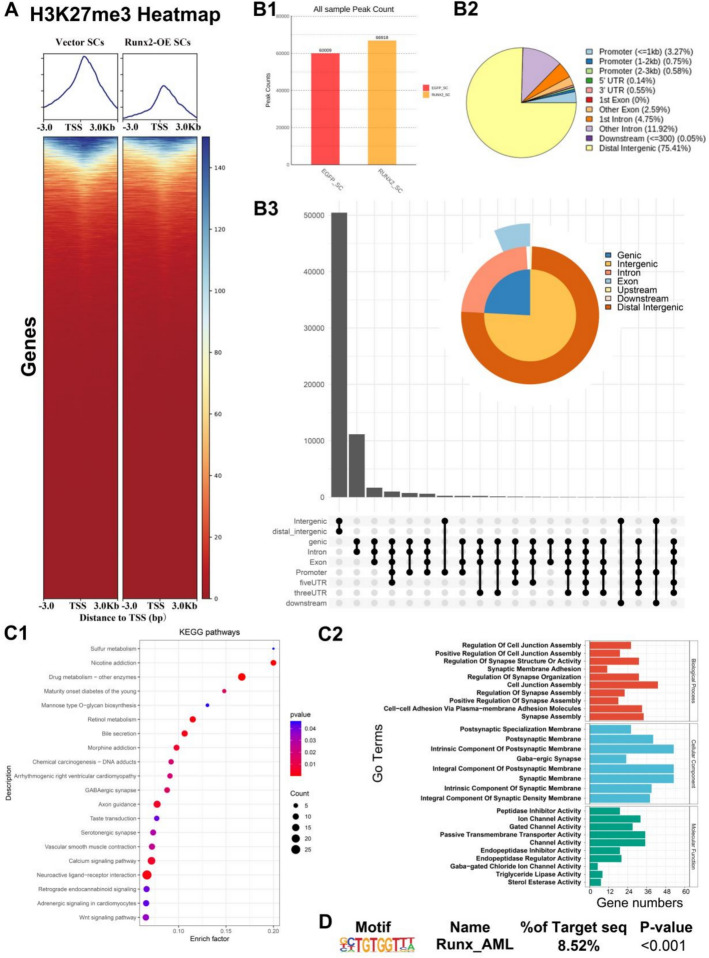
Runx2-OE雪旺细胞中染色质H3K27me3修饰状态的动态变化
为探究Runx2过表达对雪旺细胞(SCs)组蛋白甲基化修饰的影响,研究者进行了H3K27me3 CUT&Tag-seq分析。结果显示,与对照组相比,Runx2-OE细胞中H3K27me3峰数量显著增加(66,918 vs 60,009,图3B1),但其在转录起始位点(TSS)区域的峰积累量较低(图3A),提示Runx2可能促进远端染色质抑制结构的形成。Runx2-OE细胞中约75.41%的峰位于远端基因间区,仅4.6%分布于启动子区域(图3B2)。富集分析显示,这些H3K27me3修饰相关基因显著参与硫代谢、轴突导向、血清素能突触、钙信号通路及神经活性配体-受体相互作用等(图3C1);GO分析进一步揭示其主要调控细胞连接、突触组装及**脂质代谢(如甘油三酯脂肪酶与固醇酯酶活性)**等过程(图3C2)。基序扫描(HOMER)结果表明,Runx_AML转录因子具有显著结合潜能(8.52%)(图3D),提示Runx2可能通过调控H3K27me3沉默标记介导染色质构象重塑,从而影响SCs的代谢与神经再生功能。
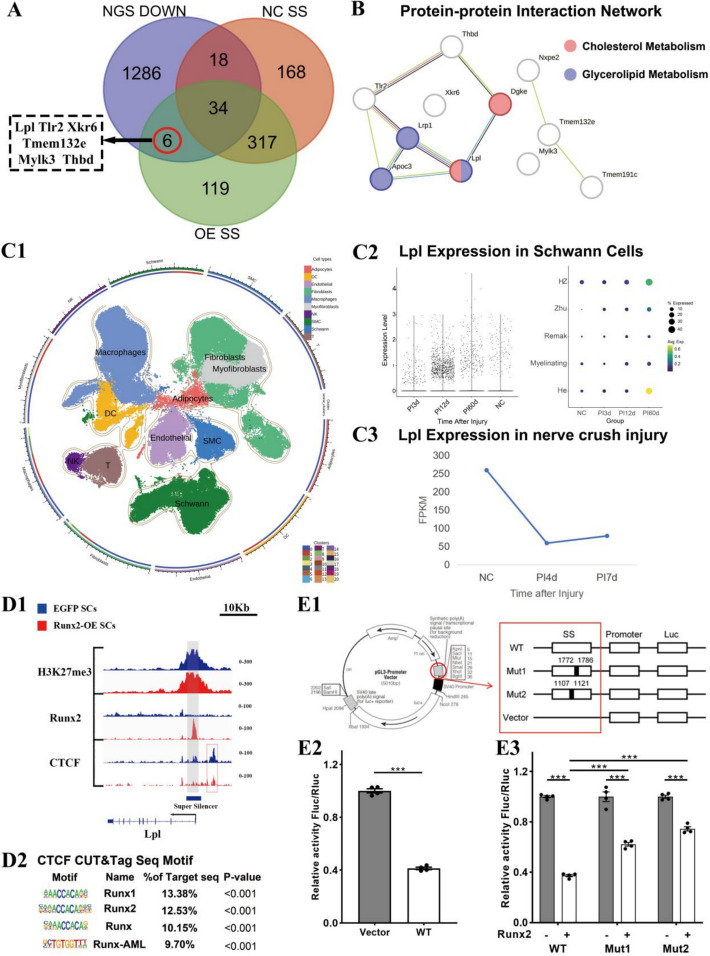
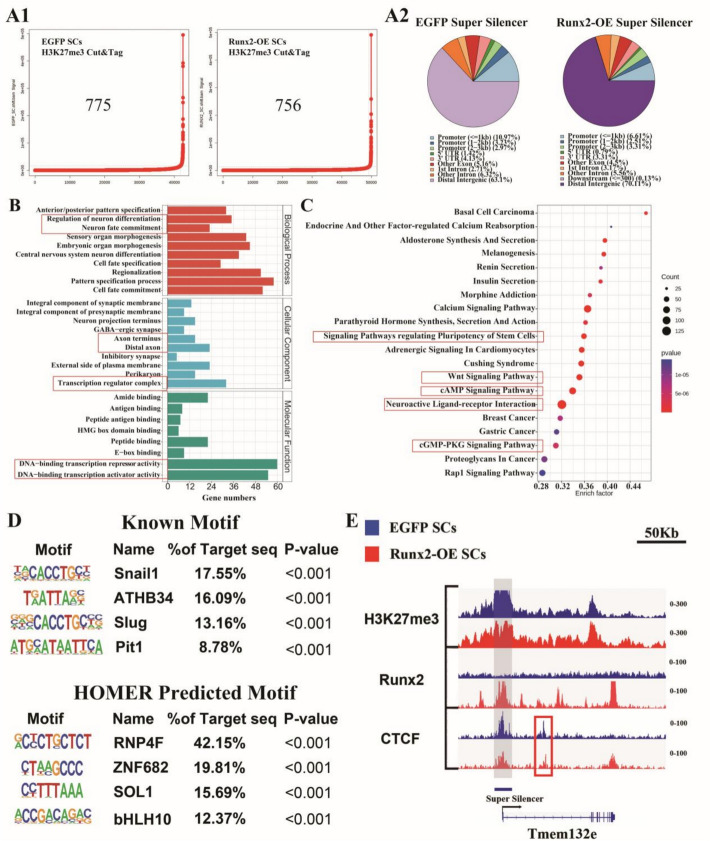
Runx2-OE雪旺细胞中Runx2相关超级沉默子(Super-Silencer, SS)景观的建立
基于H3K27me3 CUT&Tag数据,采用ReSE分析方法(Cai等)在Runx2-OE与对照组间描绘了超级沉默子(SS)景观。结果显示,对照组鉴定出775个甲基化富集位点,Runx2-OE组鉴定出756个(图4A1),其中Runx2-OE组仅有12.43%的富集位点分布于启动子区域(图4A2),提示Runx2过表达主要诱导远端染色质的抑制性重塑。GO与KEGG富集分析显示,这些SS相关基因参与神经元分化、突触组装、运动器官形成与细胞命运决定等过程,定位于突触前后膜与轴突末端,影响转录复合物与DNA结合转录因子活性(图4B)。KEGG分析进一步揭示其与SCs多能性通路、WNT信号、cAMP信号及神经活性配体–受体相互作用密切相关(图4C)。基序分析发现,已知结合基序包括Snail1 (17.55%)与ATHB34 (16.09%),预测基序则富集于RNF4F (42.15%)、ZNF682 (19.81%)、Sol1 (15.69%)与bHLH10 (12.37%)(图4D)。IGV可视化进一步确认在Tmem132e基因调控区存在明显的SS区域,伴随Runx2信号增强与H3K27me3峰富集(图4E),表明Runx2通过建立H3K27me3依赖的超级沉默子网络精细调控SCs的转录状态与神经再生潜能。
Runx2通过超级沉默子形成抑制Lpl表达并扰动雪旺细胞脂质代谢
通过整合Runx2-OE组的SS区域与mRNA-seq下调基因,发现共有6个基因(Lpl、Tlr2、Tmem132e、Mylk3、Xkr6、Thbd)同时参与SS形成(图5A)。其中,Lpl在构建的PPI网络中居核心位置,与Thbd和Tlr2存在相互作用(图5B),提示其可能通过影响胆固醇与糖脂代谢调节SC功能。对公共数据集GSE162548再分析发现,Lpl在坐骨神经损伤早期(PI4dPI7d)显著下调**,随后在**GSE216665单细胞数据**中于PI12d后逐渐恢复并在PI60d于**He与HZ型SCs**中高表达(图5C1–C3),提示其表达受损伤时程调控。**IGV可视化**显示,Lpl转录调控区存在Runx2富集的**H3K27me3超级沉默子区域**,并伴随稳定的CTCF信号(图5D2);**HOMER基序分析**揭示Runx家族因子(Runx1、Runx2、Runx-AML等)在该区域显著富集(9.70%13.38%),提示Runx2可能直接结合该抑制结构。双荧光素酶实验进一步验证Runx2能与Lpl-SS片段结合并显著抑制其转录活性,WT组荧光强度较空载体组明显下降(F=185.4,p<0.0001),而Mut1/Mut2突变体**虽保留部分结合能力但抑制效应减弱(图5E1–E3)。综合来看,Runx2通过在Lpl调控区形成H3K27me3依赖的超级沉默子并与之结合,从而下调Lpl表达、干扰脂质代谢网络,提示其在SCs代谢重塑与神经再生调控中发挥关键抑制作用。