国自然·医工交叉热点|泛癌组织学重建AI模型
在医学AI飞速发展的今天,肿瘤组织学分析早已离不开深度学习的助力——从肿瘤分类到分子特征识别,AI模型正在重塑病理诊断的流程。
但一个关键难题始终困扰着科研人员:这些模型提炼的高阶图像特征如同“黑箱”,其生物学意义难以解读,这不仅限制了模型的临床转化,也成为国自然申报中“创新性”与“研究价值”的核心瓶颈。
近期发表在《Science Advances》上的一项研究,提出了名为HistoXGAN的定制生成对抗网络,成功实现了从病理、基因组和放射学潜在特征精准重建泛癌组织学图像,为破解AI“黑箱”、推动跨模态诊断提供了新方案。

今天,我们就从这篇文献出发,拆解其适配国自然的核心内容、申报落地策略,并探讨如何将研究与临床痛点深度绑定。
交流群
近期有国自然申报需求的老师可以扫码加入交流群!
结束语
本期推文的内容就到这里啦,如果需要获取更多基金申报相关的内容,欢迎参加我们的线下课程!
越早报名加入的学员,有机会直接向黄sir提出建议,将你感兴趣的研究方向(如三级淋巴结构、多组学融合、大语言模型、因果深度学习、肿瘤微环境相关影像模型等)融入影像AI标书设计中。
黄sir将根据大家的提议,酌情准备相应的内容并纳入课程,从而更有针对性地完善教学安排。
锁定关键科学问题:直击领域核心盲区
现有肿瘤组织学AI研究存在三大瓶颈,恰好契合国自然“聚焦未解决科学问题”的导向:
- 特征可解释性缺失:深度学习模型将复杂组织学图像浓缩为高阶特征,但这些特征与肿瘤生物学特征(如分级、基因表达)的关联不明确,导致模型信任度不足,难以临床转化(对应国自然“疾病诊断与治疗的关键科学问题”研究方向);
- 批次效应干扰严重:幻灯片染色、组织处理等非生物学差异易被模型捕捉,导致诊断偏差,这一问题在泛癌研究中尤为突出(对应国自然“生物医学大数据精准分析”方向);
- 跨模态重建技术滞后:传统模型无法从放射学影像(如MRI)有效生成组织学图像,难以实现非侵入性“虚拟活检”(对应国自然“精准医学与影像组学融合”战略需求)。
创新研究思路:跨界融合破解技术难题
研究的核心创新点为为自然申报提供了清晰的“创新假说”支撑:
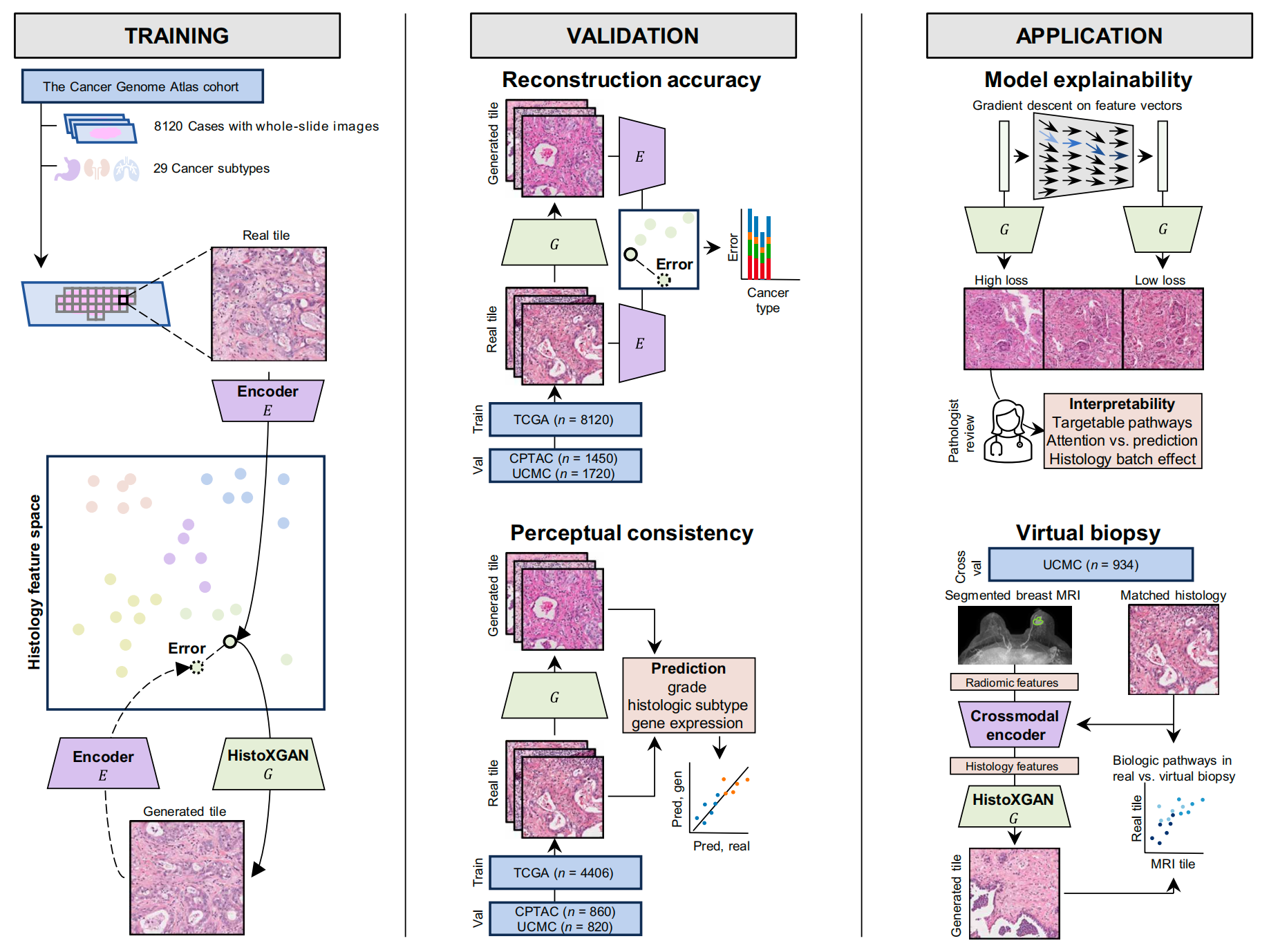
- 架构创新:整合自监督学习(SSL)特征提取器与改良版StyleGAN2,构建HistoXGAN,无需单独编码器即可将特征向量直接转化为组织学图像,解决了传统GAN跨特征域重建精度低的问题;
- 功能拓展:突破“单一任务重建”局限,实现肿瘤分级、亚型、基因表达模式的同步保留,同时可通过梯度下降解析模型预测的核心特征;
- 跨模态突破:训练跨模态编码器,从MRI放射组学特征生成组织学图像,首次实现泛癌层面的“虚拟活检”技术验证(对应国自然“跨界技术融合”创新方向)。
核心研究方法:先进性与适配性双达标
国自然申报中“研究方法”需突出“突破传统局限”,本研究的方法体系极具参考价值:
- 多数据集验证体系:基于TCGA(8120例,29种癌症)、CPTAC(1328例)及芝加哥大学医学中心(1720例)数据集,覆盖泛癌场景,验证了模型的通用性;
- 精准度评估维度:结合L1损失定量分析与4位资深病理学家盲评(一致性达75%-94%),实现客观数据与主观评估的双重支撑;
- 模型解释与优化手段:通过主成分分析解析批次效应来源,对比Reinhard与CycleGAN归一化方法的优劣,为模型临床应用扫清障碍。

研究价值:契合国自然“理论+应用”双重导向
- 理论价值:首次揭示高阶图像特征与肿瘤生物学特征的可视化关联,为AI模型可解释性研究提供新范式(对应国自然“人工智能在医学中应用的基础理论”方向);
- 应用前景:“虚拟活检”技术可解决传统活检侵入性强、取样困难(如深部肿瘤)、诊断延迟等问题,助力早期筛查与预后评估,符合国家“癌症防治行动”战略需求。
后续我们将持续解读医学AI领域的高质量文献,拆解国自然申报的核心技巧,敬请关注!
