DFT学习--文献
DFT计算在文献中所体现的图主要是:近EF局域态密度的 3D顶视图、总态密度图(TDOS)、分态密度图(PDOS)、d带中心对比图和吉布斯反应能阶梯图等。
一、以 High-Entropy Intermetallic PtRhBiSnSb Nanoplates for Highly Efficient Alcohol Oxidation Electrocatalysis 为例
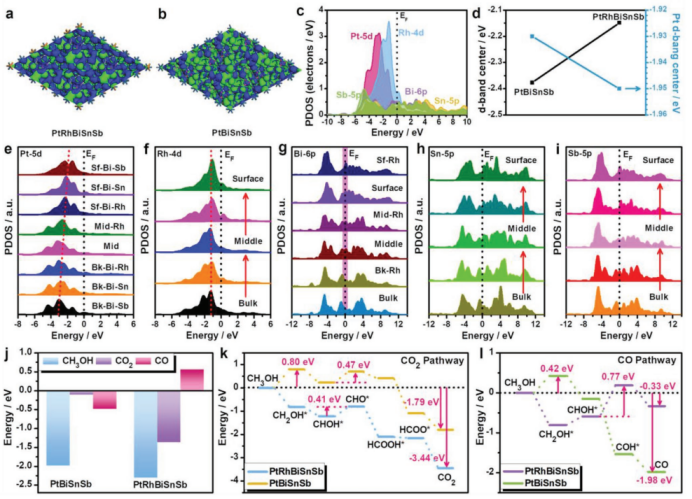
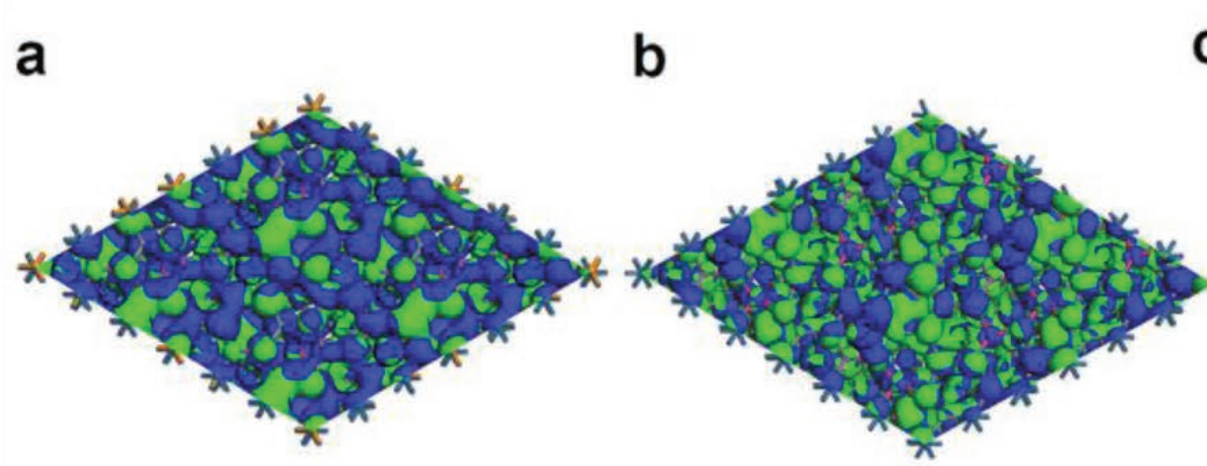
- 近EF局域态密度的3D顶视图(figure.a b):a为 PtRhBiSnSb(HEI),b为 PtBiSnSb(对照),图例颜色是元素(蓝Pt、橙Rh、紫Bi、橄榄Sn、粉Sb);等值面更密集/连贯则代表该处近EF态更丰富,利于电荷转移/化学键形成,a 相比 b,表面与 Rh 邻域的近-EF态贡献更强,提示引入Rh提高了电荷转移动力学与活性位密度。
- 分态密度图(figure.c):横轴是能量,通常将费米能级 (EF) 设为0 eV;纵轴是态密度,代表在某个能量下,有多少电子可以占据的轨道;峰值越靠近EF,则表示某个元素的轨道峰值越靠近EF,表明该原子在催化反应中越活泼。不同曲线的重叠区域表明了元素间存在轨道杂化和电子转移,体现了不同元素间的协同效应。
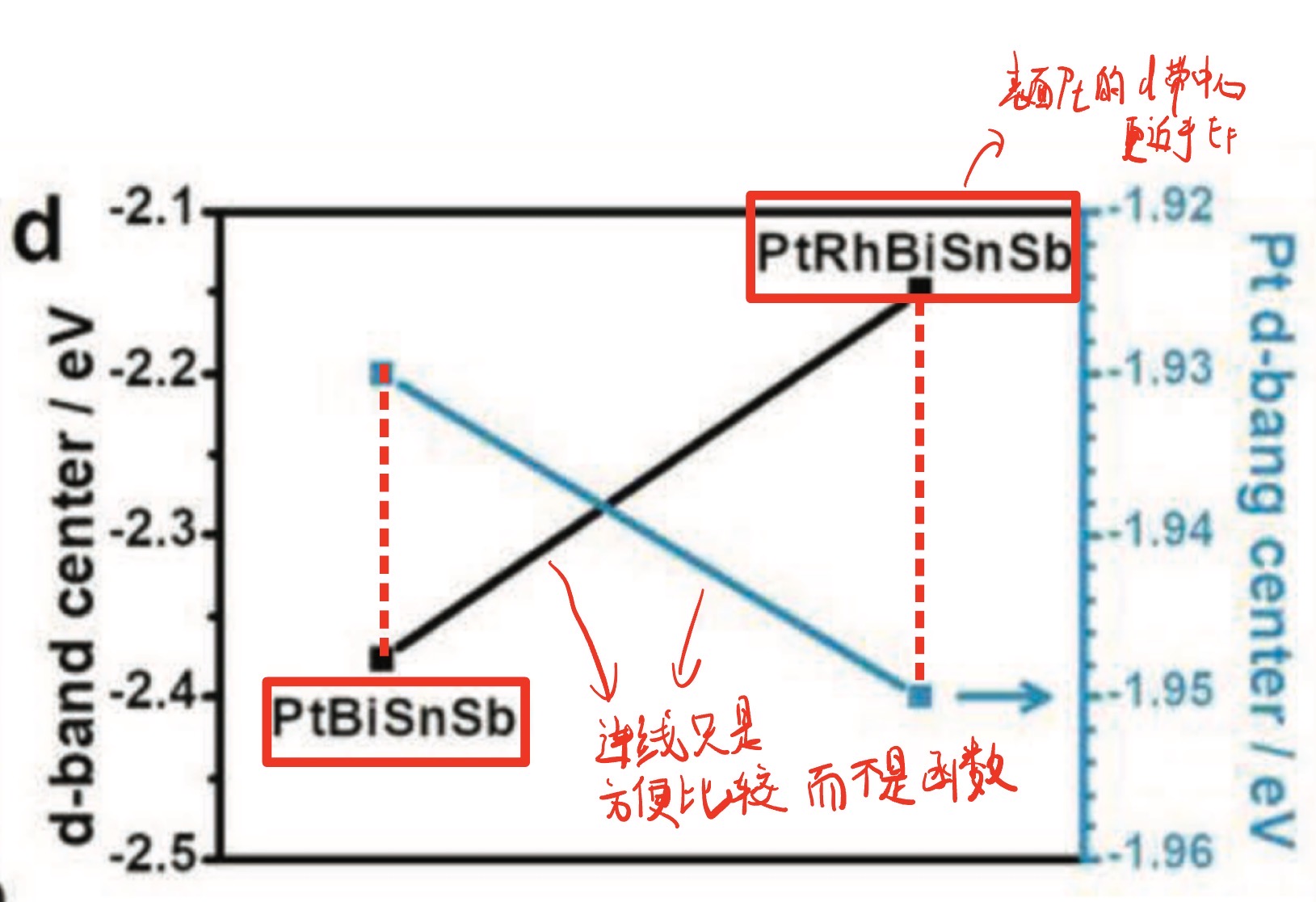
- d带中心对比图(figure.d):有两条曲线、两个纵轴,黑色(左轴)表示整体d带中心;蓝色(右轴)表示表面Pt的d带中心;加Rh后整体d带中心上移,这表示电子转移更容易;但表面Pt的d-带中心略下移则表示弱化了与中间体(尤其CO)的过强吸附;但是吸附能也不是越大越好,太负结合太弱,底物不容易活化,太趋向于0eV(EF)结合太强,毒物(如 CO)不容易脱附,最佳情况是适中 ,底物能抓住,毒物不粘牢。
- 位点依赖的分态密度图(figure.e f g h i):图标右侧标注Surface / Middle / Bulk 表示反应位置,部分子图还写了Sf-Bi-Sb、Bk-Bi-Sn等,三元素合金或x元素合金及反应位置。峰值越靠近EF,则表示该合金和位置在催化反应中活性越好。
- 吸附能对比图(figure.j):负值=更容易吸附,结合更强;正值=吸附不利/很弱,CH₃OH、CO₂、CO三条路径对比,CH₃OH路径吸附能更负,更易活化。
- 吉布斯反应能阶梯图(figure.h i):横轴为反应中间体,纵轴为反应能(近似自由能),上坡=吸能/难一步(要吸能),下坡=放能/易一步(放能),最高那级上坡≈表观能垒;在二氧化碳路径下的PtRhBiSnSb 上,仅出现一个较小能垒 ~0.41 eV,整体“阶梯”相对平缓,且总体反应能更负,表示“走完全氧化更顺、更有驱动力”;PtBiSnSb 则更偏好 CO 路径。
读图口诀
- a、b:看 EF 附近电子云是否更“亮/连通”(Rh 加入 → 更亮更连通)。
- c:看谁的 PDOS 靠 EF(Rh-4d 贴 EF)。
- d:整体 d-带中心↑(吸附能更高);Pt 的 d-带中心↓(更抗“粘”\吸附能更低)。
- e–i:看从 bulk(体相层)→surface(表面层)的位移与稳健性;红色竖线只是趋势标记,不是“斜能带”。
- j:CH₃OH、CO₂ 吸附更强;CO 更弱(抗毒)。
- k、l:从开始到末尾降得越多、能垒越小(坡度越缓),反应越顺;
PS:
d 带中心的定义
-
在过渡金属里,d 轨道的电子态分布(d-DOS)决定了催化剂表面对吸附物的亲和力。
-
d 带中心就是把整个 d 态分布的重心算出来,类似于一个“加权平均能级”,
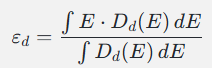
其中 Dd(E)D_d(E)Dd(E) 是 d 态的 DOS,EEE 是能量,通常费米能级 EFE_FEF 被设为 0。 -
直观理解:d 带中心就是“这块金属 d 轨道电子能量的平均水平线”,可以在一定程度上反应催化剂表面对吸附物的亲和力。
-
d 带中心离EF越近, 金属与吸附物(如 CO、O、OH)的反键轨道重叠越强,吸附越牢固;d 带中心离EF越远,金属和吸附物间吸附力减弱,更容易脱附。
