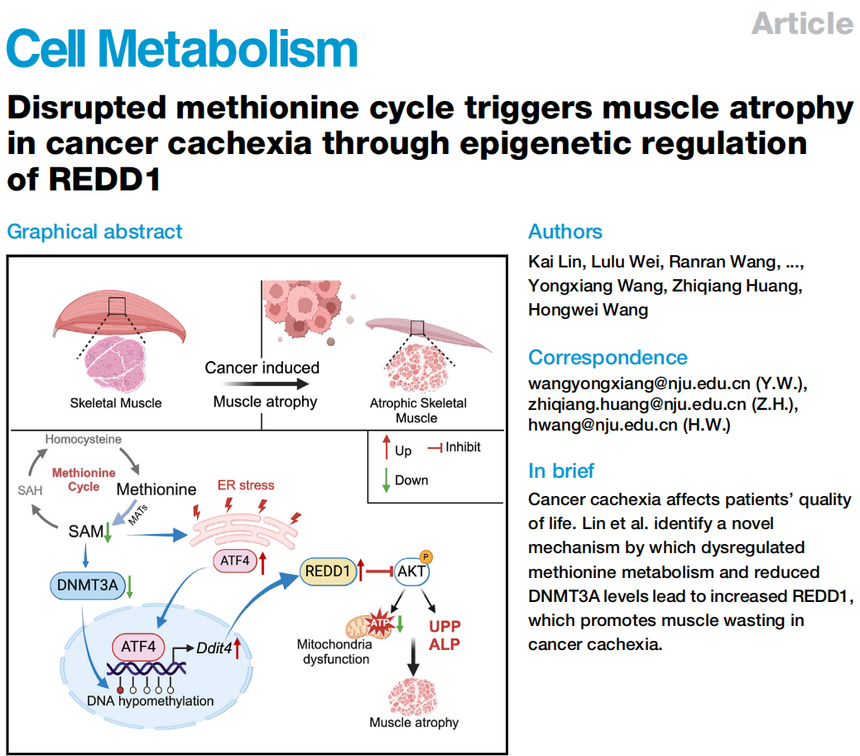
Cell Meb | 国自然热点DNA甲基化和蛋氨酸代谢共同解析癌症恶病质肌肉萎缩的机制
在癌症的阴影下,恶病质(cachexia)这个沉默的"杀手"正悄然夺走患者的生存希望——它导致高达20%的癌症患者死于极度消瘦,而非肿瘤本身。近年来,国家自然科学基金持续支持"代谢重编程与表观遗传调控的交叉研究",正是为了破解此类复杂疾病的共性机制。2025年发表在《Cell Metabolism》的研究《Disrupted methionine cycle triggers muscle atrophy in cancer cachexia through epigenetic regulation of REDD1》首次揭示:蛋氨酸代谢紊乱竟通过DNA甲基化异常驱动肌肉萎缩,这为癌症恶病质提供了全新视角。
该研究发现了可干预的代谢漏洞:补充蛋氨酸或直接甲基供体SAM,能重建DNA甲基化屏障(如图7所示),逆转肌肉萎缩。这不仅为"营养干预疗法"提供理论支撑,更印证了国自然倡导的"代谢-表观遗传轴"在疾病研究中的重要地位,本期我们带来这篇文章的解读,希望能为大家的课题研究提供思路。
研究背景
癌症恶病质(Cancer Cachexia, CC)是一种在肿瘤进展中发生的代谢综合征,导致骨骼肌严重萎缩和脂肪组织损失,是癌症患者死亡的主要原因(约占20-30%)。目前缺乏有效治疗方法。蛋氨酸(methionine)作为必需氨基酸,在蛋氨酸循环中生成S-腺苷甲硫氨酸(SAM),后者是DNA甲基化的关键甲基供体,影响基因表达。既往研究缺乏对蛋氨酸循环在恶病质肌肉萎缩中作用的深入探讨。
核心研究问题
· 论文旨在解决三个关键问题:
(1) 蛋氨酸循环在癌症恶病质中如何失调?
(2) 这种失调如何通过表观遗传机制(如DNA甲基化)调控REDD1(一种促进肌肉萎缩的基因)表达?
(3) 蛋氨酸或SAM补充能否逆转肌肉萎缩?
这些问题源于现有研究的不足:例如,对蛋氨酸代谢在肌肉稳态中的作用理解不充分,且REDD1的上游调控机制不明确。
实验方法
ATAC-seq、靶向代谢组、RNA-seq、MSP、BSP、ChIP-qPCR、DNA dot-blot等
研究思路
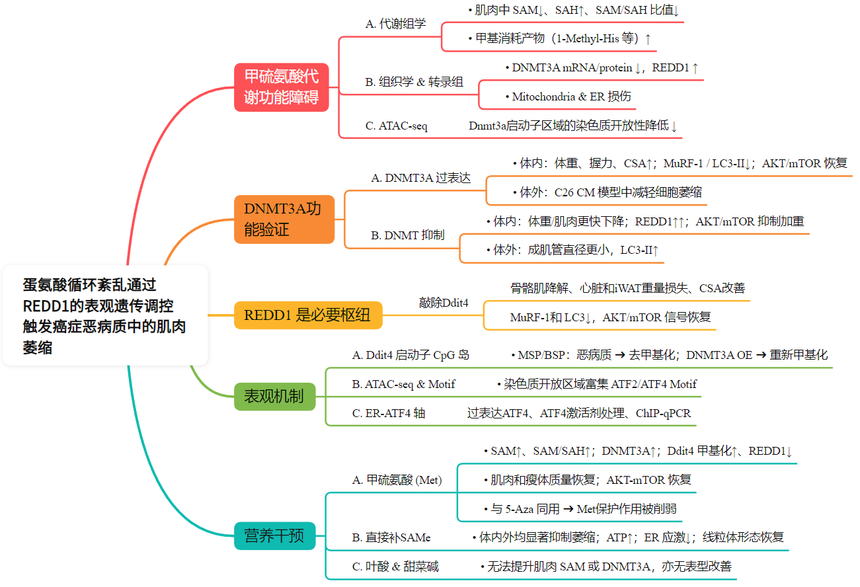
研究结果
1. 癌症恶病质甲硫氨酸代谢功能障碍
为研究癌症恶病质(CC)期间肌肉发生的转录和代谢变化,研究者首先使用两种肿瘤细胞系构建小鼠肿瘤诱导的恶病质模型。随病程推进,动物出现典型的CC体征,蛋氨酸循环出问题。靶向代谢组学揭示肌肉中发生了显著的代谢变化,其中氨基酸代谢物如1-甲基组氨酸、犬尿氨酸和2-氨基丁酸显著累积。进一步聚焦甲硫氨酸(Met)→ SAM → SAH这一条“甲基货币”循环:恶病质小鼠和患者肌肉中Met总量反而升高(图1D),但SAM显著降低、SAH升高,肌肉中SAM/SAH比值骤降。
C2C12肌管模型体外同位素示踪显示,在诱导的细胞萎缩过程中,蛋氨酸向SAM的代谢出现了异常。电子显微镜观察显示,恶病质小鼠的骨骼肌出现线粒体萎缩和内质网功能障碍,表明恶病质严重扰乱了能量代谢。这提示,在CC发展过程中,骨骼肌可能与内质网应激存在关联。
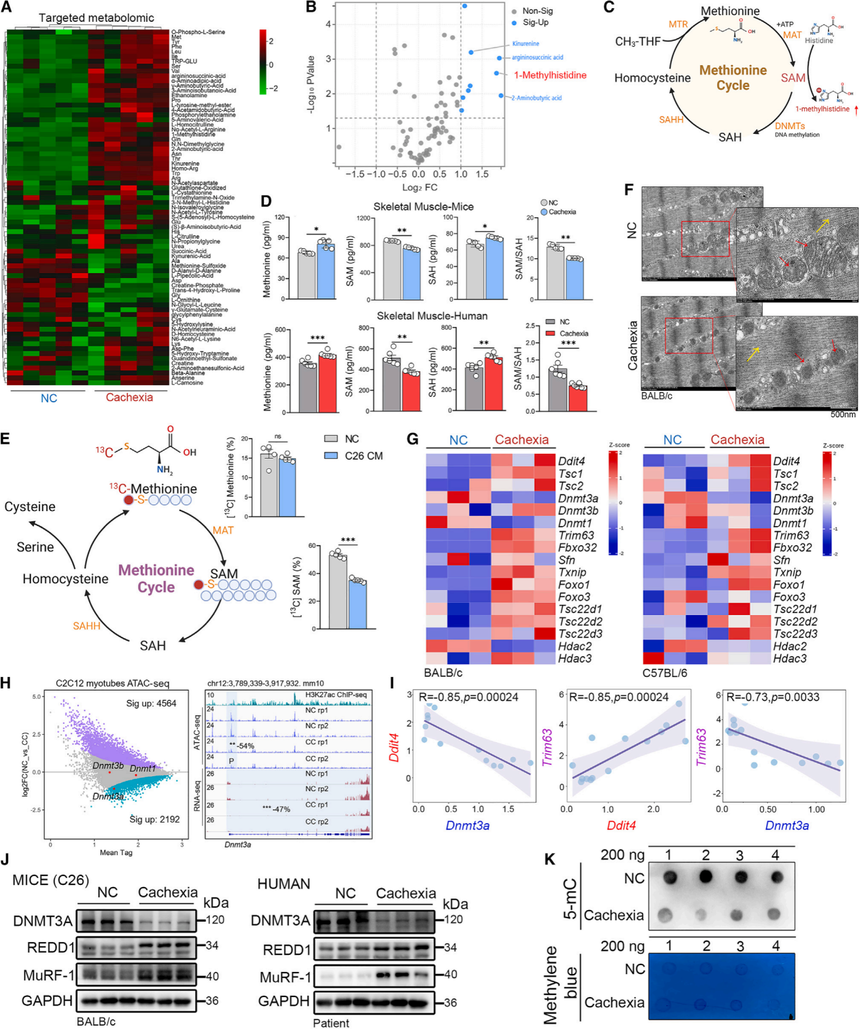
图1:蛋氨酸代谢失调与癌症恶病质相关
骨骼肌的RNA-seq显示,DNA甲基转移酶3a(Dnmt3a) mRNA下调,Ddit4(编码REDD1,应激抑制因子)上调。这一趋势在两种小鼠品系、两种肿瘤模型中一致(图1G)。C2C12肌管模型的ATAC-seq数据显示,Dnmt3a启动子区域的染色质开放性降低(图1H)。关联分析发现Dnmt3a表达与肌萎缩标记基因Trim63、Fbxo32呈负相关;而Ddit4的表达则与这些标志物呈正相关。Ddit4的表达还与肌肉收缩基因肌球蛋白重链(Myhc)呈负相关(图1I)。Western blot在小鼠和CC患者肌肉中验证结果表明DNMT3A蛋白减少、REDD1蛋白增加;同时恶病质肌肉的5mC DNA dotblot结果表面DNA甲基化水平下降,这与DNMT3A的下调相关(图1K)。此外,在C26和LLC小鼠模型以及人类患者中,蛋氨酸腺苷转移酶2A(MAT2A)(Met→SAM)的水平也有所降低,这为 SAM 供应不足再添证据。
上述数据表明蛋氨酸代谢在癌症恶病质中功能失调,DNMT3A和REDD1之间都存在显著的负相关性。
2. DNMT3A调控癌症恶病质中的肌肉功能
鉴于DNMT3A对骨骼肌功能尤为重要,研究者通过“强行补回”骨骼肌中的DNMT3A,评估其对肿瘤恶病质(cachexia, CC)所致肌肉萎缩的保护作用,并在体内(小鼠)和体外(成肌管)两条线验证了效果。
在小鼠中过表达DNMT3A后:整体体重、右后肢握力与肌肉切片的横截面积(CSA)均明显改善(图2B、C和D);后肢肌重得到恢复,但对全身瘦体重、去瘤体重或 iWAT/心肌重量作用有限(图2E);肌肉切片无胶原沉积,表明CC与肌肉纤维化无关,且恢复DNMT3A表达可改善肌肉功能,但不能增加肌肉糖原水平。从分子水平上看,过表达DNMT3A后,萎缩标记Trim63 / Fbxo32基因的表达显著降低,这表明DNMT3A可能对恶病质引起的肌肉萎缩有保护作用(图2F)。过表达DNMT3A还改善了骨骼肌降解标志物,包括泛素-蛋白酶体途径(UPP)(MuRF-1和atrogin-1)和自噬途径(LC3转换,LC3-II/I和P62)(图2G)。过表达DNMT3A显著改善了磷脂酰肌醇3-激酶 (PI3K)-蛋白激酶 B (AKT) 通路的抑制,并恢复了肌球蛋白重链 (MyHC)的表达(图2G)。此外,DNMT3A的表达抑制了肿瘤诱导的肌肉中REDD1的上调,凸显了其在调节REDD1和肿瘤诱导的肌肉萎缩中的关键作用(图2G)。
C2C12成肌管中过表达DNMT3A同样减轻了C26-CM诱导的细胞萎缩,恢复MyHC,抑制LC3-II 和REDD1,在MuRF-1和atrogin-1、PI3K-AKT通路活性、LC3和MyHC表达方面也观察到了改善(图2J)。
以上结果表明,过表达DNMT3A可能通过抑制Ddit4/REDD1表达来减轻癌症恶病质引起的肌肉萎缩。在肌肉中恢复DNMT3A的表达能有效激活PI3K-AKT通路并缓解肌肉萎缩。
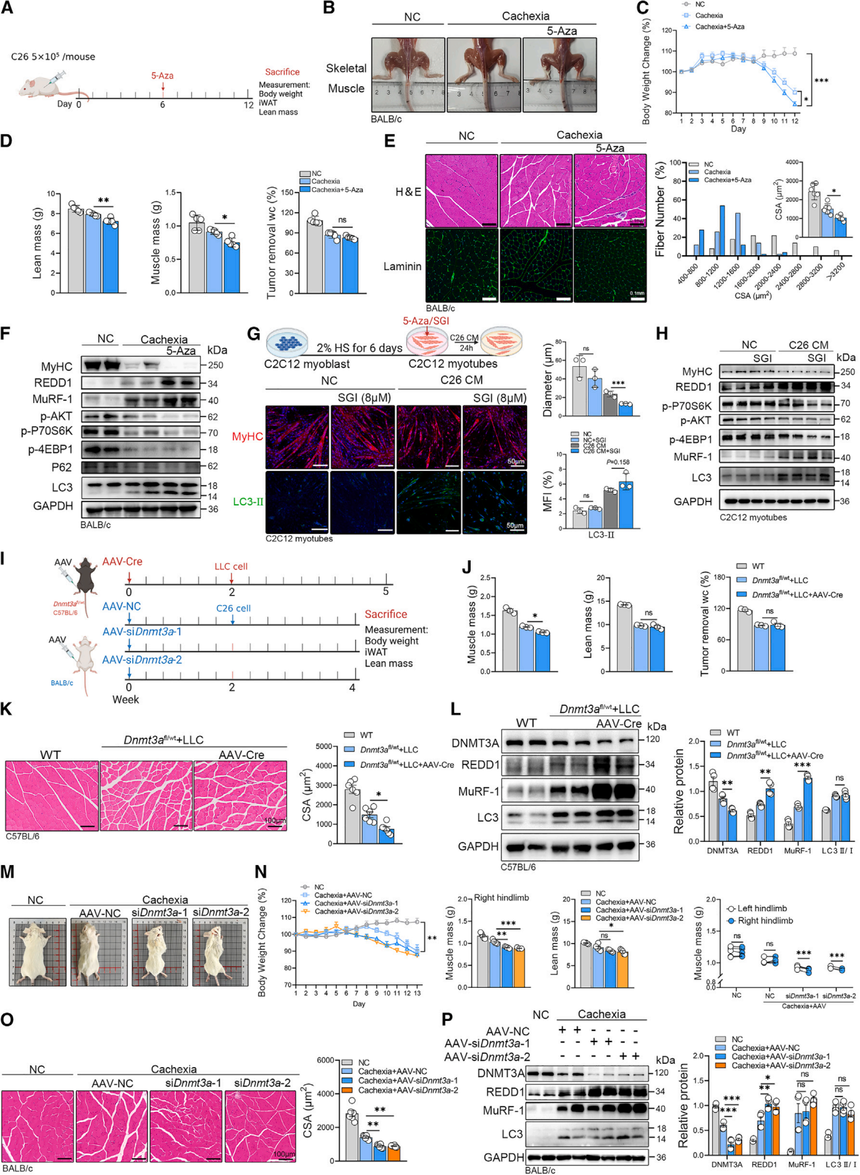
图2:DNMT3A过表达可逆转癌症恶病质中的肌肉萎缩
3. DNMT抑制会加剧恶病质症状和分子特征
随后,研究反向操作,把DNMT活性“拉低”,看看对恶病质肌肉有什么影响;结果发现——无论是药物抑制还是基因敲低,只要 DNMT(尤其是DNMT3A)被关掉,肌肉萎缩都会明显加剧。
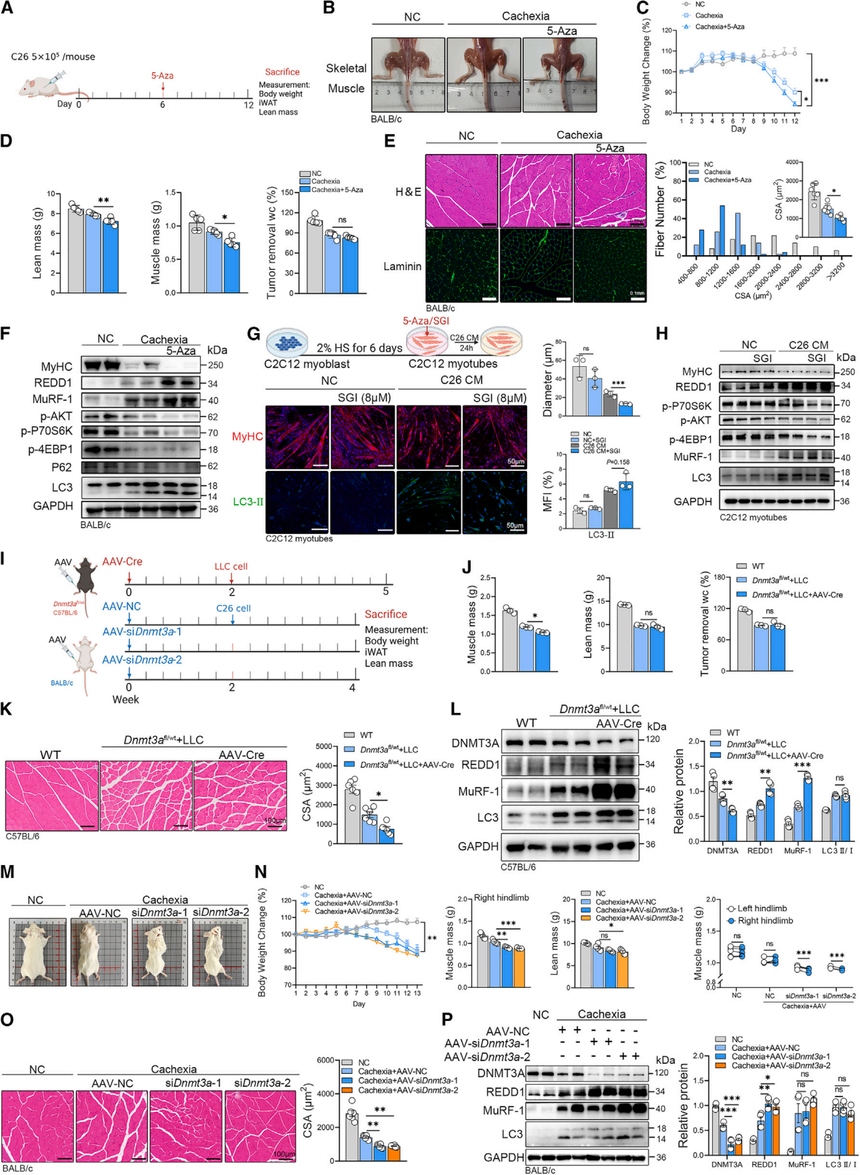
图3:抑制DNMT活性会加速癌症恶病质中的骨骼肌萎缩
4. REDD1基因敲除小鼠改善CC诱导的肌肉萎缩
为了研究REDD1在肌肉萎缩中的作用,研究使用了REDD1KO的C57BL/6小鼠,建立了肿瘤诱导的恶病质模型(图4A),骨骼肌降解得到了显著改善(图4B)。Ddit4基因的敲除显著改善了心脏和iWAT的重量损失,同时抑制了肿瘤生长。体重变化的改善(图4C和4D)表明整体身体成分可能有所改善。H&E染色和层粘连蛋白染色证实,REDD1敲除显著改善了肌纤维的横截面积(CSA)(图4E)。免疫印迹法显示,Ddit4基因的删除改善了恶病质状态下的骨骼肌降解,特别是在REDD1 KO小鼠中降低了MuRF-1和LC3的水平(图4F)。PI3K-AKT通路的抑制状况得到恢复,MyHC的表达水平也同样恢复(图4F)。这些结果有力地支持了REDD1表达在肿瘤诱导的肌肉萎缩中所起的关键作用,并凸显了其在这一病理过程中的重要性。REDD1 KO显著减轻了肌肉中PI3K-AKT通路的抑制,从而减少了自噬和UPP通路的激活。
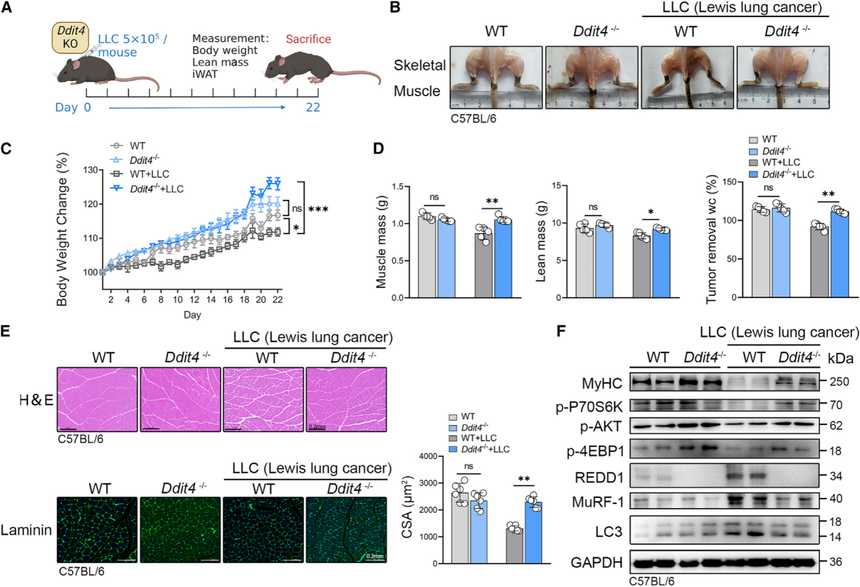
图4:REDD1基因敲除减轻恶病质引起的肌肉萎缩
5. DNMT3A通过DNA甲基化调控Ddit4的表达
为了研究DNMT3A和REDD1之间的调控关系,研究使用MethPrime甲基化预测网站预测到Ddit4/DDIT4的启动子区域内存在一个大的CpG岛。MSP、BSP均显示——无论癌因性恶病质小鼠还是临床肌肉活检,Ddit4启动子甲基化显著降低(图5A和5B);在肌肉过表达DNMT3A,甲基化水平回升,Ddit4表达被压下。因此,可以得到结论DNMT3A缺失→启动子去甲基化→ Ddit4获得转录活性。
在转录过程中,转录因子(TF)的招募是主要驱动力。于是,研究团队开始找寻DNMT3A-Ddit4调控轴中潜在的转录因子。鉴于信号转导与转录激活因子3(STAT3)在肌肉中的关键作用,研究使用抑制剂来评估其在恶病质期间的功能。抑制STAT3可减轻肌肉萎缩,但REDD1的表达没有改变。于是,研究团队重新分析了ATAC-seq数据,并联合了H3K27ac、H3K4me3的ChIP-seq数据。C2C12细胞的开放染色质区域内,ATF家族(ATF2/ATF4)结合位点最富集(图5F)。鉴于ATF4是内质网应激(ER stress)的一个重要指标,RNA-seq数据集观察到恶病质骨骼肌中内质网相关基因的上调(图5G)。因此,研究推断恶病质肌肉中发生了内质网应激。随后,多项证据指向Ddit4、Atf4和内质网功能之间存在联系(图5H、I和J)。
为进一步阐明ATF4在REDD1表达调控中的作用,过表达ATF4、ATF4激活剂处理细胞、ChIP-qPCR等结果表明DNMT3A主要通过表观遗传调控影响Ddit4的表达。
综上所述,研究结果表明,在结直肠癌诱导的肌肉萎缩过程中,DNMT3A通过其DNA甲基化功能调节Ddit4的转录(图5N)。内质网应激促进ATF4的表达,其失调的表达与DNMT3A介导的表观遗传修饰协同作用,共同调控Ddit4的表达。
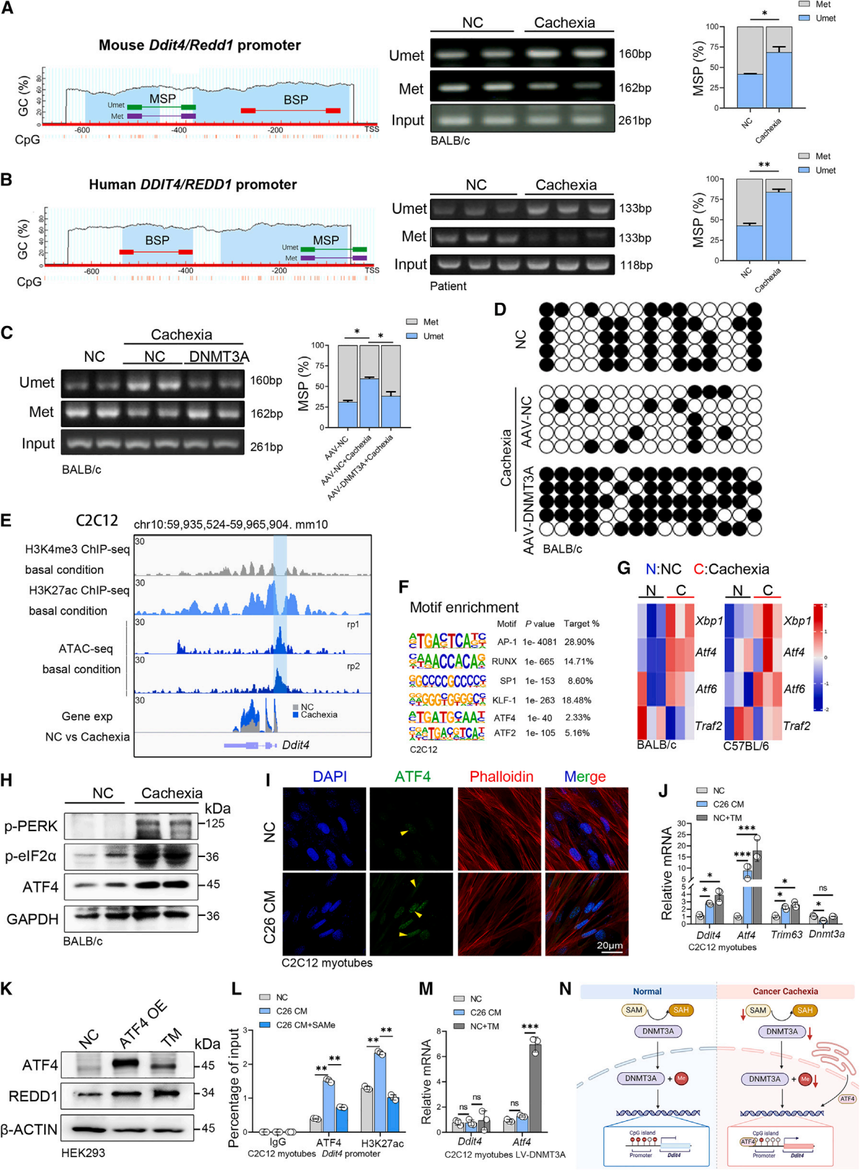
图5:DNMT3A通过ATF4表观遗传调控Ddit4基因表达
6. 补充蛋氨酸可减轻CC介导的肌肉萎缩
接下来,研究团队完善了“补蛋氨酸(Met)→甲基供体SAM↑→DNMT3A甲基化活性增强→Ddit4/REDD1表达被压下→mTOR-AKT通路重启→肌肉萎缩减轻”这一完整逻辑链。
首先,在C26肿瘤恶病质小鼠中,日常饮水或饲料添加Met。表型层面:体重下降幅度明显变小,去瘤体重、骨骼肌重和瘦体质量均恢复,心脏、iWAT 和肿瘤重量无明显变化(图6A-6C);组织学(H&E、Laminin)显示肌纤维横截面积增大,萎缩显著改善(图6D)。分子层面:MuRF-1、atrogin-1、LC3等降解标记下调,PI3K-AKT-mTOR信号及结构蛋白MyHC 恢复(图6E)。代谢结果侧证:肌肉内SAM显著升高,SAM/SAH比值改善;同样变化在血清中不明显——提示Met首先在肌肉内转化成 SAM(图6F、6G)。伴随效应:Ddit4启动子甲基化水平上升,REDD1蛋白下降(图6H)。
其次,研究使用DNMT抑制剂5-氮杂胞苷(5-Aza)来证明DNMT在蛋氨酸对恶病质小鼠的作用中所扮演的角色(图6I)。共同给药,Met的保护作用被部分/大幅逆转——体重、握力、肌肉萎缩、MuRF-1/LC3/MyHC/REDD1水平再次恶化。
C2C12肌管在无Met (Met-free, MF) 培养基中模拟“甲基匮乏”,无论正常还是DNMT3A 过表达细胞都出现更严重萎缩;DNMT3A过表达在MF条件下也救不了肌肉(图6L、6M)。MF处理使Ddit4/REDD1大幅上调,而这一效应依赖于DNMT3A(图6L、6N)。这意味着没有甲基供体,再多DNMT3A也“巧妇难为无米之炊”。
综上所述,以上结果证明,蛋氨酸在DNMT3A介导的DNA甲基化过程中起着关键作用,具体表现为对Ddit4/REDD1的表观遗传调控以及在癌症恶病质中维持肌肉功能。这些结果表明,蛋氨酸通过提供SAM,促进对REDD1的抑制并激活AKT通路,从而增强肌肉代谢。
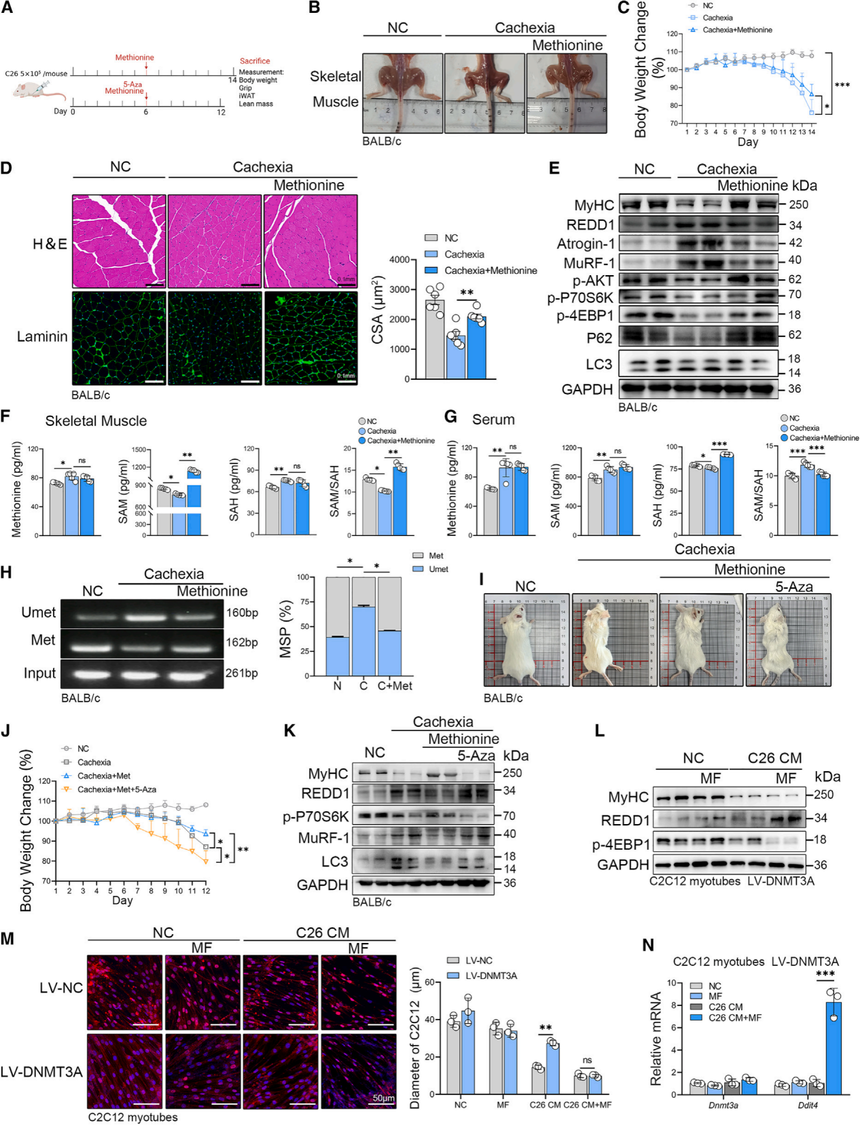
图6:蛋氨酸补充通过消除Ddit4基因表达逆转肌肉萎缩
7. 补充蛋氨酸和直接甲基供体可改善恶病质肌肉功能
随后,研究对比3种潜在甲基供体(SAMe、叶酸、甜菜碱)对肿瘤恶病质肌肉萎缩的影响(图7A)。研究结果表明只有SAMe有效果,补充SAMe可以延缓体重与瘦体质量下降,增加肌肉、心脏重量,肌肉萎缩得到显著改善,脂肪组织也有所改善。Western blot显示MuRF-1和LC3的表达来减弱肌肉萎缩,并逆转了REDD1的抑制。ATP水平回升,提示能量代谢恢复。
在体外实验中,SAMe有效减轻了C2C12肌管萎缩,并证实在萎缩条件下REDD1的表达被逆转。代谢组学的结果显示只有补充SAMe能有效降低升高的甲基代谢物水平,如1-甲基组氨酸和N,N-二甲基甘氨酸。这表明补充SAMe能增强DNMT3A的表达,支持肌肉中的DNA甲基化过程,并减少REDD1的激活。蛋氨酸循环的正常运作解释了C2C12肌管中异常线粒体和内质网形态的显著恢复。总之,补充SAMe能显著改善肿瘤诱导的恶病质肌肉降解,而FA和甜菜碱则没有显著效果,这可能是由于它们在体内转化为甲基供体的途径不同所致。
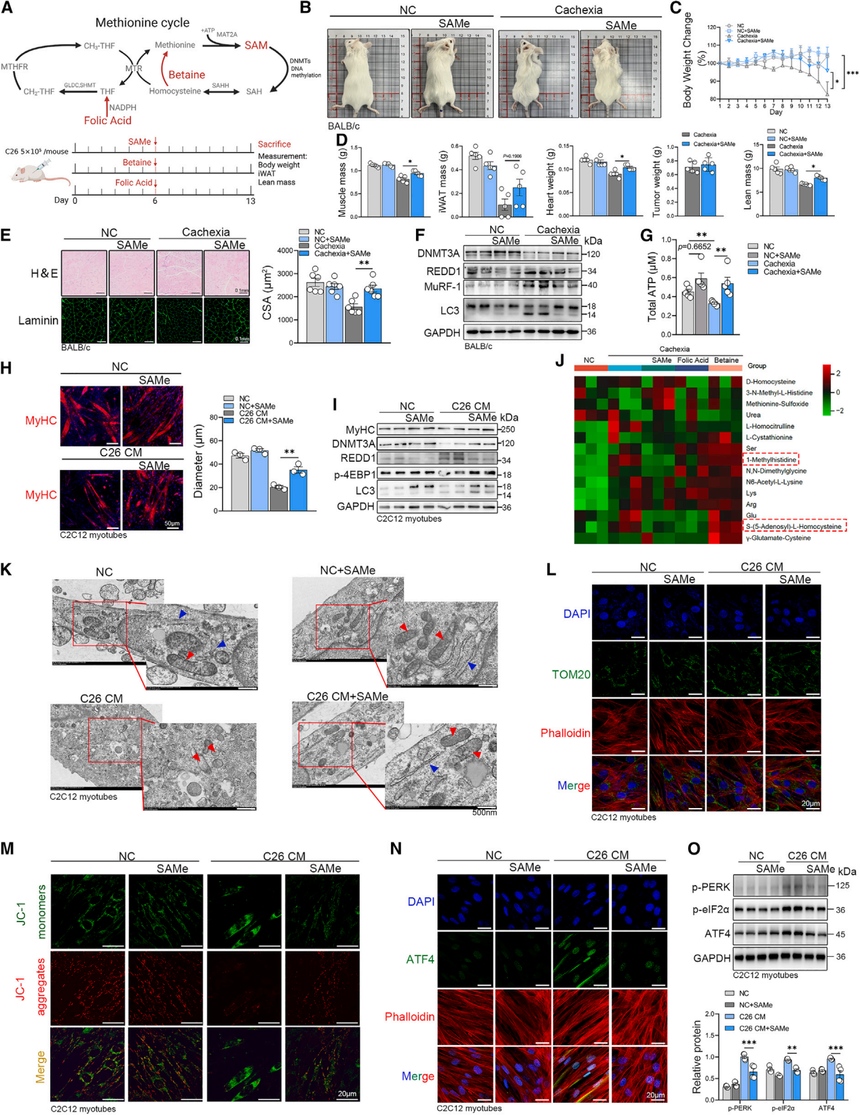
图7:甲基供体通过DNMT3A/REDD1轴改善肌肉萎缩
研究结论
总而言之,该研究首次揭示了蛋氨酸稳态在癌症恶病质引发的肌肉萎缩中扮演的关键角色,并进一步厘清了其分子机制。主要有四个发现:① CC过程中蛋氨酸代谢显著失衡;② 蛋氨酸代谢可调控REDD1,从而影响肌肉功能;③ 蛋氨酸缺失经SAM通路诱发内质网应激;④ 适量补充蛋氨酸或SAMe有望改善CC所致肌肉萎缩。更重要的是,该研究揭示了蛋氨酸作为甲基供体,通过表观遗传方式调控 Ddit4/REDD1,为开发基于营养干预的治疗策略提供了新的思路。未来,结合临床验证与精准补充方案,或可为恶病质患者带来切实可行的肌肉保护新途径。