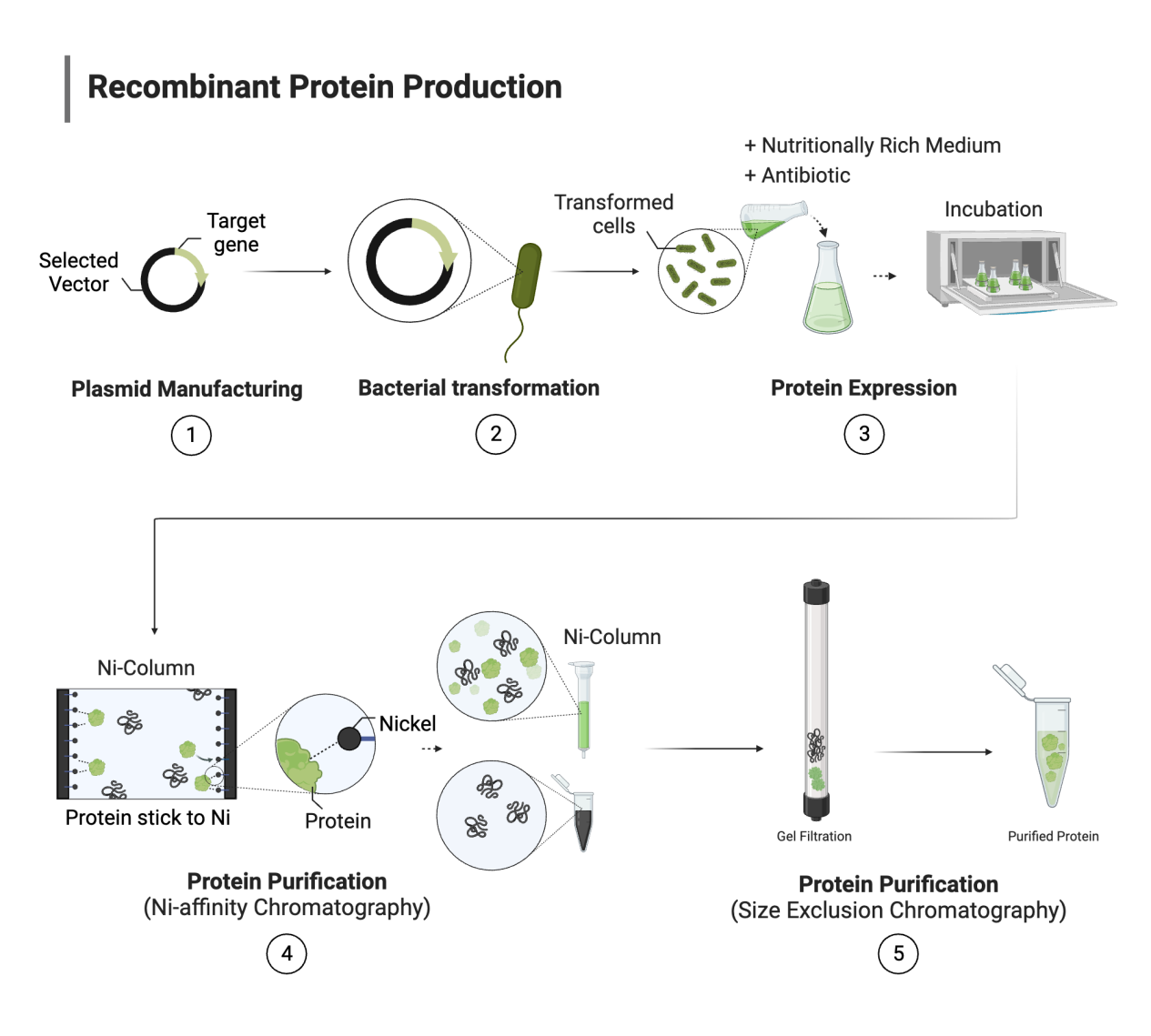
重组蛋白基础与技术概述
重组蛋白是指通过基因工程技术,在宿主细胞中表达和纯化的特定蛋白质分子。这一技术使得科学家能够大规模获得高纯度的目标蛋白,为生命科学研究提供了重要的工具试剂。重组蛋白技术的核心在于将目标蛋白的编码基因导入合适的表达宿主,通过宿主的转录翻译系统合成目标蛋白,再经过一系列纯化步骤获得最终产品。
重组蛋白的基本特性
重组蛋白的结构基础源于其氨基酸序列,这一序列决定了蛋白质的三维结构和生物学功能。与天然提取的蛋白相比,重组蛋白具有明确的序列信息和一致的翻译后修饰特征。蛋白质的一级结构是指氨基酸的线性排列顺序,二级结构包括α-螺旋和β-折叠等局部空间结构,三级结构是整个肽链的折叠形态,而四级结构则涉及多条肽链的组装。
重组蛋白的生物学活性与其空间构象密切相关。构象的完整性依赖于分子内氢键、疏水作用、二硫键等化学力的平衡。在重组蛋白生产过程中,维持这些相互作用的稳定是确保蛋白功能的关键因素。许多重组蛋白需要形成特定的三维结构才能发挥其生物学功能,如与配体结合、催化生化反应或参与信号转导。
重组蛋白的分类体系
根据结构和功能特性,重组蛋白可分为多种类型。细胞因子是一类重要的重组蛋白,包括白介素、干扰素、趋化因子和生长因子等,它们在细胞间信号传递中发挥重要作用。另一大类是酶类重组蛋白,如激酶、磷酸酶、蛋白酶等,参与各种生物化学反应。膜蛋白和受体蛋白也是常见的重组蛋白类型,但由于其疏水特性,表达和纯化难度较高。
根据表达系统的不同,重组蛋白的翻译后修饰特征存在显著差异。哺乳动物表达系统如CHO或HEK293细胞能够完成复杂的糖基化、磷酸化和乙酰化等修饰,最接近天然人类蛋白的修饰模式。昆虫细胞表达系统能够进行基本的糖基化,而原核表达系统如大肠杆菌则无法完成真核特异的翻译后修饰。
重组蛋白的质量控制
重组蛋白的质量评估包括多个关键指标。纯度通常通过SDS-PAGE和高效液相色谱分析,高纯度的重组蛋白应达到95%以上的纯度。浓度测定常用紫外分光光度法,基于蛋白质中酪氨酸和色氨酸的吸光特性。生物活性检测则通过细胞增殖实验、酶活性测定或结合实验等方法验证。
重组蛋白的稳定性是另一个重要考量因素。冻干制剂通常具有更长的保质期,而液态制剂则更方便使用。适当的保存条件,如温度、pH值和保护剂的选择,对维持蛋白稳定性至关重要。多次冻融和机械剪切力等物理因素可能导致蛋白变性或聚集,因此在处理过程中需要特别注意。
重组蛋白的应用场景
在科学研究中,重组蛋白作为标准品在定量分析中发挥关键作用。它们为免疫检测实验提供已知浓度的参照,确保实验结果的准确性和可重复性。在细胞培养中,重组生长因子和细胞因子是维持细胞体外增殖和分化的必要条件。
重组蛋白也是药物筛选平台的重要组成部分。它们可用于高通量筛选实验中评估化合物与靶蛋白的相互作用,为药物开发提供初步数据。在结构生物学研究中,均匀一致的重组蛋白样品是获得高质量晶体进行X射线衍射分析或进行核磁共振研究的前提。
蛋白质-蛋白质相互作用研究同样依赖于重组蛋白技术。通过表面等离子共振、等温滴定量热或共免疫沉淀等技术,科学家能够详细描绘生物分子间的相互作用网络。标记重组蛋白,如带有荧光标签、生物素或His标签的蛋白,进一步扩展了这些研究的可能性。
结语
重组蛋白技术为生物医学研究提供了强大而灵活的工具,科学家通过精确控制蛋白的序列和表达条件,能够获得满足特定实验需求的高质量蛋白试剂。
参考文献
1.Rosano, G.L. & Ceccarelli, E.A. Recombinant protein expression in Escherichia coli: advances and challenges. Front. Microbiol. 5, 172 (2014).
2.Chen, R. Bacterial expression systems for recombinant protein production: E. coli and beyond. Biotechnol. Adv. 30, 1102-1107 (2012).
3.Yin, J., Li, G., Ren, X. & Herrler, G. Select what you need: a comparative evaluation of the advantages and limitations of frequently used expression systems for foreign genes. J. Biotechnol. 127, 335-347 (2007).
4.Demain, A.L. & Vaishnav, P. Production of recombinant proteins by microbes and higher organisms. Biotechnol. Adv. 27, 297-306 (2009).
5.Khan, K.H. Gene expression in Mammalian cells and its applications. Adv. Pharm. Bull. 3, 257-263 (2013).