生物化学Learning Track(15)酶活性的调节
本笔记基于杨荣武教授主编的《生物化学》第四版,若未说明,配图也源于教材
酶活性调节的目标就是酶在正确的时间、正确的地点有着正确的活性。酶活性调节的方式主要有两种,一种是量变(改变酶的浓度),一种是质变(改变酶的活性),一般来说酶对于活性的调节是以其中的一项为主。
酶的“量变”
1. 同工酶
同工酶指的是同一生物体内催化相同反应但是在结构上有所不同的酶。同工酶在结构上的差异可以是在一级结构上,这可能是因为编码基因不同或者是mRNA的可变剪切等导致的,对于四级结构的不同,那么是因为构成它们的亚基以不同的方式组合在一起造成的(也就是比如这一类同工酶可能有2种亚基A和B,对于同工酶1可能是由两个A亚基构成,对于同工酶2可能是由一个A亚基和一个B亚基构成,对于同工酶3可能是有2个B亚基构成(A亚基和B亚基的一级结构存在不同) )。
部分同工酶的分布具有组织特异性(不同组织可能具备不同类型的同工酶,或者同工酶的量存在较大差异),亚细胞定位特异性(不同细胞器内的同工酶的类型或者含量比例可能存在差异)以及时间特异性(可能在生物不同的发展阶段,同工酶的类型和含量也会发生转变)
同工酶由于其结构上的不同不仅导致其在理化性质上的差异,同时也可能导致其在动力学(米氏常数和最大速率)或者在调节机制上的差异。比兔对于不同组织的细胞,其对于代谢路径的倾向性是不同的,这样可能是由于选择了不同的同工酶造成的。比如乳酸脱氢酶(LDH)由五种形式(M4,M3H,M2H2,MH3,H4),那么在骨骼肌细胞当中主要是M4,在心肌细胞当中主要是H4,因为在骨骼肌细胞当中倾向于对于乳酸的积累,而M4恰好对于丙酮酸的Km低于乳酸,这样酶对于丙酮酸就具备更好的亲和力(脱氢能力),从而使得乳酸积累(注意乳酸积累是果,M4是因),对于心肌细胞当中,H4对于乳酸的Km更低,会促进乳酸在心肌细胞当中的分解。
同时不同同工酶由于其结构的不同,也可能会使得其的调节机制不同,这会给酶活性的调节带来更大的灵活性
(之前我们提到了同工酶的组织特异性,其实这可以用来作为疾病的检测,比如H4-LDH本来就是在心肌细胞当中特异表达的,但是如果我们在血液当中检测到了H4,那么就可以作为心脏病的诊断指标之一)
(这里有必要再次强调一下,就是我们这里说的对于酶活性的调节是使得酶可以在正确的时间,在正确的位置有着正确的活性,那么这里的活性除了我们理解的催化活性,也可以理解为对于不同代谢途径的倾向性。那么我们在这里说同工酶,其实更多地是站在整个生物体的角度分析跨组织这些酶的类型和含量有什么差别,而不是聚焦于某一个细胞。对于某一个细胞而言,由于基因的选择性表达,其对于酶的选择可能是相对固定的)
2. 酶的合成和降解
这一部分书上相当于放了一个链接跳转到基因表达调控这一节。但是小编正好最近也系统学习了一下基因表达调控的内容,所以我这里就不放链接了,但是也是简要提及一下。
对于基因表达调控首先我们需要对基因进行一个再定义,我们之前说的基因可能更多的是对于编码蛋白质的基因,但是除此之外,基因也可以编码RNA,这些RNA不依赖于翻译过程而直接行使生物功能(虽然其可能作用于其他蛋白合成途径的翻译过程。)但是即使是这样的定义也是不完善的,事实上,研究表明,对于一个物种的基因组而言(这里我们更多偏向于分析真核生物),一个基因可能受到了多个DNA 位点的调控,那么这些位点实际上对于基因的表达上也发挥着重要作用,那么这些位点是否可以被称作基因呢?这里不再深究,只是有个概念就好。
那么对于原核生物而言,其的基因表达和真核生物的很不相同,但是基本上对于基因的表达调控也是基于transcription control 和post-transcription control,还有后面对于翻译过程的调控,由于主要的调控机制在transcript这一步,那么我们也就在这里仅仅介绍这一步。
原核生物的基因更多是以一个operon的形式存在的,在这个operon当中在基因的上游有两段序列,promoter和operator,promoter(启动子)是RNA聚合酶结合的位点,对于原核生物而言,RNA聚合酶的结合仅仅需要一个General Transcription factor(通用转录因子),因此这一过程比真核生物要简单得多,至于operator(操纵子)是Repressor和大部分的Activator结合的地方,这些也是TF(transcription factor),也被称为反式调控因子,这些因子可以通过与operator或其他位点(对于Activator)的结合,来对RNA聚合酶结合启动子这一过程产生调控。之所以在Activator这里没有说operator也是Activator结合的位点,是因为部分的Activator是结合在其他位点处的(一般是基因的上游,称作Activator-binding-site,在原核生物我们不称为enhancer),这些位点离promoter也不会很远,但是对于promoter的作用可以有DNA loop来介导。至于原核生物的基因是由多个基因组成的一个Cluster,也就是这些基因是同时转录的,共用一个mRNA,然后这些mRNA在翻译的过程当中,通过特定位点的识别,ribosome会reinitiate translation,这样来实现对于多个基因表达产物的分离。原核生物对于基因的表达调控机制较为简单,我们不再多介绍。
现在来看真核生物,同样我们先聚焦于基因的结构。首先我们要时刻记住,真核生物的DNA是和组蛋白等蛋白结合形成核小体的,这一点对于真核生物的转录调控也非常重要。
首先,我们先假定对naked DNA进行分析,其上的基因实际上包括了外显子(exon)和内含子(intron),然后在基因的上游有promoter,同样是RNA聚合酶结合的位点,但是与原核细胞不同的是,这里我们没有对真核细胞的基因有operator的定义,因为对于真核生物的TF有着更加灵活的结合,而非局限在这一个区域内。那么对于RNA聚合酶与operator的结合,需要多种GTF的作用,不仅如此很多基因是受到了其他TF的作用。同样我们把可以激活或者促进基因表达的蛋白称为Activator,反之称之为Repressor(记住,这是蛋白),然后我们把Activator结合的序列称为enhancer,对于Repressor结合的序列称为Silencer,(注意这两个是序列)。那么enhancer和Silencer的位置是高度灵活的,但是也有相当一部分是分步在基因的附近的。为了保证enhancer和Silencer的基因特异性(仅仅激活或抑制特定基因),序列上还存在insulator,这些序列可以募集特定蛋白,形成一个DNA拓扑结构域(部分生物具有,其他生物可能是类似的机制),这样将这些序列彼此靠近从而既保证可以作用同时保证特异性
那么这些Activator和Repressor(TF,直接结合DNA序列),作用的方式有很多,目的都是一个促进或抑制基因的表达,比如Activator可以通过与co-activator结合募集其他TR(transcription regulator,包括了TF),促进RNA聚合酶与promoter的结合(也可以直接结合RNA聚合酶发挥促进作用),同时这些募集到的蛋白如Mediator构成了一个complex,这个complex可以促进DNA从组蛋白解开(可以对组蛋白进行乙酰化和磷酸化修饰),从而促进RNA聚合酶的推进。那么Repressor也通过类似的方式抑制,除了与Activator形成拮抗作用,也可以促进组蛋白的去乙酰化或者甲基化,从而抑制转录。
这是transcript这一步的调控,简单概括可以理解为对RNA聚合酶与promoter亲和力的调控和对组蛋白的修饰调控。
之后再转录后,可以进行pre-mRNA的可变剪切,这一部分可以有一种mRNA产生不同的成熟mRNA,这一部分的调控可以有regulatory protein负责
同时细胞当中也存在micro RNA,这些micro RNA首先在核内编码然后形成区域内互补配对,形成一个类似发夹型的结构,再通过酶的剪切,形成双链RNA(不是perfect match),这个双链RNA会在另外一个蛋白的作用下选择一条链,另一条链舍弃。形成的RNA-蛋白质复合物可以与细胞中存在的RNA进行配对,如果perfect match,那么会对此RNA进行chop up,对于partial match,则会抑制此mRNA的翻译,比如直接结合在这条RNA上,block translation。
那么我们也可以对翻译前进行调控,比如翻译时核糖体和mRNA的结合同样是受到蛋白的作用,比如eIF-2是结合在核糖体小亚基上的调控蛋白,如果这个蛋白被磷酸化了,那么就翻译过程就无法进行。那么即使在蛋白质合成之后,细胞仍然可以对其进行磷酸化、泛素化修饰来决定蛋白活性。因此对于基因的表达调控而言,是十分复杂的,在每一步都存在很多的调控方式和手段。
(另外需要注意的是,我们提到的enhancer和Silencer是具有组织特异性的,另外对于enhancer、Silencer、insulator、promoter和gene都是无法直接从全基因组测序得到位点的,需要经过ChIP-seq等多种方式才可以得到)
酶的质变
酶的质变有多种方式,主要包括了别构调节、共价修饰、水解激活、调节蛋白的结合与解离以及液-液相分离。
1. 别构调节:
别构调节也称变构调节,是调节酶活性最快的一种方式,原理就是通过它的别构中心结合别构效应物,诱导酶的构象发生改变,从而导致酶活性发生变化。其中起抑制作用的别构抑制剂也称为负别构效应物,起激活作用的别构激活剂也称为正别构效应物。充当别构效应物的配体一般是细胞正常代谢产生的内源性代谢物,如一条代谢途径的终产物,某一步反应物的底物或者产物。由底物作为别构效应物产生的别构效应称为同促效应(别构蛋白结合的别构效应物与活性中心的配体是同一种分子时,该配体结合后通过构象改变,调节后续相同配体与蛋白结合亲和力的现象(即同一个分子调节自身与蛋白结合效率)),否则称为异促效应。许多别构酶具有多个别构中心,能够与不同别构效应物结合。
由于别构效应物与别构中心总是通过非共价键结合,所以别构调节改变酶活性是可逆的。
反馈抑制(终产物抑制):一条代谢途径,通常是合成代谢途径的终产物作为别构抑制剂,抑制位于其上游作为限速酶的别构酶的活性,从而关闭自身合成的一种调节方式。
反馈抑制的一般情形是一条代谢途径的最后一步形成的终产物抑制第一步反应的酶,但是如果在代谢途径当中存在分支(如图)
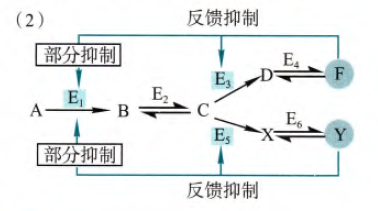
那么F会反馈抑制E3,部分反馈抑制E1,同理Y,这样就使得E1在F和Y都过量的时候才会被完全抑制,如果有一个产物仍需合成,E1的活性就不会被完全抑制住。那么这样分别抑制分步抑制的好处十分明显:对于某一产物过量,可以特异性关停这个产物的合成途径,但是不会很大程度影响到另外一个分支产物的合成。这样的反馈抑制,有利于避免产物积累可能导致的毒性,同时也可以促进能量的合理分配。
除了反馈抑制之外,还有其他的方式可以进行别构调节,比如前馈激活(是指代谢途径中位于上游的代谢物作为别构激活剂去激活下游酶的活性),底物激活(同促调节,有两方面的含义,一方面是底物结合到活性中心会促进底物与活性中心的亲和力增强即正协同效应,另一方面是底物与酶的别构中心结合激活酶活性),底物抑制的定义可以仿照底物激活
有两种模型可以解释酶的别构效应和与底物结合的协同效应,一种是齐变模型,一种是序变模型
齐变模型
齐变模型也称为对称模型,这个模型的建立是基于别构酶是由多个亚基组成的事实。那么齐变模型认为对于这样一个多亚基复合体而言,其在溶液当中是存在两种状态的平衡的,一种是易于与底物结合的松弛态,也就是R态,一种是不利于与底物结合的紧张态,也就是T态。齐变模型的管家假设在于R态和T态之间不存在中间态,即要么所有亚基全部都是R态,要么所有亚基全部都是T态,这亚基之间的齐变是由亚基之间的相互作用导致的。
那么在一个正常的没有激活剂或者抑制剂的溶液当中,绝大部分的别构酶都是处于T态,那么因为底物与R态酶的亲和能力更强,所以当底物分子增多的时候,就促使平衡向着R态移动,从而溶液中有更多的R态,酶对底物的整体的亲和力提高了,从而展现出正协同效应。
那么齐变模型对于别构效应的解释如下:如果是别构激活剂与别构酶结合,相当于由更多的R态,这个时候对于底物的亲和能力就上升了,但是因为此时体系当中已经存在更多的R态,所以增加底物对于平衡的移动影响就逐步变小,所以呈现出一个正协同效果减弱的现象。如果是激活剂的浓度很高的话,那么此时绝大部分的酶都是R态,此时也就几乎不存在正协同效应了(可以理解为给协同效应发挥的空间不大了)那么对于别构抑制剂其实是一样的,抑制剂会使得T态的含量更高,这样会降低酶和底物的亲和力,但是给正协同作用的空间增大了,所以体现出更大的正协同效果。、这里可以呼应到我们在酶动力学里面讲到的别构酶的动力学,对于最开始酶活性越低的(看底物浓度很低的时候)其实受到的抑制作用是越强的,但是随着底物浓度的上升,可以发现这个体系反应速率的提升是最快的,也就是说正协同效果是最强的。
那么齐变模型非常容易理解,但是也非常容易证伪:
1. 事实上,在很多酶中是存在亚基构象混合的中间状态的,也就是没有严格遵循齐变模型的核心假设“齐变”
2. 齐变模型的建设似乎是为了解释正协同效应存在的,比如如果产物结合R,按照齐变模型就是必然会产生正协同效应,那么对于负协同效应就无法解释(这里请不要抬杠,说底物可以结合T,那么就促使R往T的方向移动,产生负协同,这个思路的错误在于T与底物是低亲和力,如果采用这种思路这里的T态反而是我们说的R态)
3. 过于简单,忽略太多复杂的因素。
(但是作为一个学习者来说,我还是非常喜欢齐变模型的,但是我们还是要秉持着学无止境的理念,学习一个更为复杂的但是解释效果更好的模型——序变模型)
序变模型
与齐变模型的最大不同之处是,序变模型接受了杂合酶存在的可能性,也就是一个酶分子当中的亚基的状态不再是规定必须一致,而是在一个酶当中,可以存在R态的亚基,也可以存在T态的亚基
另外,序变模型还强调了底物对酶结构的影响,它不再假定底物只可以与R态结合,而是认为在没有底物的时候,绝大部分的酶几乎都以T态的形式存在,在有底物的时候,底物与T态的结合促使该亚基T态向R态转变。
序变模型另外一个核心假设是,相邻亚基之间存在相互作用,这些相互作用可以使得亚基的状态发生转变。以正协同作用为例,T态酶上的一个亚基因为底物的结合从T态变为R态之后,会促进其他的亚基在结合底物之后更容易转变为为R态(注意是更容易转变为R态,如果没有结合底物还是以T态存在的),从而使得底物结合之后酶对底物的亲和力会增大,从而体现出正协同效应(相邻亚基之间的影响是逐一发生的,所以称为序变)
使用序变模型解释负协同作用也很简单,因为序变模型依据的不是化学平衡的移动,而是亚基结构的改变以及相互影响。当一个底物结合亚基使这个亚基从T态变为R态之后,实际上这个亚基的状态改变会使得相邻的亚基更难以通过诱导契合效应变为R态,从而体现出负协同效果
那么使用序变模型解释别构效应物也很容易,抑制剂就是使得T态更加稳固,难以通过诱导契合使其变为R态,反之激活剂。
其实之所以序变模型可以解释很多,是因为把核心假设搬到了一个非常灵活的角度-结构的变化与互作,其实利用序变模型甚至可以支持一个酶同时受到别构抑制但是仍然是负协同,因为其实发现按照序变模型的假设,并没有说明协同作用和别构作用直接的关联
别构酶实例——氨甲酰转移酶
别构酶的一个实例是天冬氨酸转氨甲酰酶(ATC),是嘧啶核苷酸从头合成途径当中的限速酶,其活性收到严格的调控,以维持细胞内嘧啶核苷酸和嘌呤核苷酸比例的平衡
对大肠杆菌的ATC动力学研究表明,其动力学曲线是S型,活性受到嘧啶合成终产物CTP的反馈抑制,但是受到嘌呤核苷酸ATP的激活,S型曲线表明该酶与底物的结合具有正协同性
ATC全酶是由12个亚基组成,包括6个大的催化亚基(C亚基)和6个小的调节亚基(R亚基)。其中每3个C亚基构成一个催化三聚体,每2个R亚基构成一个调节二聚体,这样一个全酶分子就是有2个催化三聚体和三个调节二聚体构成的。对于这个别构酶可以使用两种模型解释(解释基本上就是仿照我们介绍过的理论就好,至于书上提到的数据和结构咱们略过)
我们主要说一下ATP和CTP作为别构效应物对于ATC活性调节的意义:ATP越多说明嘌呤越多,那么自然要促进嘧啶的合成,符合ATP作为别构激活剂,反之CTP同样如此
2. 共价修饰调节
酶的共价修饰调节是通过对酶分子的某个或者某些氨基酸残基进行化学修饰改变酶活性的调节方式。这是由修饰酶和去修饰酶共同构成的一种可逆的环式调节系统。
由于这种由修饰酶介导的共价修饰调节会涉及更多的途径,所以实际上产生效应会更慢,但是也正是因为途径更长(酶本身可以被别构效应调节),所以可以对更多的效应物刺激产生反应,具有更大的灵活性。另外因为这是由酶介导的,所以可以产生级联放大的效果,对于别构抑制剂或激活剂的微小变化,就可以引发修饰的强度发生剧烈变化。
调节酶活性的共价修饰方式有:磷酸化、腺苷酸化、鸟苷酸化、乙酰化和甲基化等。其中最为常见的修饰方式是磷酸化,能够被磷酸化修饰的残基主要是三种羟基氨基酸(丝氨酸、苏氨酸和酪氨酸),组氨酸(与咪唑基团的两个氮原子进行反应)还有天冬氨酸和谷氨酸(这两个都是与羧基上的羟基反应)。催化磷酸化修饰的酶是蛋白质激酶,磷酸基团来自于ATP,催化脱磷酸化的去修饰酶是磷蛋白磷酸酶即蛋白质磷酸酶
那么磷酸化的作用可以总结如下:
(1)增加两个负电荷,影响静电作用
(2)引入额外的氢键供体或受体,增强了形成氢键的能力
(3)随磷酸基团引入了额外的能量,贮存在磷蛋白上
(前三种可以对蛋白质的结构产生了很大程度的影响,因此可以影响蛋白质的活性)
(4)磷酸化和去磷酸化可以在很长的时间发生,间隔的时间可以调节(磷酸化和去磷酸化的速率本身也受到调节,并没有绝对的大小关系)
(5)产生级联放大,一种激酶的底物可能是另外一种激酶,如此作用具有放大效应
但是一个酶可以在磷酸化下被激活,也可以在磷酸化下被抑制,其根本原因还是由于磷酸化对于酶结构的影响导致的。下面是一些基本的规律(经验规律,不保证绝对性)
1. 对于分解产生能量的酶通常磷酸化激活,对于合成消耗能量的酶通常磷酸化抑制(这里也可以引申出另一经验,如果两个过程是相互拮抗的,比如合成和分解,那么磷酸化对这两个过程的关键酶的作用通常也就是相反 )
2. 关注酶本身的结构是抑制还是激活,如果一个酶本身就是被抑制的,那么磷酸化多半是激活(再抑制有什么用呢?),反之,如果一个酶的活性本身就很高,那么磷酸化多半是抑制的。(另外比如调节亚基如果是抑制催化亚基的活性,那么磷酸化调节亚基,多半是激活这个催化亚基的活性的)
3. 根据代谢通路判断,根据这个通路具体的激活或者抑制的需求来判断磷酸化的影响
不同蛋白激酶的特异性也存在差异,不仅表现在对哪一个残基进行磷酸化,还表现在这个残基处于哪个序列当中。比如有的激酶磷酸化的那计算靠近碱性氨基酸,有的靠近脯氨酸(脯氨酸是部分激酶的关键识别位点,因为其附近经常是苏氨酸或者丝氨酸残基,同时脯氨酸的刚性基团可以保持蛋白结构不会发生很大变化),有的靠近已经磷酸化的氨基酸残基(双负电加强变构,再利用正电残基或者金属离子稳定构象)(如果磷酸化一个蛋白,实际上不仅要保证这个蛋白结构发生适应变化来变更活性,同时我们也希望这个蛋白仍然保持一定的稳定,所以磷酸化的位点要满足这两个条件,可以产生变化,比如我磷酸化一个外围的残基,可能对蛋白结构没有很大影响,那么磷酸化的意义就不大,或者我磷酸化一个很重要的结构基团,虽然会对结构产生很大影响,但是也可能会使得蛋白结构不再稳定。由此可以解释为什么会磷酸化会偏好于碱性氨基酸附近、Pro附近以及已经磷酸化残基附近)
一般根据接受磷酸根的氨基酸残基的性质,将蛋白质激酶分为丝氨酸/苏氨酸蛋白质激酶、酪氨酸蛋白质激酶和双功能激酶(双功能激酶对于丝氨酸、苏氨酸和酪氨酸都可以修饰)。此外还有组氨酸蛋白质激酶,这类组氨酸蛋白质激酶一般是先将自己的组氨酸磷酸化,然后再把磷酸基团转移到底物分子的天冬氨酸上,因此将其称之为组氨酸-天冬氨酸蛋白质激酶会更加合适。
(与蛋白激酶相比,催化蛋白去磷酸化的磷酸酶的种类较少,作用的特异性没有蛋白激酶强,进化的保守性也更强)
酶的腺苷酸化(由腺苷酸转移酶催化,由ATP提供AMP)和尿苷酸化(由尿苷酸转移酶催化,由UTP提供UMP)一般发生在细菌体内,被修饰的氨基酸通常是酪氨酸。催化脱腺苷酸化的没是拖腺苷酸化酶,同理脱鸟苷酸。
二硫键的形成可以认为是一种特殊的共价修饰,以暗反应的一些酶为例,在无光条件下,这些酶会因为二硫键形成从而失去活性,然后在有光条件下,光反应产生的还原性辅酶可以还原并断开二硫键,激活这些酶(这样也可使得光反应和暗反应更好的协同)
3. 水解激活
水解激活指的是一些酶在细胞当中以无活性的酶原形式被合成,需要通过由其他蛋白酶催化或者自催化的方式,水解去除一些氨基酸序列之后才会有活性。
与前面两种质变改变酶活性不同的是,水解激活是不可逆的(因为不可能再通过水解酶的逆反应合成酶原)通过这种机制调节酶活性的主要是一些消化酶,如胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶、羧肽酶和弹性蛋白酶。这些蛋白酶以酶原的形式在胞内合成好之后被分泌到消化道中,然后在消化道内再被水解掉一段氨基酸序列以后才被激活。(其实这些酶如果在分泌前就具备活性,那么就会水解细胞内重要的蛋白质)
除了消化酶之外,绝大多数参与血凝过程的凝血因子也是被水解激活的。
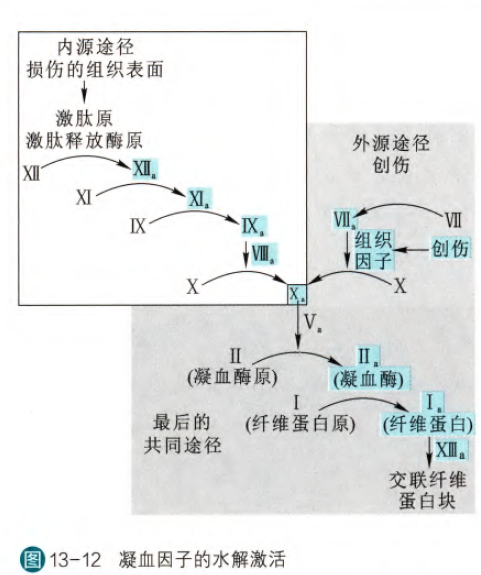
这些凝血因子依次被水解激活,构成凝血的级联反应,最后激活的凝血因子II就是凝血酶,发挥凝血作用。伤口愈合之后,血凝块也必须被清除,这一过程主要由纤溶酶催化,这个酶也是以酶原的方式合成,受组织纤溶酶激活剂(tPA)的水解激活。(维生素K的缺乏会影响到凝血过程,这是因为许多凝血因子在翻译之后需要对谷氨酸残基进行特殊的γ-羧基化修饰,这一过程需要维生素K作为辅酶)
对于外源途径涉及的级联步骤较少其实是由于对于功能的需求决定的,外源导致的损伤一般较大,所以需要迅速凝血,故涉及到的凝血步骤不能过多,同时对于内源而言,如果迅速凝血反而容易形成血栓,所以采用级联放大来精准凝血
4. 受调节蛋白的激活或抑制
某些蛋白质也可以作为配体,与特定的酶结合而调节被结合的酶的活性,这些调节酶活性的蛋白质统称为调节蛋白,其中,抑制酶活性的调节蛋白称之为抑制蛋白,激活酶活性的调节蛋白称为激活蛋白。
对于抑制蛋白而言,通常结合在酶的活性中心,通过阻止底物与活性中心的结合来达到抑制的目的。那么之所以抑制蛋白可以结合在酶的活性中心,是因为抑制蛋白通常会模拟底物的结构,从而竞争性抑制酶的活性。
用蛋白质作为抑制酶活性的手段似乎很没有性价比,因为蛋白质的合成需要很多能量。但是其实这些抑制蛋白起着非常重要的特点,首先因为它是生物大分子,而且具备结构特异性,所以就不会像一些调节小分子一样特异性较低同时可能会干扰到细胞的代谢途径(在别构效应当中谈到,很多别构效应物就使得代谢的底物产物或者中间物);另外,这些抑制蛋白一般作用的是非常重要的机制,利用蛋白质结合的强亲和力有助于对特定酶的调控更加精准。
比如,对于一些需要迅速降低酶活性或者含量的酶,如丝氨酸蛋白酶,这些蛋白质过度表达,可能会对机体产生不利的影响,比如在血液当中的丝氨酸蛋白酶,那么就需要抑制蛋白(在这里是丝氨酸蛋白酶抑制剂)直接结合酶然后使其失活。
另外,对于一些非常重要的酶的调控也值得使用这些抑制蛋白。比如与DNA酶结合的抑制蛋白可以使得DNA酶暂时失活同时定位在细胞质中,试想一旦释放,那么DNA蛋白酶便会穿过核孔水解DNA。因此这个抑制蛋白需要胱天蛋白酶(这个酶需要水解激活,是细胞凋亡的重要信号)水解之后,DNA酶才具有活性。
核糖核酸酶抑制剂(RI)作为一种抑制蛋白,与胰核糖核酸酶的亲和力极高,这么高的亲和力有助于使得细胞防止受到泄露或者侵入的核糖核酸酶的侵害(核糖核酸酶是分泌蛋白,但是是直接合成活性酶而非酶原)
使用激活蛋白来调节酶活性的重要例子是使用周期蛋白(cyclin)激活调节真核细胞周期的依赖周期蛋白的蛋白激酶(CDK)。在真核细胞当中,依赖周期蛋白的蛋白激酶的含量基本是稳定的,那么实际上CDK的依次起作用是依赖于周期蛋白的含量依次上升和下调。周期蛋白作为CDK的激活剂可以使得原本无法和ATP结合的CDK暴露位点结合CDK从而被激活。那么除了cyclin可以作为CDK的激活蛋白之外,在真核细胞内广泛存在钙调蛋白在与钙离子结合之后,也可以作为许多酶的激活蛋白起作用。
5. 液-液相分离
有些酶在特定的条件下会局部凝聚在一起,可逆地形成一种无膜包被的生物凝聚物的细胞器结构,即发生液-液相分离来改变活性(这是在特定条件的激活下,局部特定蛋白质浓度的提升,而这些蛋白的汇聚也是其激活的重要条件)
好了,这就是对于酶活性调控的全部内容啦,关于一些细节的代谢途径或者结构分析可以自行查看书籍~
总结一下,我们在这一节主要讲到了酶的两大类活性调节方式,量变和质变,那么再强调一次,酶的活性调节的目的是,使得酶在正确的位点、正确的时间可以有正确的活性。
对于量变,我们介绍了两种,一种是同工酶,也就是在生物体当中(注意范围),其中相同的催化功能但是结构不同的酶,那么我们强调其对酶活性的调节的视角也是生物体,不同组织由于对酶活性的和动力学特性的要求不同,可能会选择不同的同工酶或者调整比例,另外生物体发育的不同阶段也会适时调整同工酶的类型,二是基因表达的调控,这里做了简单的介绍,其实这是一个很复杂的课题,可以以后再深入了解。
对于质变,我们介绍了五种,其中最后一种液-液相分离介绍的不多,可以作为重要的质变补充。那么对于第一种别构调节,是别构效应物与酶别构中心的结合从而激活或者抑制酶的活性,那么根据这些别构效应物的来源,我们可以把其分为反馈抑制(注意多节点情况),前馈激活,底物激活和底物抑制(这两个属于同促效应,分子对酶对本身的结合起调节作用)。然后我们介绍了两种解释酶的协同效应和别构效应的机制,一种是齐变模型,建立在化学平衡的基础上,认为酶仅仅存在两种状态R和T,而不存在中间的过渡状态,这个模型的优点是很简单,可以很清晰地说明正协同效应和抑制效应之间的关联,但是对于负协同效应几乎解释不了;还有一种是序变模型,这个模型最大的优点是灵活性,因为它把核心论点建立在亚基的结构受到底物调节,亚基之间彼此结构关联但是并非同时变化,可以抑制可以激活,也就因此,这个模型似乎可以解释很多现象,但是由于其太灵活了,似乎没有办法将负协同和别构激活以及正协同和别构抑制联系在一起(有万金油的嫌疑)
接着我们介绍了共价修饰,共价修饰的可逆性主要体现在酶上,主要的共价修饰的反式是磷酸化,由蛋白激酶催化磷酸化,由蛋白磷酸酶催化去磷酸化。但是这里有两点比较关键,什么时候磷酸化激活,什么时候磷酸化抑制,这一点需要根据本身蛋白的结构和初始状态以及代谢途径或者信号传导途径当中所起的作用加以判断,另外一点是在何处磷酸化,不仅有残基特异性,也有位点特异性,也做出了简要的分析。
接着是水解激活,水解激活更多强调的是一个蛋白如何从酶原(无活性的状态)通过自水解或者其他蛋白酶辅助水解来激活活性,这里也分析了凝血因子的水解激活途径。
然后是调节蛋白(激活蛋白和抑制蛋白),用蛋白作为抑制或者激活剂,可以见得这个机制的重要性或者是紧迫性,调节蛋白主要有几个优势:高度特异性,强结合力(迅速致使失活),稳定性,这些调节蛋白作为血液当中的丝氨酸蛋白酶抑制剂(seprin),肺泡环境中的弹性蛋白酶抑制剂,DNA酶抑制剂以及核糖核酸酶抑制剂以及CDK激活剂,发挥着至关重要的作用
