PINNs for Medical Image Analysis: A Survey
Abstract
将物理信息融入机器学习框架正在重塑医学影像分析(MIA)。通过引入基本知识与控制性物理定律,这些模型在鲁棒性与可解释性方面均得到显著提升。本文系统探讨了物理信息方法在 IA(简称 PIMIA)中的实际价值,涵盖配准、生成、分类与重建等核心任务。我们对 80 余篇专注 PIMIA 的文献进行了系统综述,提出了一套统一分类法,用于厘清:① 哪些物理知识与过程被建模;② 它们如何被表示;③ 它们以何种策略嵌入 MIA 模型。我们深入剖析了广泛的影像分析任务,包括成像、生成、预测、逆成像(超分辨率与重建)、配准,以及影像分析(分割与分类)。针对每一类任务,我们以表格形式详尽列出:核心物理引导操作、解剖学感兴趣区域、对应成像模态、训练数据集、所采用的深度网络架构,以及所利用的主要物理过程/方程/原理。此外,我们提出了一种全新评价指标,可在不同任务与数据集之间对 PIMIA 方法的性能进行横向比较。基于本次综述,我们提炼并总结了 PIMIA 面临的挑战、开放研究问题及未来方向,重点指出两大关键难题:① 如何选取合适的物理先验;② 如何建立标准化的基准测试平台。
1. Introduction
近年来,医学影像分析(MIA)在图像配准、图像生成、特征提取、图像分类和图像重建等任务中取得了卓越性能(Litjens 等,2017)。这些任务对于辅助诊断、制定治疗方案以及实施治疗干预至关重要。然而,这些成果往往依赖于复杂且数据密集型的模型,缺乏鲁棒性、可解释性,并且未能与物理规律和常识推理有效对齐(van der Velden 等,2022;Kaviani 等,2022)。
将通用机器学习方法应用于医学影像分析时,会面临一系列独特挑战:数据稀缺、采集成本高昂、可解释性要求严格、精度标准高,以及患者间差异显著。纯数据驱动模型需要大量训练数据,收敛缓慢,且往往依赖数百万参数的庞大架构。在医学影像分析领域,由于优质数据匮乏,这些问题愈发突出,严重制约了数据驱动机器学习模型的有效性。
物理方程与数学模型能以简化的类比方式,帮助我们理解人体解剖结构内部的物理过程以及成像的生理机制,从而为医学影像分析任务提供宝贵洞见——尽管它们并不能完全还原这些系统的真实复杂度。例如:将血流建模为非牛顿流体(Toghraie 等,2020);以 Navier–Stokes 方程作为基础物理模型来理解与模拟心血管血流动力学(Li 等,2021)。此外,医学图像的采集过程本身也可表述为微分方程、边界条件与约束:CT 灌注扫描的动力学(de Vries 等,2023);MRI 图像采集的物理原理(Borges 等,2024);MRI 硬件限制(Peng 等,2022)。基于基本方程与领域知识的物理方法,通过体现真实的物理关系,有望提高可靠性与系统安全性(Balageas 等,2010;Hu 等,2019)。因此,医学影像分析亟需一场范式转变——将物理定律纳入其中。
近期研究强调了将物理原理融入机器学习的优势,并已在这一领域确立起主流范式。物理信息机器学习(PIML)把数学物理嵌入机器学习模型,提升了解的相关性与效率。如图1所示,物理信息模型在“数据量”与“物理量”之间实现了数值模型与纯数据驱动模型的平衡。PIML方法能加速神经网络训练,在数据更少的情况下提高泛化能力,并处理复杂应用,同时确保解符合物理定律(Karniadakis等,2021;Hao等,2022)。在计算机视觉模型中引入物理原则,可显著提升其鲁棒性、准确性、效率和功能性(Hao等,2022;Meng等,2022a;Karniadakis等,2021)。随着医学影像分析(MIA)不断融合机器学习和深度学习技术以增强自身能力,它同样能够享受到PIML带来的上述益处。
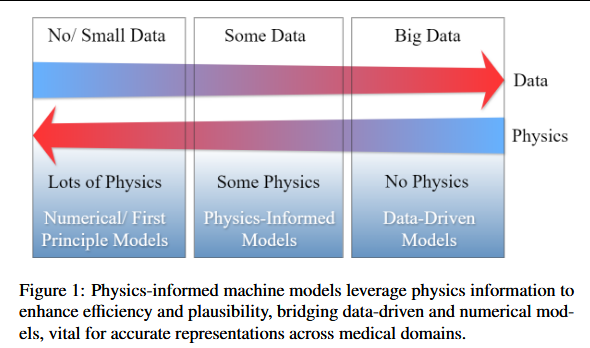
除了与通用机器学习和计算机视觉任务存在共性外,医学影像分析(MIA)还因其输入数据的本质而呈现独特挑战:数据主要是复杂且带噪的人体医学图像。这些挑战包括:数据稀缺且获取成本高昂、可解释性要求严苛、精度需求极高、患者间差异显著。医学图像捕捉的是人体内错综复杂的现象,如血流、肿瘤等病变、金属伪影,以及心脏搏动、肺呼吸等动态器官活动。它们由专门的成像技术生成,常包含机器特定的信息,反映出临床医生所采用的具体处理步骤。有效解读医学图像需要医学物理、生物医学工程、影像诊断学和生物力学等高级领域知识。这种多学科知识对于应对生物组织特性的复杂性和 MRI、CT、超声等成像方式的精细技术至关重要。这些独特特征使 MIA 有别于通用图像分析,凸显了其需要专门设计的模型与方法,并应充分利用可用的独特物理信息,从而催生了物理信息医学影像分析(PIMIA)这一研究方向。本文综述了 MIA 中前沿的物理信息策略,重点关注:如何将物理知识融入算法、把哪些物理过程建模为先验,以及采用了哪些专用网络架构或增强手段来嵌入物理洞察。
近期 PIMIA 文献呈指数级增长趋势,仅过去 7 年便涌现出大量相关研究,见图 2a。配套的饼图展示了各 PIMIA 任务的研究占比,清晰显示逆成像(尤其是图像重建)与预测建模等任务在物理信息融合方面受到最多关注。
本文贡献总结如下:
提出统一分类法,系统探究:① 哪些物理知识/过程被建模;② 它们如何表示;③ 嵌入 MIA 模型的具体策略。
深入覆盖广泛图像分析任务:成像、生成、预测、逆成像(超分辨率与重建)、配准,以及图像分析(分割与分类)。
对每项任务,以易查表格形式详尽列出:核心物理引导操作、解剖学感兴趣区域、对应成像模态、训练数据集、所用深度网络架构,以及所利用的主要物理过程/方程/原理。
基于对任务的回顾,我们总结了我们在挑战、开放研究问题和未来研究方向上的观点。
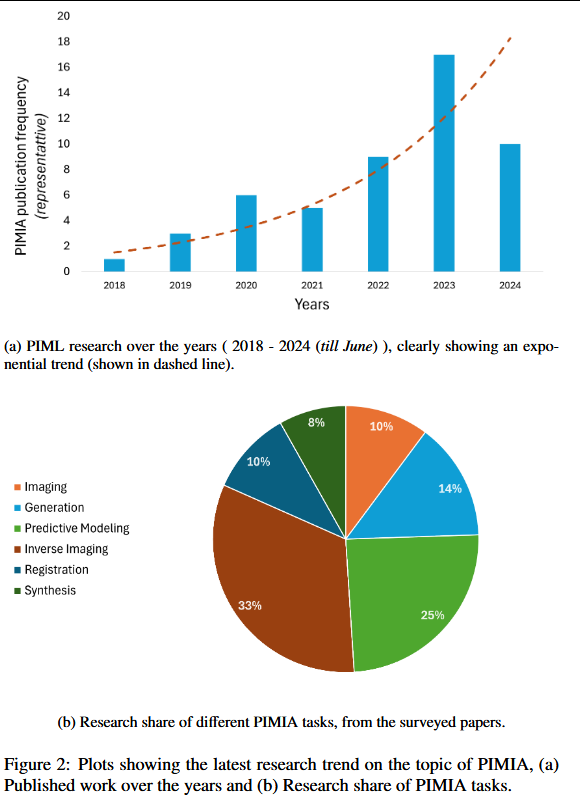
我们重点指出 PIMIA 领域的关键开放挑战:如何选取合适的物理先验、建立标准化的评测平台。尽管物理知识已通过(特别是)数据增强等方式被融入训练流程,但分类、分割与超分辨率等任务尚未充分挖掘物理先验的潜力。这些任务按“对物理信息的利用效率”由低到中等排序,仍有较大提升空间。
Focus of the current survey:
物理信息机器学习(PIML)领域正迅速扩张,其热度在多个学科的调查报告中可见一斑,涵盖信息物理系统(Rai 和 Sahu, 2020)、水文学(Zhang 等, 2019)、流体力学(Cai 等, 2022)、气候建模(Kashinath 等, 2021)以及强化学习(Banerjee 等, 2023b)等方向。
在医学影像分析(MIA)中,亦有多篇综述探讨物理与知识融合的不同侧面,但往往聚焦于某一细分场景。这些综述虽提供了宝贵洞见,却仍缺少一份能够全面捕捉该领域宏观趋势与最新进展的综合性概述。
- Banerjee 等 (2023a)对计算机视觉任务中的物理融入做了全面调研,然而其视野覆盖整个计算机视觉领域,对 MIA 的专门讨论较为有限。
- Liu 等 (2021) 则聚焦“解剖结构辅助深度学习”在医学图像分割中的应用,系统梳理了解剖信息的类别与表示方法。
- Hammernik 等 (2023) 深入回顾了物理驱动的深度学习在 MRI 重建中的研究,涵盖线性与非线性前向模型,以及经典算法与深度学习方法。
- Xia 等 (2023)针对低剂量 CT(LDCT)的物理与模型驱动方法进行了详细考察,强调将成像物理原理嵌入深度网络架构。
- 另一项工作Maier 等 (2022)则探讨了医学成像中的“已知算子学习”范式。
综上,尽管已有诸多专门综述,但尚缺乏一份能够系统整合并全景展示 PIML 在医学影像分析中发展现状与趋势的综合性文献,而本文正是为填补这一空白而作。
与现有综述不同,本文首次对“将物理信息融入医学影像分析(PIMIA)”的方法进行全面回顾。以往综述要么聚焦于非物理的通用技术,要么仅针对单一成像模态;而本研究系统梳理了多样化的物理驱动方法,并横跨多种成像模态与解剖感兴趣区域。此外,尽管“知识引导”在医学影像领域早已有之,但把物理信息机器学习(PIML)真正应用于 MIA 的研究近 3–4 年才显著兴起,尚属新兴热点。
**文献纳入与排除标准**
为确保综述的相关性与质量,我们制定以下关键准则:
1. 主题契合:优先收录明确引入物理模型/方程的工作,排除仅使用通用领域知识或非物理先验的研究。
2. 出版形式:以同行评审的期刊/会议论文为主,同时酌情纳入部分预印本,以捕捉最新进展。
3. 范围限定:文献必须直接面向医学影像分析任务,确保综述内容专注且实用。
为确保透明性,我们在下文对这些标准进行了详细说明,包括检索的具体数据库与期刊、所用关键词以及文献的时间范围。通过执行上述标准,我们旨在对现有研究进行全面且无偏的整合,系统梳理该领域的关键主题与最新进展。
本综述的数据系统采集自以下权威期刊:
- Medical Image Analysis
- Physics in Medicine and Biology
- IEEE Transactions on Medical Imaging
- Medical Physics
- Nature Reviews Physics
- Nature Machine Intelligence
检索覆盖的主要数据库包括:
- PubMed
- IEEE Xplore
- ScienceDirect
- SpringerLink
- Wiley Online Library
- ACM Digital Library
- arXiv
- Scopus
- JSTOR
- Google Scholar
使用的关键词为:
- physics informed medical image analysis
- physics informed imaging
- physics informed generation
- physics incorporated predictive modeling
- physics informed inverse imaging
- physics informed image registration
鉴于近 7 年来物理信息方法在医学影像与分析领域的迅猛发展,我们仅遴选该时段内的文献,以确保综述反映最新趋势与突破,提供与时俱进的前沿概览。
本文结构如下:第2节介绍物理信息机器学习(PIML),阐述其优势与分类,为后续在医学影像分析(MIA)中的应用提供背景。 第3节论述PIMIA方法,并提出物理先验的分类体系。第4节综述PIMIA领域内已发表的最新常规研究工作。第5节进行定量实验,揭示在MIA中引入物理信息(PI)的实际收益与最佳适用场景。第6节讨论将物理先验融入PIMIA任务所面临的现有挑战,并指出研究空白与未来研究方向。 第7节总结全文,提炼关键要点。
2. Physics-informed Machine Learning (PIML)
本节简要介绍物理信息机器学习(PIML)范式,并讨论一种分类体系,用于按照“物理原理、数据或方程”在机器学习流程中的插入位置对偏差进行归类。PIML 致力于将数学物理模型与观测数据融合到学习过程中,从而在观测不完整、存在不确定性和高维的场景下,引导模型得到物理一致的解(Kashinath 等,2021;Hao 等,2022;Cuomo 等,2022)。引入体现过程基本规律的物理信息,可为机器学习模型带来显著优势(Kashinath 等,2021;Meng 等,2022a):
有助于确保机器学习模型在物理上和科学上都是连贯的。
提高模型训练中的数据效率,使得可以用更少的数据进行训练。
加快模型训练过程,更快地收敛到最优解。
提升训练模型的泛化能力,使其在未见过的场景中能够更好地预测。
增强模型的透明度和可解释性,使其可解释且更值得信任。
在这种将物理信息嵌入机器学习范式的方法中,一个典型的例子是物理信息神经网络(PINNs)家族。PINNs是一类深度学习算法,能够无缝地整合数据和抽象的数学算子,包括偏微分方程(PDEs)。这种整合使得机器学习方法更具可解释性,即使面对不完美数据(如缺失值或噪声值)时也能保持鲁棒性,并提供准确且物理上一致的预测。通过同时利用数据和物理模型,PINNs特别适用于解决正问题和逆问题、发现隐藏物理规律,以及应对各种科学与工程应用中的高维问题。
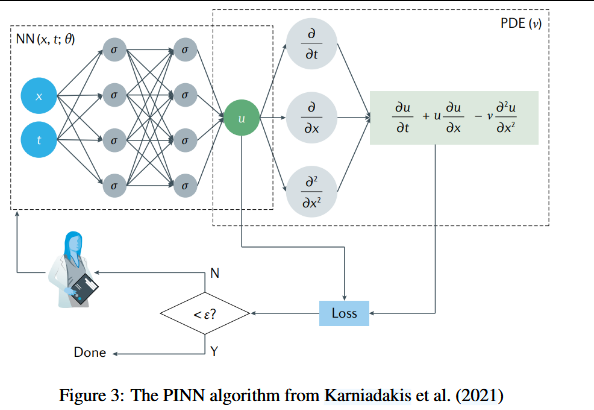
我们在图3中展示了一个典型的PINN示例,该示例旨在利用神经网络来近似求解偏微分方程(PDE)的解。该PINN由神经网络函数 NN(X, t; θ) 定义,其中 X = (x, y, z) 和 t 分别为空间坐标和时间坐标,θ 表示可训练参数。该网络使用非线性激活函数 σ。测量数据表示为 {(xi, ti, ui)},其中 xi 和 ti 分别为空间和时间的坐标,ui 是在这些坐标上观测到的 U 值。此外,还定义了残差点 {(x j, t j)},在这些点上将评估PDE的残差。在数学上,总损失函数 L 被表述为:
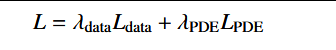
这里,和 λ_PDE 是权重因子,用于平衡数据损失和 PDE 损失的贡献。训练神经网络的目标是找到最优参数 θ*,使得总损失函数 L 最小化:
![]()
这一优化过程确保了神经网络解 NN(X, t; θ) 既能拟合观测数据,又能遵守由偏微分方程(PDE)描述的底层物理规律。该算法将迭代运行,直到损失值低于某个设定的阈值 ε(ε 为正数),或由人工操作者终止。
接下来,我们讨论 Wang 等人(2022年)在流体力学领域的工作,展示如何利用 PINN 从稀疏数据中提升速度场的测量精度。在该研究中,通过最小化基于稀疏数据和 Navier-Stokes 偏微分方程的损失函数,PINN(见图4)重建了高密度的速度场并预测了压力,显著提高了流动可视化和分析的分辨率和准确性。该 PINN 由神经网络 NN(X, t; θ) 定义,网络同时近似速度场 U = (u, v, w) 和压力 p。用于训练该 PINN 的损失函数 L 如下:
![]()
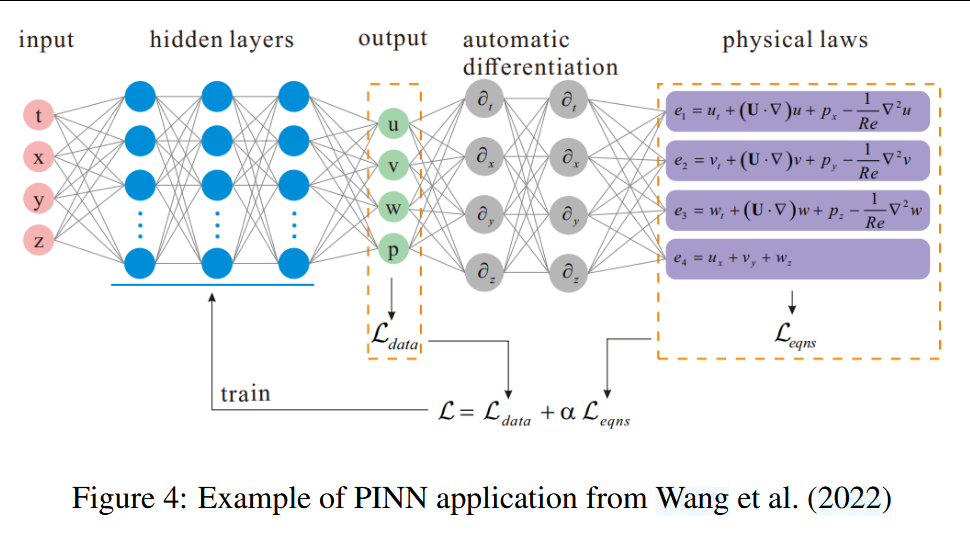
其中,L_data 衡量与实验数据的偏差,L_eqns 强制执行由 Navier-Stokes 方程描述的物理规律。参数 α 用于调整数据拟合与 PDE 约束之间的相对重要性。该方法旨在提高重建速度场和压力分布的分辨率和准确性。
先前文献(如 Karniadakis 等,2021)已总结出三种将物理知识/先验引入机器学习模型的策略:**观测偏置(observational bias)**、**学习偏置(learning bias)** 和 **归纳偏置(inductive bias)**,这些将在下文讨论。
2.1. Biases as taxonomy in PIML
观测偏置:观测数据是机器学习的基石,是跨尺度、跨模态刻画底层物理规律的核心输入(Karniadakis 等,2021)。这些数据负责把基本物理定律和原理“教”给 ML 模型(Lu 等,2021;Kashefi 等,2021;Li 等,2020;Yang 与 Perdikaris,2019)。数据来源包括:传感器网络(环境、地震)、遥感(卫星影像、气象数据)、实验测量(实验室、风洞)以及高保真数值模拟(如 CFD、FEA)。这些多元数据跨越不同时空尺度,捕捉复杂现象,为物理系统提供丰富洞察。训练阶段引入此类数据,使深度神经网络能够有效建模底层物理过程。多保真度的观测确保物理行为被全面覆盖,从而提升模型在插值精度以及对物理对称性和守恒律的遵循能力。
学习偏置:该方法通过“软惩罚”约束把先验知识或物理信息强加给模型。此类做法在损失函数里附加基于物理机制的额外项,例如动量守恒、质量守恒等。典型例子是物理信息神经网络(PINN):借助自动微分,将偏微分方程(PDE)嵌入网络的损失函数,使模型同时学习测量数据与方程约束(Karniadakis 等,2021)。其他代表性工作包括:基于统计约束的生成对抗网络(Wu 等,2020)、物理信息自编码器(Erichson 等,2019),以及通过软约束在损失中编码不变性的 InvNet(Shah 等,2019)。
归纳偏置:通过定制神经网络结构引入“硬”约束,从而把先验知识直接写进模型。典型例子包括:
- Hamiltonian NN(Greydanus 等,2019)从哈密顿力学汲取灵感,在网络中嵌入严格守恒律,使模型自动满足能量等守恒条件。
- Lagrangian NN(Cranmer 等,2020)用神经网络参数化任意拉格朗日量;与大多数 HNN 不同,LNN 无需显式计算正则动量,适用范围更广。
- Tensor Basis NN(Ling 等,2016)将张量代数融入网络运算与结构,比传统网络更高效地挖掘高维张量数据的内在结构。
- Meng 等(2022b)提出贝叶斯框架:先用 PI-GAN 从数据与物理中习得函数先验,再用 Hamiltonian Monte Carlo(HMC)在 PI-GAN 的隐空间中求取后验分布,实现物理一致的推断。
MIA(医学图像分析)正逐步融合机器学习(ML)与深度学习(DL)技术,以全面提升其能力。物理信息机器学习(PIML)已被证实能显著增强 MIA 的效果(Banerjee 等,2023a;Hammernik 等,2023;Xia 等,2023)。后续章节将详细阐述 PIML 在 MIA 领域中的具体应用方法。
3. Physics-Informed Medical Image Analysis (PIMIA)
物理信息医学图像分析(Physics-informed medical image analysis,PIMIA)是一种将物理学原理融入医学图像分析的计算方法,专门面向医学领域。PIMIA 借用并扩展了“物理信息机器学习”(PIML)中的概念与方法;PIML 是一个更宽泛的术语,涵盖不同领域、数据类型和模态的物理信息。在医学成像中,图像的形成以及组织与各种成像模态(X 射线、MRI、CT、超声等)之间的相互作用,均由明确的物理过程支配。物理信息分析正是利用这些先验知识,来提升图像重建、分割、配准等各项任务的性能与可靠性。
该方法通常首先建立数学模型,用以刻画图像形成、数据采集、设备特性以及组织属性等背后的物理现象;随后将这些模型嵌入图像分析算法,从而提升医学图像处理任务的精度、鲁棒性与可解释性。此外,相较于纯数据驱动的方法,物理信息方法通过对解空间施加物理约束,能够给出更可靠且更具临床价值的结果。
3.1. Physics incorporation in general ML and MIA
主要介绍在 通用机器学习和医学图像分析中如何融入物理知识。
无论是在通用机器学习,还是在医学图像分析(MIA)中,引入物理知识都能提升模型性能与可解释性。然而,两者在“如何融入物理”方面存在显著差异。通用机器学习通常采用“物理启发”的建模思路,或将物理约束作为正则项加入优化目标。例如,在流体动力学仿真中,机器学习模型会把守恒定律与流体力学方程嵌入损失函数,以改善预测结果。
相比之下,在医学图像分析(MIA)中,物理知识的融入更直接地对应于成像过程本身及组织特性。例如,在 MRI 重建中,会将描述信号形成的物理模型——如傅里叶变换、T1/T2 弛豫过程——嵌入重建算法,以提升图像质量并减少伪影。此外,PIMIA 还常常对成像系统进行标定,以校正 X 射线或超声成像中的衰减、散射等物理效应,从而获得更准确的定量测量与诊断评估。因此,尽管两个领域都能从物理引入中受益,但侧重点和具体应用方式因各自的需求与挑战而异。
3.2. Intuitive introduction to physics priors in MIA:
物理信息对医学图像分析(MIA)至关重要,可显著提升精度与可靠性。例如,借助 MRI 采集物理进行数据增强,或利用信号演化物理校正运动伪影,都能让 PIMIA 任务表现更佳。此外,PINN 被用于建模流体与血流动力学,进一步增强预测能力。通过将物理知识融入 MRI 重建、CT 伪影去除等任务,医学分析变得更加稳健、精准。
我们接下来看一个直观的例子。Weiss 等人(2019)(见图 5)把物理约束融进 MRI 采样轨迹设计,并通过求解“旅行商问题”(TSP)实现加速 MRI。该方法确保轨迹严格服从硬件限制,包括梯度线圈最大强度与爬升率。借助 TSP,PILOT-TSP 对轨迹点重新排序,在尊重物理约束的前提下最短化路径,并进一步优化轨迹形状。整个过程提升了 MRI 数据采集的效率与图像质量,尤其在单次激发场景下效果显著。通过 PILOT-TSP,训练流程将物理原理与计算技术有机结合,推动了加速成像中轨迹设计的进步。
在其他示例中:
- Poirot 等人(2019)利用双能 CT(DECT)衰减物理,在脑部成像中实现材料分解。他们设计了一种基于 ResNet 的定制架构,充分挖掘 DECT 不同能量下衰减系数的差异。
- Eichhorn 等人(2024)则借助梯度回波 MRI 的信号演化物理,对脑部 GRE 序列的运动伪影进行校正;其定制的 MLP 架构显式考虑了患者运动对信号的影响。
- Kissas 等人(2020)使用 4D 血流 MRI 数据,预测心血管系统中的动脉血流。网络以守恒定律为引导,学习血流与压力波的传播规律。与传统方法不同,该方案无需繁琐的预处理或边界条件设定,可直接利用含噪的临床数据,绕过传统仿真器即可获得物理一致的预测结果。
3.3. Physics prior categories with examples (Taxonomy I):
根据物理学先验或信息在医学图像分析(MIA)任务中的来源与形式,我们将其划分为三大类别,并辅以示例详述如下。
3.3.1. Medical Imaging Physics:(医学影像物理学)
本类别汇集的研究均把源于成像系统与成像过程的物理信息及参数直接融入医学分析任务。
- Poirot 等(2019)利用 DECT 衰减物理实现脑部材料分解;
- Eichhorn 等(2024)借助信号演化物理消除 GRE-MRI 脑扫描的运动伪影;
- Zhu 等(2023)通过束硬化校正模型抑制 CT 金属伪影;
- Borges 等(2024)与 Leung 等(2020)分别将 MRI 采集物理和 PET 建模物理用于数据增广;
- Jiang 等(2021)在 GCNN 框架下联合心脏电活动与表面电位数据重建心脏图像序列。
3.3.2. Process dynamics and Equations:(过程动力学与方程)
本节介绍主要借助 Physics-Informed Neural Networks(PINNs)及其同类方法,将物理机制嵌入医学分析的研究,旨在增强预测建模、成像与重建效果。Halder 等(2023)、Zapf 等(2022)与 Herrero Martin 等(2022)分别将流体动力学、4D 偏微分方程及电生理模型引入 PINN。Kissas 等(2020)和 Sarabian 等(2022)利用守恒定律与血流动力学方程;van Herten 等(2022)与 Buoso 等(2021)则结合常微分方程与心脏力学约束。在成像与重建方面,Kamali 等(2023)和 Zheng 等(2024)采用弹性理论与亥姆霍兹方程。此外,Zhang 等(2023)和 Zhang 等(2022)通过计算流体力学及物理定律预测血流与肌肉骨骼力。这些工作充分展示了物理约束在提升医学分析精度与鲁棒性方面的有效性。
3.3.3. Others:
目前已出现两种将底层物理嵌入机器学习框架的核心思路:表征与特征法和物理信息与测量法。
- 前者通过模式、表征或特征来编码物理信息,例如把数据置信度图引入分割任务,或将周期性运动模式用于配准任务。
- 后者则直接利用物理原理和测量值,这些测量值通常来自生物学研究和领域专家。
表征与特征法:这类研究以“模式、表征或特征”为媒介,把底层物理信息嵌入学习过程。
- Peiris 等(2023)将数据置信度图引入 MRI/CT 分割,用于胰腺与心脏成像。
- Chen 等(2023a)借助图像数据特征,在胸片和皮肤镜图像中分割皮肤与肺部病灶。
- Fechter 与 Baltas(2020)利用周期性运动模式,实现肺和心脏 CT/MRI 的可变形配准。
- Liu 等(2020)通过 k 空间伪影模式增强肝脏 MRI 的去噪效果。
物理信息与测量法:
- Altaheri 等(2022)在脑机接口中直接使用 EEG 信号,其本质即利用了脑电活动的物理规律与信号处理原理。
- Frid-Adar 等(2018)指出医学图像生成背后的隐含物理——尤其是 CT 成像受 X 射线衰减定律支配。
- Shi 等(2020)借助放射科医师的域知识解决医学影像数据稀缺问题,合成高质量图像,重点针对甲状腺结节。
3.4. Medical Image Analysis (MIA) tasks (Taxonomy II)
此处简要介绍我们所采用的 MIA 任务框架,用以梳理已综述的文献。
“成像”涵盖利用各类传感器与技术获取视觉数据的完整流程,是 PIMIA 任务的基石。该流程包括视觉信息的采集、处理与分析,旨在提取有意义的模式与特征,为后续计算分析提供输入。
图像生成是指利用先进算法(通常基于深度学习框架,如生成对抗网络 GANs)创建合成图像的任务。该过程旨在从潜空间表征中生成逼真图像,广泛应用于数据增广、仿真与创意设计等场景。
反演成像旨在通过求解病态问题,从间接或不完整的测量中重建原始图像。它借助数学与计算方法,由退化或含噪数据推断高质量图像,并常利用正则化技术确保重建的稳定与准确。
图像超分辨率是一种通过从低分辨率输入中重建高频细节来提升图像空间分辨率的技术。该过程利用先进算法对图像进行上采样,预测并补全细微纹理与结构,从而显著提高图像的视觉质量与细节保真度。
图像重建是指利用计算方法将原始传感器数据转化为可视图像的过程。该任务借助数学模型把传感器测量数据转换成可解释的图像,通常通过迭代算法并依据物理原理不断修正,从而提升图像质量。
图像配准是将多幅图像对齐到统一坐标系的过程。该过程通过几何变换使图像与参考帧匹配,确保空间位置一致。它对于整合来自不同视角、传感器或时间点的数据至关重要,能够实现连贯的分析与比较。
图像分割与分类:分割是将图像划分为若干互不重叠的区域;分类为这些区域赋予语义标签。二者借助机器学习与模式识别技术,自动识别并归类图像中的目标与结构,为后续精细分析奠定基础。
预测建模将物理定律与约束嵌入机器学习框架,以提升预测的准确性与可靠性。该方法把数据驱动手段与领域物理知识相结合,确保模型输出既符合已知物理原理,又表现出真实可行的行为。
3.5. Typical pipeline
我们逐段介绍 MIA 的典型流水线,以及各环节与三种“物理偏置”的对应关系:
1. 数据采集 (观测偏置)
图像、视频或传感器信号在此输入算法。物理融入属于观测偏置:直接采集或仿真得到的物理量(如 k-space、能谱、运动信号)作为原始数据进入系统。
2. 预处理
对原始数据进行标准化、去噪或增强。此时采用物理引导的超分辨率、图像合成等手段,通过正则项把物理约束写进目标函数,对应学习偏置。
3. 模型设计 (归纳偏置)
选择或定制主干网络并提取特征。物理知识被“硬编码”进网络结构(如哈密顿网络、守恒层、旋转等变卷积),属于归纳偏置;也可设计专用分支抽取瞬态、涡流等物理特征。
4. 模型训练 (学习偏置)
通过最小化损失函数更新参数。把守恒方程、亥姆霍兹方程等残差项加入总损失,强制网络解满足物理定律,这是典型的学习偏置。
5. MIA 头(任务头)
最终模块负责预测、分割或重建。其损失函数直接决定任务效果:
- 通用选择:交叉熵、L1/L2 像素损失;
- 定制选择:加入物理残差、边界条件、临床度量等,可进一步提升模型在特定数据与目标上的性能。
4. PIMIA Tasks: Detailed Survey
4.1. Imaging
近期,面向成像应用的物理引导机器学习模型取得了显著进展。
- Poirot 等(2019)基于 ResNet 架构,并引入查找式虚拟非对比(L-VNC)图像数据,提升了 CT 处理效果。
- Eichhorn 等(2024)提出一种面向定量 MRI 的运动校正方法,借助物理信息学习实现。该法通过定量参数估计,在重建时自动排除被运动污染的 k 空间线,特别针对梯度回波 MRI 的 T2* 定量难题,既提高图像质量,又缩短采集时间,更具临床实用性。
- Zhu 等(2023)提出物理信息正弦图补全(PISC)方法,用于 CT 金属伪影抑制(MAR)。该方法利用物理模型,结合束硬化校正与归一化线性插值对正弦图进行修正,在有效消除金属伪影的同时,保留金属植入物周边的结构细节。
Kamali 等(2023)利用 PINN 同时重建线性弹性材料的材料参数(杨氏模量、泊松比)与应力分布。该方法以线弹性控制方程、应力-应变关系及动量平衡方程为核心,将实验测量与有限元建模无缝融合,为临床弹性成像精确估计力学性能。
Halder 等(2023)则结合实时动态 MRI 与 PINN,分析食管食团运输过程。研究融入详细流体动力学及压力-体积关系,加深了对食管生理的理解,为吞咽障碍的诊断提供新工具,并推动胃肠病学计算建模的发展。
4.2. Image Generation
在面向“生成”的医学图像分析任务中:
- Kawahara 等(2023)采用生成对抗网络(GAN),在生成图像时显式考虑 MR 物理属性。
- Pan 等(2023)以数据增广为目标,利用定制模型及 ACDC MRI、BTCV 等数据集进行医学影像生成。
- 针对医学 MRI 分析,Borges 等(2024)借助 UNet 启发的增广策略,结合 ABIDE 等自定义数据集实现数据扩充。
Leung 等(2020)探讨了将物理机制引入 PET 成像:通过模拟放射性衰变、光子与物质相互作用、探测器响应、系统模糊及噪声特性,生成逼近真实的数据,用于训练和验证改进 UNet 等神经网络,从而提升医学影像应用效果。
Shi 等(2020)则提出一种基于 Auxiliary Classifier GAN(ACGAN)的医学图像合成方法。该研究以语义标签为条件进行图像生成,增加数据多样性与真实感,为医学分析提供更多样本。借助领域知识生成的合成数据,对医学影像机器学习模型的训练至关重要。
Frid-Adar 等(2018)提出利用生成对抗网络(GAN)合成医学图像,为基于 CNN 的肝脏病灶分类提供数据增广。GAN 生成的图像提高了分类精度,缓解了医学影像中标注样本稀缺的难题,并有望为放射科医生的诊断提供更好支持。
Tirindelli 等(2021)则引入一种面向超声(US)的数据增广新策略:基于超声成像原理,设计了包含形变、混响及信噪比调整等物理启发式变换。这些方法可生成逼真的超声图像变化,提升数据对深度学习医学应用的适用性。
Zhang 等(2024)提出物理引导的扩散模型(Phy-Diff),用于提升扩散 MRI(dMRI)合成质量。Phy-Diff 将 dMRI 物理机制融入噪声演化过程,并引入基于查询的映射以及 XTRACT 图谱提供的解剖先验,通过可解释的噪声管理和解剖一致性合成来改善 dMRI 图像。
Momeni 等(2021)则生成合成脑微出血(sCMB),以增强 MRI 扫描中脑微出血(CMB)检测网络的训练。该方法利用高斯建模模拟多样化的 CMB 特征,在无需大量真实标注的情况下提升分类器性能。受 MRI 物理特性引导,sCMB 能有效模拟真实病灶,实现鲁棒训练。
4.3. Inverse Imaging
物理信息反演成像技术通过将物理原理融入深度学习模型,提升医学影像质量。例如,4D Flow MRI 超分辨率借助物理信息神经网络(PINNs)引入流体动力学约束;SR-UNet 等专用架构则提高 X 射线图像保真度。PINNs 还把 Navier-Stokes 方程嵌入 MRI 重建,优化 k 空间轨迹,并利用物理变量生成高分辨率、高精度的图像。这些跨越多种成像模态的方法保证了结果的物理合理性,显著改善了图像质量与生物医学诊断能力。
4.3.1. Image Superresolution
在医学图像超分辨率任务中:
- Fathi 等(2020)针对 4D Flow MRI,利用物理信息深度神经网络引入流体动力学与质量守恒原理,同时提升空间分辨率并降低噪声。
- Fok 等(2023)提出专用 SR-UNet(SRUNK)架构,通过调制传递函数(MTF)核增强 X 射线图像的超分辨率重建,获得更高保真度。
- Shone 等(2023)同样聚焦 4D Flow MRI,采用嵌入 Navier-Stokes 方程的物理信息神经网络(PINN),在超分辨率过程中严格保持物理一致性,显著提高图像质量。
- Chen 等(2023b)在 MRI 成像中引入 SRGAN,通过融入物理变量确保生成的高分辨率图像既符合物理规律又具备高质量,从而有效缩短扫描时间。
4.3.2. Image Reconstruction
在医学图像重建任务中:
- Burns 与 Liu(2023)聚焦显微成像领域的超分辨率(SR)重建,提升生物图像分辨率,对精确分析与诊断至关重要。
- Zimmermann 等(2024)提出 PINQI——一种面向定量 MRI 的物理信息神经网络,将信号与采集模型同可学习正则化结合,采用展开优化实现高精度参数映射,在高度欠采样的 T1-mapping 任务上性能显著优于传统方法,并在合成与真实数据中得到验证。
- Liu 等(2020)提出 RARE 框架,利用在欠采样数据上训练的 artifact-removal CNN 先验,增强 MRI 重建效果。该方法无需全采样真值,即可实现高质量 4D MRI 重建,在仿真与实验数据上均优于传统去噪方案。
- Peng 等(2022)提出用神经常微分方程(Neural ODE)优化 k 空间采样轨迹以加速 MRI。该方法将采样视为动态系统,嵌入 MRI 物理约束,通过 Neural ODE 近似轨迹演化,保证采样方案可在实际扫描中实现。
- Oh 等(2020)提出无监督深度学习方案,利用物理信息 CycleGAN 从 MRI 相位图像重建定量磁化率图(QSM)。通过显式引入已知偶极子核,简化网络结构,实现更快、更稳定的训练,提升 QSM 重建精度,克服传统监督方法的局限。
- Jiang 等(2021)将物理原理融入神经网络框架进行图像重建:借助电磁理论建立心脏电兴奋与体表电位的关系,无需标注数据即可提高重建精度,为心脏活动监测提供新视角。
- Zheng 等(2024)提出 PIN-wEPT 方法,利用磁共振电特性断层成像(MREPT)重建人脑电特性(EPs)。该方法将亥姆霍兹方程嵌入 PINN,无需特殊硬件配置,仅依据水含量图即可获得准确的 EPs 分布。
- Ragoza 与 Batmanghelich(2023)在磁共振弹性成像(MRE)中利用 PINN 重建组织弹性:通过在网络内编码物理原理,无需数值微分即可求解组织刚度反问题,实现更鲁棒、精确的弹性图。
- Shen 等(2022)提出 GIIR 方法,用于超稀疏 3D 断层重建:结合成像系统几何先验,设计自定义 3D-Net 与几何反投影算子,在 2D 与 3D 图像域之间建立桥梁,利用物理引导信息提升重建质量,为生物成像带来新进展。
- Maul 等(2024)提出血管造影中时间分辨对比剂浓度重建方法:利用血流与对比剂传输的物理原理,以计算流体力学仿真数据训练神经网络,快速获得无伪影重建,改善血管图像质量。
- Desai 等(2021)提出 VORTEX 方法,用于 MRI 加速重建:基于 MRI 物理知识进行数据增广,模拟真实噪声与运动,提高模型对分布漂移的鲁棒性;结合图像域与物理驱动增广,提升数据效率与临床场景下的重建质量。
- Weiss 等(2019)推出 PILOT(Physics-Informed Learned Optimized Trajectories),联合优化 k 空间轨迹与图像质量,嵌入梯度线圈幅度与爬升率等物理约束,利用深度学习设计高效采集方案,显著提高 MRI 扫描速度与图像质量。
- Saba 等(2022)提出 MaxwellNet,将 PINN 用于光学衍射层析(ODT):该方法直接在重建过程中融入物理原理,重建生物样本三维折射率分布,提升精度与效率,并确保结果满足物理约束。
4.5. Image Segmentation & Classification
- Borges 等(2019)将多参数 MRI 仿真与物理信息 CNN 相结合,在不同采集条件下均表现出稳健的分割性能。该方法通过模拟 MRI 序列并把序列参数嵌入 CNN 架构,提升了分割的一致性。
- Chen 等(2023a)提出 CoTrFuse,一种融合 CNN 与 Transformer 的新分割网络。借助注意力机制同时捕获局部和全局信息,显著提高分割精度。
- Peiris 等(2023)提出 CoBioNet,一种基于对抗学习的双视角半监督医学图像分割框架。充分利用标注与未标注数据,性能优于现有方法,具备更强的鲁棒性与可扩展性,并推动了多视角学习的发展。
- Altaheri 等(2022)致力于提升脑机接口在运动想象分类中的能力,利用定制模型对脑电(EEG)输入信号进行分析。
Borges 等人(2019)提出的物理信息分割网络(见粉色框,为创新点)将物理参数融入 3D U-Net 进行 MRI 分割。网络设有一条专门的“物理分支”,由两个全连接层构成,用于接收 N 维物理参数向量。这些参数及其负指数化结果随后被拼接进网络,旨在减弱成像参数差异对分割结果的影响,使不同采集条件下的分割保持一致。
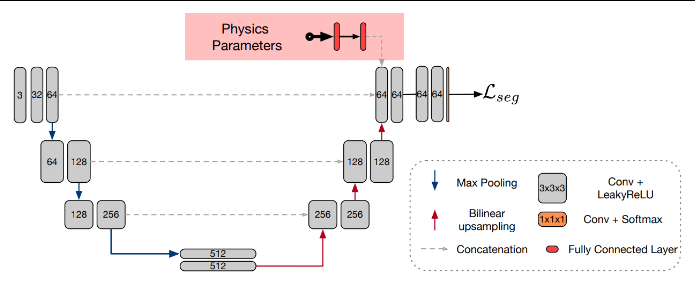
4.6. Physics Informed Predictive Modeling
在面向“预测”的医学图像分析任务中:
- Kissas 等(2020)针对心血管流体力学预测动脉血压,对理解心脏功能及相关疾病具有重要意义。
- Zapf 等(2022)致力于估计扩散系数,该参数对阐释多种医学与生物过程至关重要。
- Sarabian 等(2022)聚焦脑血流动力学预测,加深我们对脑灌注在健康与疾病中作用的理解。
- Herrero Martin 等(2022)则从事电生理参数估计,这是心脏健康与诊断的关键环节。
Kaandorp 等(2021)提出 IVIM-NET,一种用于扩散加权磁共振成像(DWI)的深度学习模型。IVIM-NET 整合基于物理的约束,通过定制损失函数强制遵守物理原理,从 DWI 数据中准确估计反映组织微结构与灌注的 IVIM 参数,实现无创组织表征。
Ruiz Herrera 等(2022)提出 FiberNet——一种物理信息神经网络(PINN)方法,用于解决心脏电解剖标测图中纤维识别的反问题。该方法通过将神经网络同时拟合到标测图并预测传导速度张量,扩展了先前研究,在数值实验中验证可行,并展示了临床应用的潜力。
Zhang 等(2022)提出一种面向肌肉骨骼建模的物理信息深度学习框架,将已有的物理领域知识融入数据驱动模型。该方法采用表面肌电(sEMG)信号预测肌肉力与关节运动学,并在卷积神经网络(CNN)架构中以物理定律作为软约束。
Zhang 等(2023)提出一种新颖框架,将计算流体力学(CFD)与物理信息神经网络(PINN)相结合,用于预测心血管系统的血流动力学。通过 CFD 仿真与深度学习融合,该框架可实现血流动力学参数的实时、无创获取,为心血管疾病的诊断与治疗提供支持。
de Vries 等(2023)提出 SPPINN——一种用于 CT 灌注分析的新方法。SPPINN 将物理原理嵌入神经网络,在高噪声环境下仍能准确估计脑灌注参数。利用时空物理信息学习,为医学影像中的稳健灌注分析提供了有前景的新途径。
5. Quantitative study and insights
5.1. Calculation of performance improvement score
我们引入了一项“总结性提升指标”,用于量化物理信息在 PIMIA 任务中带来的改进。针对每一类任务,我们挑选出一对性能相对更优的研究,并用自定的“提升分数”(improvement score,见图 14)进行并排比较。由于不同论文采用的指标、损失函数、基线、感兴趣区、数据集和成像模态各异,即便在同一任务内也难以直接比较,更遑论跨任务统一评估。因此,我们设计了如下自定义分数:
P:引入物理信息后取得的性能
B:未引入物理信息时的性能
C:该案例在某一 PIMIA 任务类别中的提升分数
计算公式为
C_case = |P − B| / B × 100%
该绝对百分比差值即可在不同指标(RMSE、F1、SSIM、NMSE、SI、MSI 等)之间给出可比的“物理增益”量化值。
随后,定义“提升分数” S 为同一 PIMIA 任务类别内两篇代表性工作的平均值:
S_Mean = (C1 + C2) / 2
其中 C1、C2 分别为两项研究按前述公式算出的提升百分比。该均值用于量化“引入物理信息”带来的相对增益,实现跨研究标准化比较。
其波动程度用简化标准差表示:
S_Std.Dev. = |C1 − C₂| / 2
(仅两项样本,故直接取半差。)
数据处理规则
若原文给出“均值 ± 标准差”,仅取均值参与计算。
若在多个数据集或 ROI 均有结果,优先选用“基线”与“物理增强”对比最显著的数值,以保证最大可观测增益被纳入分析。
性能数据来源于以下研究:
- 成像:Poirot et al. (2019);Eichhorn et al. (2024)
- 生成:Leung et al. (2020);Borges et al. (2024)
- 预测建模:van Herten et al. (2022);Kaandorp et al. (2021)
- 超分辨率:Shone et al. (2023);Fok et al. (2023)
- 重建:Peng et al. (2022);Desai et al. (2021)
- 配准:He et al. (2023);Min et al. (2023)
- 分割/图像分析:Borges et al. (2019);Chen et al. (2023a)
我们选取了以下指标来衡量性能提升:RMSE、MAE、DICE、NRMSE、SSIM 和 TRE。
5.2. Performance improvement due to physics incorporation
PIMIA 各任务的对比分析显示出不同类别间的性能提升存在显著差异(见图 14)。成像任务平均提升13.8%;生成任务提升10.495%;预测建模提升幅度较大,达29.675%;反演成像中的超分辨率子任务提升最为显著,平均高达44.27%。相比之下,重建与分析任务提升较温和,分别仅 5.55%和2.85%。
5.3. Discussion: PIML Bias based taxonomy and PIMIA
观测偏置方法通常借助多模态数据与深度神经网络,从训练数据中捕捉底层物理规律,这些数据来源于直接观测、表征或物理量本身。此类偏置体现在引入物理信息、测量值以及“特征型”物理先验的研究中(见第 3.3.3 节)。例如:
- Peiris 等(2023)利用数据置信度图进行 MRI/CT 胰腺与心脏分割;
- Chen 等(2023a)借助图像数据特征在胸片和皮肤镜图像中分割皮肤与肺部病灶;
- Fechter 与 Baltas(2020)使用周期性运动模式实现肺和心脏 CT/MRI 的可变形配准;
- Liu 等(2020)通过 k 空间伪影模式增强肝脏 MRI 去噪。
此外,直接应用物理原理的案例还包括:
- Altaheri 等(2022)在脑机接口中使用反映脑电活动的 EEG 信号;
- Frid-Adar 等(2018)讨论 CT 成像中 X 射线衰减的物理机制;
- Shi 等(2020)利用放射科医生的领域知识合成高质量图像,缓解医学影像数据稀缺问题。
在受调研的工作中,绝大多数通过“学习偏置”方式引入物理先验,即**以软惩罚约束的形式**把物理知识强加给模型。具体做法通常是直接采用 PINN 或其变体:
- Halder 等(2023)、Zapf 等(2022)、Herrero Martin 等(2022)分别用 PINN 嵌入流体动力学、4D 偏微分方程和电生理模型;
- Kissas 等(2020)、Sarabian 等(2022)将守恒定律与血流动力学方程写入损失;
- van Herten 等(2022)、Buoso 等(2021)则把常微分方程和心脏力学约束加入训练。
至于“归纳偏置”——即**通过定制网络结构实现硬编码物理约束**——在当前文献中**尚未发现**有工作直接采用该路径。
5.4. When to choose PIMIA over typical data-driven MIA?
将物理信息嵌入数据驱动模型,在特定场景下正变得不可或缺。传统纯数据方法虽擅于从多样样本中学习,却需海量数据、训练耗时,且缺乏理论保证,易违背物理规律。置于医学图像分析(MIA)背景下,物理信息深度网络在“数据稀缺、精度要求高、计算效率关键”时优势突出:
1. 小数据稳健学习
把MRI信号生成、血流守恒等已知原理写进损失或网络结构,可用极少标注完成有效训练,显著缓解样本不足。
2. 训练加速与收敛保证
物理约束提供明确梯度方向,帮助网络跳过局部极小,缩短收敛时间,降低调参成本。
3. 解的物理一致性与可信度
强制结果满足守恒、边界条件等先验,确保输出符合真实世界物理,减少伪影和异常预测,提升临床可靠性。
4. 数据增广与自监督
利用物理仿真生成带标签合成数据,或把物理残差作为自监督信号,无需额外人工标注即可扩大训练集。
综上,物理信息模型在数据有限、精度与效率并重的医学成像任务中,既能“省数据”,又能“保物理”,为可靠、高效的临床解决方案提供理论+数据的双重保障。后续章节将对此展开更详尽讨论。
1) 扩充训练与/或验证数据集
在医学影像中,由于隐私限制、高昂费用以及依赖专家标注,大规模标注数据集往往难以获得。例如,针对罕见病的标注 MRI 就因病例稀少而几乎无法收集。物理信息模型可把 MRI 信号生成等已知物理原理嵌入学习过程,即便数据量有限也能稳定表现,从而最大化利用稀缺数据,无需大量标注图像即可训练出鲁棒且精准的模型。
2)用物理先验正则化深度网络
小数据集也能高效训练
物理信息(PI)模型把物理定律作为约束写进训练目标,相当于给参数搜索提前划定“合法区域”,从而缩小解空间、加快收敛,即便数据量少也能保持高准确率与可靠性。例如在 MRI 重建中,PI 模型将 MRI 信号生成物理嵌入损失,使网络可用更少的扫描样本完成高效学习,训练更快、结果更准,显著降低对大规模数据集的依赖。
避免陷入局部极小
物理信息(PI)模型把基于物理的快速算法与数据驱动的自适应学习能力相结合,可加速训练并缓解局部极小问题。例如,在实时 MRI 引导手术中,PI 模型能迅速给出组织结构的初始近似,降低计算量,确保临床决策及时、精准。
生成更符合物理规律的解
MRI、CT 等医学成像受复杂物理原理支配,PI 模型因此尤为适用。以心脏 MRI 为例,血流动力学与组织特性是准确诊断的关键。将血流及组织对比的物理规律嵌入模型后,可更好解析心脏图像的细微结构,从而更准确识别瓣膜缺陷或心肌梗死等病变,而纯数据驱动方法往往难以捕捉这些细节。
3) 可使用更简单的模型与架构
小模型,高速度
嵌入物理先验后,网络无需靠大量参数“硬记”规律,因而架构更简洁、参数量更少,计算复杂度降低。所得轻量模型推理更快,特别适合实时应用或算力受限环境,在不减精度的情况下提升效率。
收敛更快
物理定律与约束为优化过程提供明确方向,显著压缩可行解空间。模型迅速贴近物理合理解,训练步数减少,整体训练时间缩短,节省计算资源。
剔除不可能解
将物理原理直接写进模型,可事先过滤掉违背现实规律的“非法”解,确保输出始终与真实世界一致。对精度与可靠性要求极高的医学图像分析而言,这种“物理合法性”大幅提升了结果的可信度。
6. Current challenges and future research direction
6.1. Challenges in Incorporating Physics into MIA
机器学习与物理先验在医学图像分析(MIA)中的融合,已在计算 MRI、高精度断层重建以及更优预测模型等方面带来显著突破。然而,尽管进展迅速,该领域仍存在诸多开放问题和具体挑战,亟待解决以进一步打磨并提升物理信息方法。下文概述了在 MIA 中应用物理信息方法所面临的核心议题与难点:
1) 过度正则化性能评估
需检测深度模型是否因物理约束过多而在训练阶段过拟合。临床上,这类网络可能输出“看起来真实却暗藏误导”的图像,使伪影更难被识别。物理先验可能在无意中生成或掩盖具有临床意义的特征,因此必须建立稳健指标,量化约束对模型行为的影响,确保在数据质量参差不齐的现实环境中仍维持诊断准确性。
2) 模型泛化能力
MIA 模型必须跨设备、跨院区、跨人群通用。图像质量、时间分辨率、视野(FOV)、患者体位/运动等采集差异会显著降低模型效能。利用包含解剖知识、成像技术与采集元数据的物理先验是缓解差异的关键。核心抉择在于:是构建“通用型”模型以求广泛适用,还是打造“专精型”模型针对特定场景提升诊断精度。
3) 前瞻与回顾式加速中的物理先验
回顾式加速通过离线降采样实现快速成像,但易忽略采集链路上的信号效应;前瞻式加速在扫描实时执行,信息更全面,却难以从回顾方案平稳过渡。引入物理先验可让计算模型顾及成像系统的细微特性,挑战在于如何高效地把 MRI 扫描仪等复杂物理嵌入计算成像流程。
4) 使用已处理数据的风险
用 DICOM 等已处理图像而非原始数据(如 k-space)做实验,可能因信息被“美化”而得出过于乐观的结果。处理环节对数据的扭曲未必反映真实扫描情形。设计实验时需避免这类偏差,确保基于已处理数据的结论仍与实际患者扫描一致;进一步加入物理信息会使对齐更复杂,必须精心设计与反复验证,以维持 MIA 的准确性与可靠性。
6.2 未来方向
未来研究将聚焦于:①让深度学习模型在多样化成像环境中保持鲁棒;②在重建任务中精化不确定性量化;③把 Transformer 与物理方法融合,以优化特征识别并解决断层成像的数据稀缺难题。
1. 跨成像环境增强模型鲁棒性
通过物理先验强化深度网络,对抗设备与协议差异,实现可靠的医学图像分析。例如,将磁场强度、成像序列等先验嵌入模型,使其在不同 MRI 机型间依然表现稳定。
2. 重建中的不确定性量化精
结合物理洞见,开发能在各种采样模式下准确评估重建不确定性的算法。例如,利用 X 射线衰减与重建物理,针对层厚各异的 CT 扫描,量化图像置信区间。
3. 深度网络与物理方法深度融合
把 Transformer 的注意力机制与物理方程结合,自动聚焦关键特征,进一步提升性能;同时探索“物理 + 自监督”学习策略,解决断层成像中配对训练数据不足的难题。
7. Conclusions
本文提出了一种融合数据驱动方法与物理科学原理的最先进 PIMIA(Physics-Informed Medical Image Analysis)范式。我们构建了一套统一分类法,依据物理信息的来源、表示方式及其在 MIA 模型中的嵌入策略,对现有 PIMIA 方法进行系统归类。综述涵盖成像、生成、预测、逆成像(超分辨率与重建)、配准以及图像分析(分割与分类)等广泛任务,并在表 3 中以表格形式汇总所讨论文献,清晰展示物理原理如何嵌入各类 MIA 任务。本文旨在阐明 PIMIA 方法的全景应用,剖析当前挑战,并激励该领域的进一步研究。
