AbMole小课堂丨Trastuzumab:靶向 HER2 的多维作用机制及科研应用详解
HER2(表皮生长因子受体2)在多种恶性肿瘤中存在过度表达,与肿瘤细胞的增殖、迁移及存活密切相关。Trastuzumab(AbMole,M6218)作为一种靶向HER2的人源化单抗试剂,通过特异性结合HER2受体,阻断其下游信号传导,是抑制HER2阳性肿瘤的重要生物活性分子。AbMole为全球科研客户提供高纯度、高生物活性的抑制剂、细胞因子、人源单抗、天然产物、荧光染料、多肽、靶点蛋白、化合物库、抗生素等科研试剂,全球大量文献专利引用。
一、Trastuzumab(曲妥珠单抗)的作用机制
1.HER2受体结构与功能
HER2属于EGFR家族成员,其胞外结构域包含四个亚区(Ⅰ-Ⅳ),其中Ⅱ区是配体结合的关键位点。HER2本身无直接配体,但可通过与其他EGFR家族成员(如HER3)形成异二聚体,激活PI3K/AKT、RAS/MAPK等下游信号通路,促进肿瘤细胞增殖与存活。在HER2阳性肿瘤中,HER2基因扩增导致受体过度表达,胞外结构域暴露量增加,为Trastuzumab(AbMole,M6218)的结合提供了基础[1]。
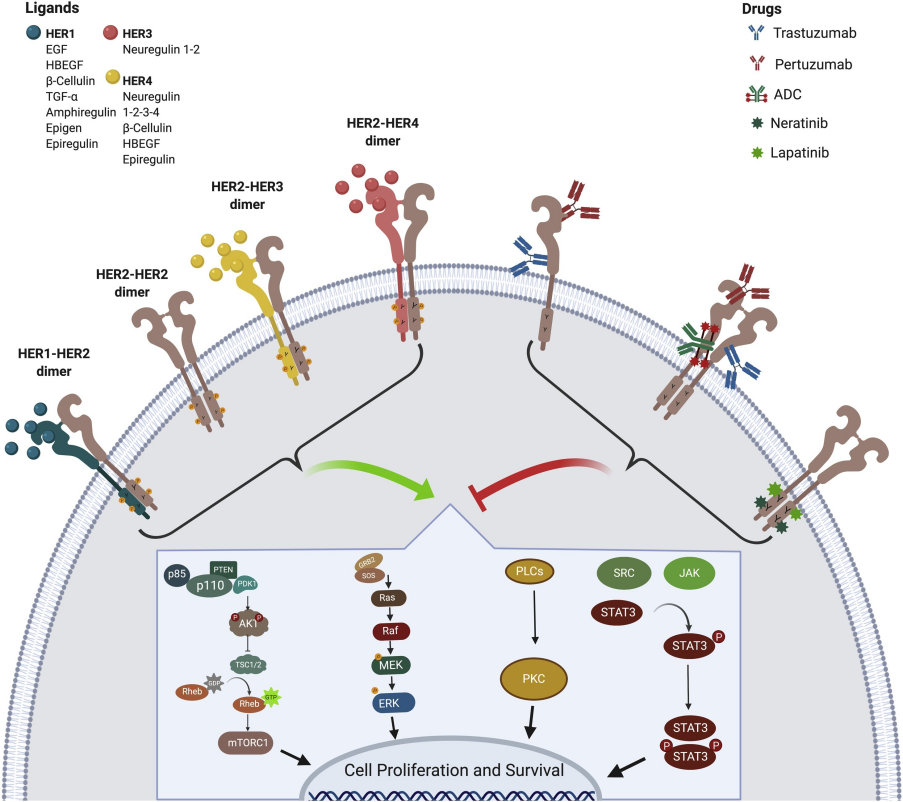
图 1. HER2 downstream pathway activation, anti-HER2 targeted agents[1]
2.Trastuzumab(曲妥珠单抗)通过抑制HER2阻断肿瘤生长
Trastuzumab(AbMole,M6218)是一种人源化IgG1单克隆抗体,其抗原结合片段(Fab)特异性识别HER2胞外结构域Ⅳ区。通过高亲和力结合,Trastuzumab可阻断HER2与其他EGFR家族成员(如 EGFR/HER1、HER3、HER4)的异二聚化,抑制受体磷酸化及细胞增殖相关的信号通路激活(如 PI3K-AKT 和 MAPK)。本文所述活性物均为科研试剂,仅供有资质的科研机构或医药企业进行科学研究用途。
3.Trastuzumab(曲妥珠单抗)通过诱导ADCC效应抑制肿瘤细胞
此外,作为一种IgG1 型单克隆抗体,Trastuzumab(AbMole,M6218)的恒定区(Fc 段)可与免疫细胞(如自然杀伤细胞 NK、巨噬细胞、中性粒细胞)表面的Fcγ受体(如 FcγRⅢa)结合,触发ADCC 效应(抗体依赖的细胞介导的细胞毒作用)。即上述免疫细胞在识别结合了Trastuzumab的 HER2阳性肿瘤细胞后,释放穿孔素、颗粒酶等细胞毒性物质,裂解肿瘤细胞。
4.Trastuzumab(曲妥珠单抗)抑制血管生成
肿瘤的生长和转移依赖新生血管提供营养。Trastuzumab(AbMole,M6218) 可通过以下途径抑制血管生成:阻断 HER2 信号通路后,减少血管内皮生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)等促血管生成因子的分泌;直接抑制肿瘤血管内皮细胞的增殖和迁移,破坏肿瘤血管网络的形成。
5.Trastuzumab(曲妥珠单抗)促进 HER2 受体内化与降解
Trastuzumab(AbMole,M6218) 与 HER2 结合后,可诱导受体-抗体复合物通过胞吞作用被细胞内化,随后进入溶酶体降解,减少细胞表面 HER2 的表达量。这可有效抑制肿瘤细胞对HER2信号的接收,进一步抑制其增殖,同时减少HER2在细胞表面的积累,降低肿瘤的恶性程度。
二、Trastuzumab(曲妥珠单抗)的科研应用
1.Trastuzumab(曲妥珠单抗)用于HER2阳性的乳腺癌和胃癌研究
HER2阳性的乳腺癌和胃癌是存在HER2 基因过表达的两种恶性肿瘤。该亚型肿瘤细胞因 HER2 信号通路持续激活,具有增殖快、侵袭性强、容易早期转移等特点,且对传统抑制剂的敏感性较低,预后相对较差。Trastuzumab(曲妥珠单抗,AbMole,M6218) 作为一种HER2抑制剂,在HER2阳性的乳腺癌和胃癌肿瘤中具有重要的研究价值。例如Trastuzumab可以抑制 SKBR3、BT474、MDA-MB-453 等HER2阳性乳腺癌细胞系,以及抑制NCI-N87、SNU-216、MKN-45等HER2 阳性胃癌细胞系[1]。经过Trastuzumab 处理的上述细胞系表现为下调细胞周期蛋白(如Cyclin B1)、上调周期抑制因子(如 p27),使细胞阻滞于G1期;同时,Trastuzumab通过抑制 Akt 的磷酸化减少抗凋亡蛋白 Bcl-2 表达、激活caspase家族(如caspase-3、-9),诱导细胞凋亡。在 MDA-MB-453(乳腺癌细胞系)和 SNU-216(胃癌细胞系)中,均观察到Trastuzumab处理后凋亡相关蛋白的激活。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。
2.Trastuzumab(曲妥珠单抗)与其它抑制剂和人源化单抗的联用
Trastuzumab(AbMole,M6218) 作为靶向 HER2 的蛋白类抑制剂,其与其他工具分子的协同应用在HER2阳性乳腺癌和胃癌的机制研究中展现出多维度的探索价值。在与紫杉醇(Paclitaxel)等化合物的协同研究中,二者通过微管稳定性破坏与 HER2信号阻断的交叉作用,显著增强了对SK-BR-3、NCI-N87等细胞系的增殖抑制效应,其中多西他赛 (Docetaxel,RP-56976)与 Trastuzumab 的组合可使HER2阳性乳腺癌细胞的 G1 期阻滞比例提升至单独使用 Trastuzumab 的1.8倍[2],而在胃癌模型中,顺铂(Cisplatin,CDDP)与Trastuzumab的联用通过 DNA 交联与抗体依赖的细胞毒性效应的叠加,使肿瘤细胞凋亡率较单一组分提高40%以上[3]。双靶向策略的研究则聚焦于HER2信号通路的全方位阻断,Pertuzumab 与Trastuzumab的协同通过分别结合HER2 胞外域Ⅱ区与Ⅳ区,有效抑制了 HER2 同源及异源二聚体的形成,在 BT-474 细胞系中可使 PI3K/Akt 通路的激活水平降低 60%[4];而抗体偶联物如T-DXd(Trastuzumab deruxtecan,DS-8201)利用Trastuzumab和Deruxtecan 的联合,实现拓扑异构酶抑制剂的靶向递送,在 HER2 低表达模型(如MKN-45亚株)中仍能维持显著的杀伤效应[5]。在免疫调控机制的探索中,Trastuzumab与PD-1/PD-L1阻断剂如Pembrolizumab(MK-3475)的协同研究证实,前者通过抗体依赖的细胞毒性效应释放肿瘤相关抗原,后者则解除T细胞的免疫抑制状态,二者共同作用可使SK-BR-3荷瘤模型中的肿瘤浸润淋巴细胞(TILS)数量增加2.3倍,且IFN-γ等细胞因子的分泌水平显著上调[6]。针对耐药性机制的研究体系中,PI3K抑制剂与Trastuzumab的联用在PIK3CA突变型细胞系(如HCC1954)中展现出强效抑制效果,恢复肿瘤细胞对抑制剂的敏感性[7]。此外,双特异性抗体如 Zanidatamab 与Trastuzumab的组合则利用对HER2表位的双重识别,提高了在异质性肿瘤模型中的穿透效率与信号阻断强度[8]。这些研究通过细胞系模型、动物模型及分子互作分析,系统揭示了Trastuzumab与不同工具分子协同作用的核心机制,为解析HER2阳性肿瘤的信号网络复杂性、构建高效的靶向干预体系提供了丰富的实验依据,同时为探索耐药性逆转策略及新型联合模型的设计奠定了理论基础。本文所述活性物均为科研试剂,仅供有资质的科研机构或医药企业进行科学研究用途。
三、范例详解
1.Br J Cancer. 2024 Jun;130(12):1990-2002.
伦敦国王学院、伯明翰大学的科研人员在上述论文中研究了HER2低表达乳腺癌细胞及类器官(PDOs)对靶向抑制的响应机制,重点探索了泛HER抑制剂Neratinib(HKI-272)单独使用或与 Trastuzumab 联合的作用效果。结果证实Neratinib(不可逆泛HER抑制剂)单独使用可有效抑制HER2低表达细胞及类器官的活力,其机制包括抑制HER受体激活、诱导HER2与HSP90解离并促进其降解;Neratinib与Trastuzumab联合时表现出叠加效应,能更强地抑制细胞增殖及下游信号通路(如 PI3K/Akt、MAPK/Erk)。在 HER2低表达的类器官中,Neratinib 单药(300 nM可降低50%细胞活力,联合Trastuzumab后效果略增强;且 Trastuzumab 可通过 NK 细胞介导的抗体依赖的细胞毒性(ADCC)效应增强杀伤作用。由AbMole提供的Trastuzumab(AbMole,M6218)作为重要研究工具被多次使用[9]。
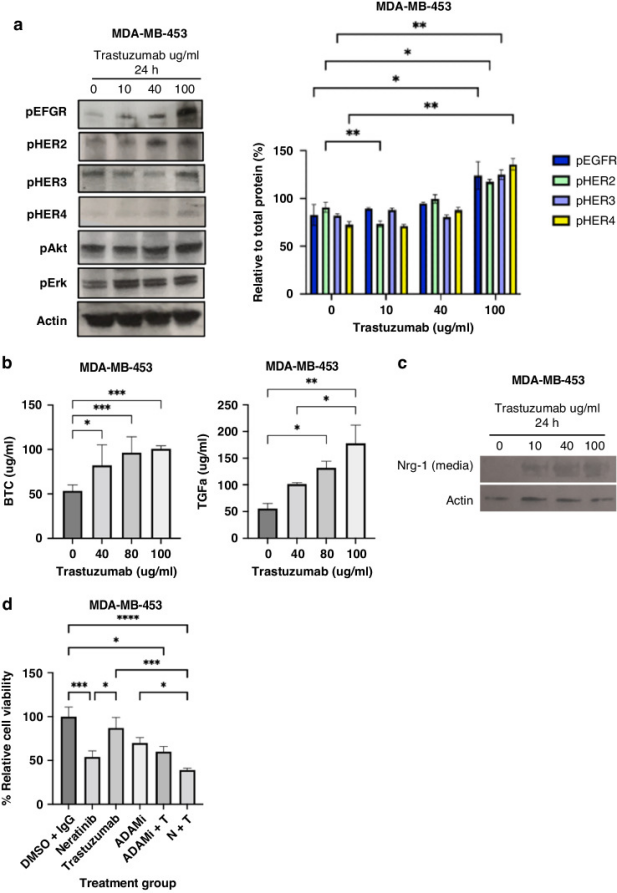
图 2. Trastuzumab induces activation of HER receptors as well as ADAMs and ligands[9]
AbMole是ChemBridge中国区官方指定合作伙伴。

参考文献及鸣谢
[1] C. Marchiò, L. Annaratone, A. Marques, et al., Evolving concepts in HER2 evaluation in breast cancer: Heterogeneity, HER2-low carcinomas and beyond, Semin Cancer Biol 72 (2021) 123-135.
[2] Joshua D Mezrich, John H Fechner, Xiaoji Zhang, et al., An Interaction between Kynurenine and the Aryl Hydrocarbon Receptor Can Generate Regulatory T Cells, The Journal of Immunology 185(6) (2010) 3190-3198.
[3] Y. J. Bang, E. Van Cutsem, A. Feyereislova, et al., Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial, Lancet (London, England) 376(9742) (2010) 687-97.
[4] Adrienne G. Waks, Olga Martínez-Sáez, Paolo Tarantino, et al., Dual HER2 inhibition: mechanisms of synergy, patient selection, and resistance, Nature Reviews Clinical Oncology 21(11) (2024) 818-832.
[5] S. Modi, W. Jacot, T. Yamashita, et al., Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer, The New England journal of medicine 387(1) (2022) 9-20.
[6] H. C. Chung, Y. J. Bang, S. Fuchs C, et al., First-line pembrolizumab/placebo plus trastuzumab and chemotherapy in HER2-positive advanced gastric cancer: KEYNOTE-811, Future oncology (London, England) 17(5) (2021) 491-501.
[7] Aryana R. Rasti, Amy Guimaraes-Young, Farrah Datko, et al., <i>PIK3CA</i> Mutations Drive Therapeutic Resistance in Human Epidermal Growth Factor Receptor 2–Positive Breast Cancer, (6) (2022) e2100370.
[8] J. J. Harding, J. Fan, D. Y. Oh, et al., Zanidatamab for HER2-amplified, unresectable, locally advanced or metastatic biliary tract cancer (HERIZON-BTC-01): a multicentre, single-arm, phase 2b study, The Lancet. Oncology 24(7) (2023) 772-782.
[9] M. Arshad, A. Azad, P. Y. K. Chan, et al., Neratinib could be effective as monotherapy or in combination with trastuzumab in HER2-low breast cancer cells and organoid models, British journal of cancer 130(12) (2024) 1990-2002.
