TR-FRET(时间分辨荧光能量共振转移)在药物研发中的热门应用简介
TR-FRET(时间分辨荧光能量共振转移)是一种用于研究分子间相互作用的生物物理技术,结合了荧光共振能量转移(FRET)和时间分辨荧光(TRF)两大技术。
荧光共振能量转移是一种物理现象:当荧光分子(供体)吸收光能后,若另一分子(受体)空间距离足够接近(通常为1-10纳米),供体可通过非辐射方式将激发能量转移至受体。该能量转移效率与供体-受体间距离的六次方成反比,因此可用于研究分子间的邻近性与相互作用。
时间分辨荧光(TRF)是一种荧光寿命测量技术,通过检测光源停止激发后的荧光衰减,区分短寿命的背景荧光与长寿命的信号荧光。该技术能在特定时间窗口内测量荧光,从而降低背景干扰、提高信噪比。利用该技术可高效筛选靶向蛋白/蛋白受体抑制剂、PROTAC靶向蛋白降解分子以及KRAS/cRAF小分子阻断剂。
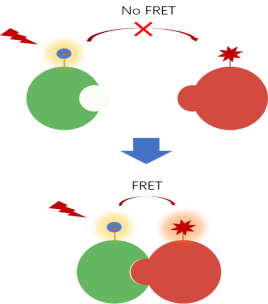
荧光共振能量转移示意图
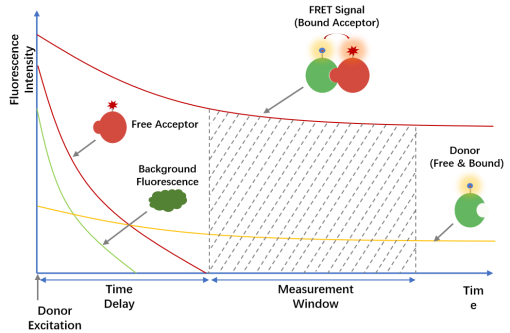
时间分辨荧光示意图
目录
编辑
1. 细胞因子/细胞因子受体阻断剂筛选
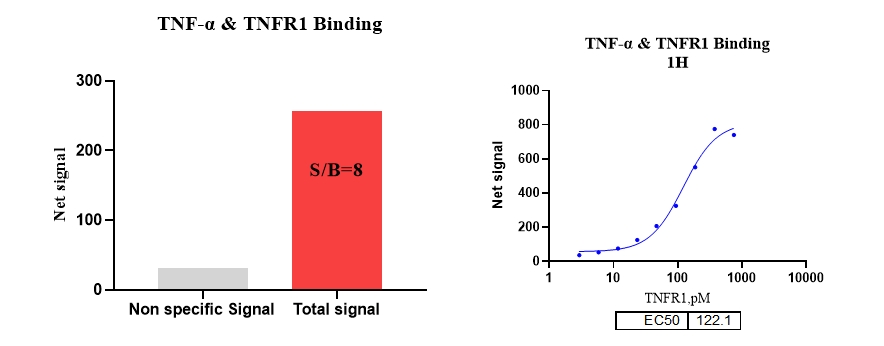
1、TNF-a & TNFR1 结合
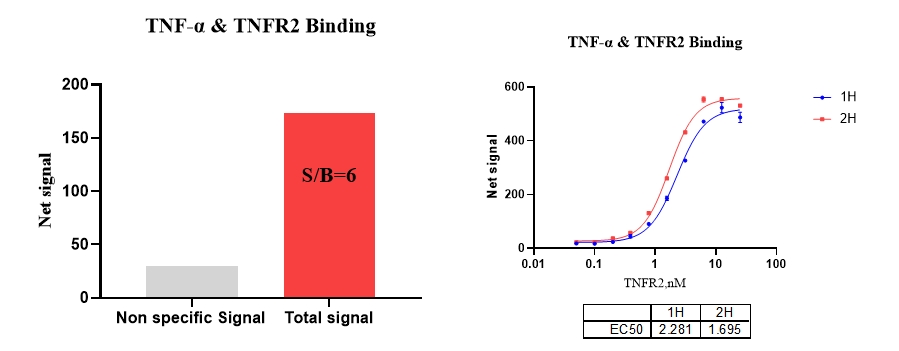
2、TNF-a & TNFR2 结合
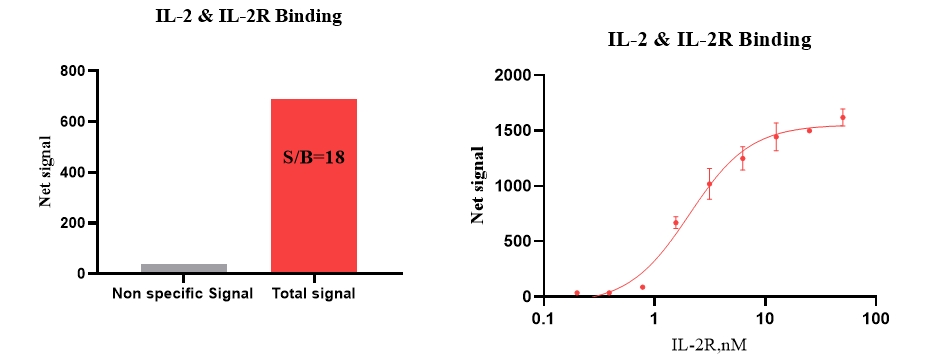
3、IL-2 & IL-2R 结合
4、IL-3 & IL-3R 结合
5、IL-4 & IL-4R 结合
6、IL-17 & IL-17RA 结合
2. PROTAC靶向蛋白降解分子筛选系统
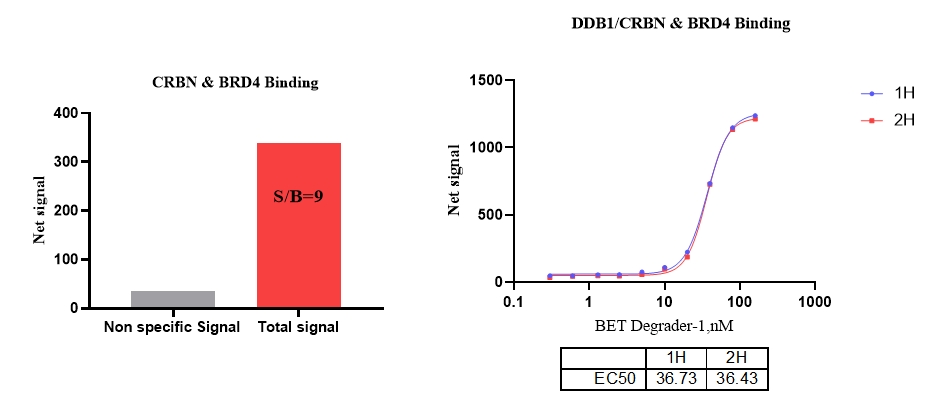
1、DDB1/CRBN & BDR4,Protac : BET Degrader-1
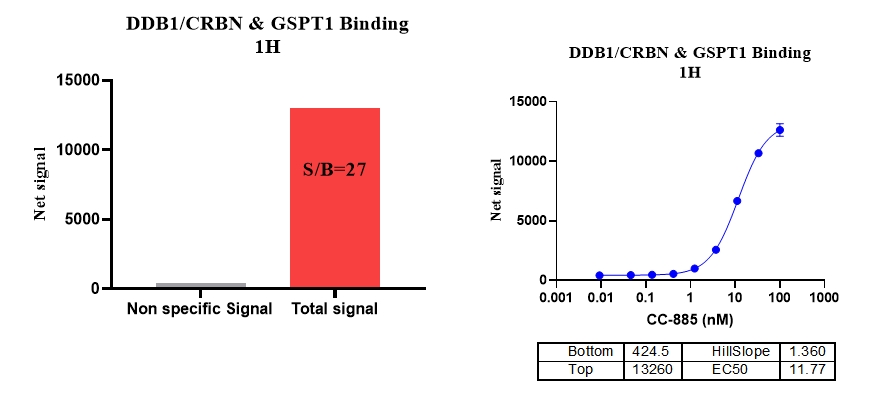
2、DDB1/CRBN & GSPT1,Protac : CC-885
3. KRAS/cRAF小分子阻断剂筛选系统
1、KRAS WT & cRAF 结合抑制剂 : MRTX1133
2、KRAS G12C & cRAF 结合抑制剂 : MRTX1133
3、KRAS G12D & cRAF 结合抑制剂 : MRTX1133
4、KRAS G12V & cRAF 结合抑制剂 : MRTX1133
5、KRAS G12R & cRAF 结合抑制剂 : MRTX1133
6、KRAS G13C & cRAF 结合抑制剂 : MRTX1133
7、KRAS G13D & cRAF 结合抑制剂 : MRTX1133
8、KRAS Q61H & cRAF结合抑制剂:MRTX1133
参考文献:
1. 细胞因子/细胞因子受体阻断剂筛选
细胞因子抑制剂在医学界的应用和研究中展现出广泛的潜力,尤其在治疗自身免疫性疾病、肿瘤、感染及多种其他疾病领域。
在自身免疫性疾病治疗方面,IL-2和IFN是重要的细胞因子抑制剂。IL-2已被广泛研究用于多种自身免疫性疾病的治疗,尽管研发过程充满挑战,它仍是这类疾病的核心治疗药物之一。IFN-α主要用于治疗病毒感染和肿瘤,对慢性活动性肝炎和毛细胞白血病的疗效显著。近年来,靶向B淋巴细胞刺激因子(BLyS)的抑制剂(如贝利尤单抗)已在国内获批,另有超过20种药物正积极开发用于类风湿关节炎等其他自身免疫性疾病。IL-1受体拮抗剂在炎症性和自身免疫性疾病的治疗中也表现出良好效果。
在肿瘤治疗方向上,抑制肿瘤细胞中特定的细胞因子信号通路是当前策略之一。例如,抗TNF单克隆抗体在肿瘤治疗中的应用,以及基于PD-L1/IL-15免疫细胞因子的新型肿瘤疗法正在研发中。小分子蛋白-蛋白相互作用抑制剂通过阻断细胞内信号传导用于癌症治疗,尤其是通过抑制STAT3等关键信号分子来阻断肿瘤通路。此外,CDK4/6抑制剂在乳腺癌治疗中显示出潜力,已有三种药物获批用于激素受体阳性乳腺癌患者。
在感染性和炎症性疾病治疗中,抑制促炎细胞因子的产生及其受体结合是治疗脓毒性休克和自身免疫性疾病的有效手段。
尽管细胞因子抑制剂在多种疾病治疗中疗效显著,但仍面临副作用较大和耐药性等挑战。随着新技术和新药的发展,未来可能提供更多选择并实现更优疗效。
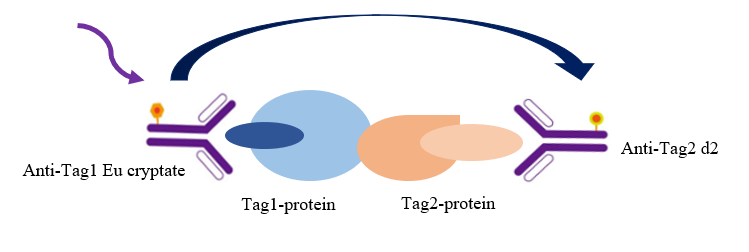
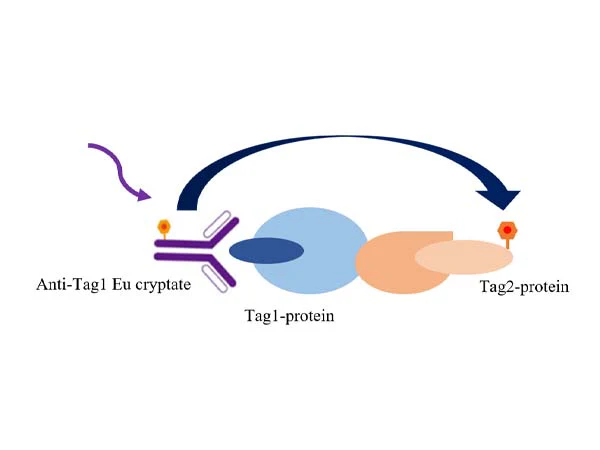
图1 TR-FRET技术筛选细胞因子阻断剂原理
如图所示,实验采用铕标记的抗Tag1抗体(TR-FRET供体)和受体标记的抗Tag2抗体(TR-FRET受体)来检测Tag1与Tag2的相互作用。当Tag1与Tag2结合时,会使供体抗体与受体抗体相互靠近,此时激发供体抗体会触发荧光共振能量转移(FRET)至受体抗体,导致受体抗体在665 nm波长处产生特异性信号。该特异性信号强度与Tag1-Tag2相互作用程度成正比。这种均相实验操作简便,无需洗涤步骤。
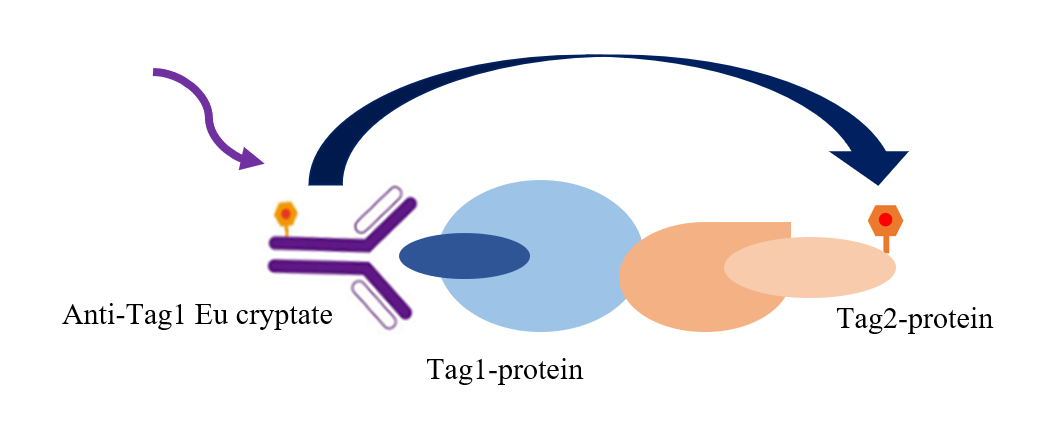
图2 TR-FRET技术筛选细胞因子阻断剂
如图所示,本实验采用铕标记的抗Tag1抗体(TR-FRET供体)和受体标记的Tag2蛋白(TR-FRET受体)来检测Tag1与Tag2的相互作用。当Tag1与Tag2结合时,可使供体抗体与受体蛋白相互靠近。此时激发供体抗体将触发荧光共振能量转移(FRET)至受体蛋白,导致受体在665 nm波长处产生特异性荧光信号。该信号强度与Tag1-Tag2相互作用程度呈正比。这种均相实验操作简便,无需洗涤步骤。
相关试剂
| Catalog number | Product name | specification |
| abs560014 | Human TNF-α/TNFR1 Binding Kit | 500T |
| abs560015 | Human TNF-α/TNFR2 Binding Kit | 500T |
| abs560017 | Human IL2/IL2R Binding Kit | 500T |
| abs560018 | Human IL3/IL3R Binding Kit | 500T |
| abs560019 | Human IL4/IL4R Binding Kit | 500T |
| abs560020 | Human IL6/IL6R Binding Kit | 500T |
| abs560021 | Human IL17A/IL17RA Binding Kit | 500T |
数据说明:以下数据不可替代实际实验获得的数据,仅作为示例展示。具体结果可能因所用TR-FRET兼容仪器的不同而有所差异。
1、TNF-a & TNFR1 结合
2、TNF-a & TNFR2 结合
3、IL-2 & IL-2R 结合
4、IL-3 & IL-3R 结合
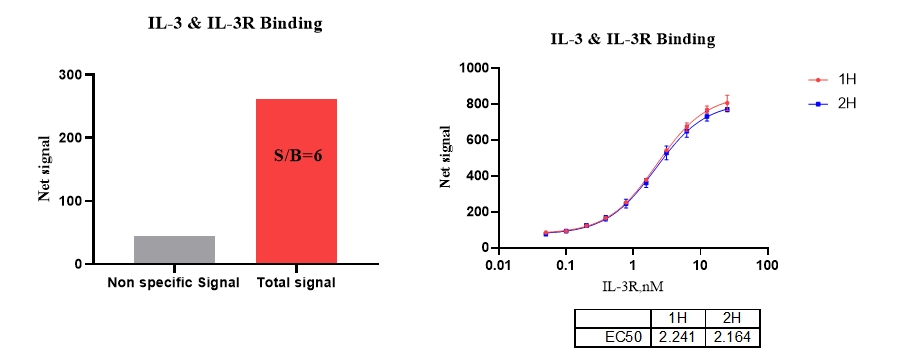
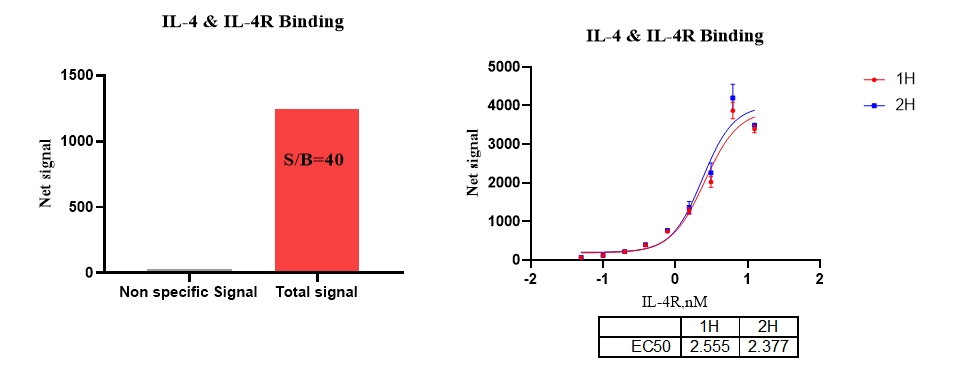
5、IL-4 & IL-4R 结合
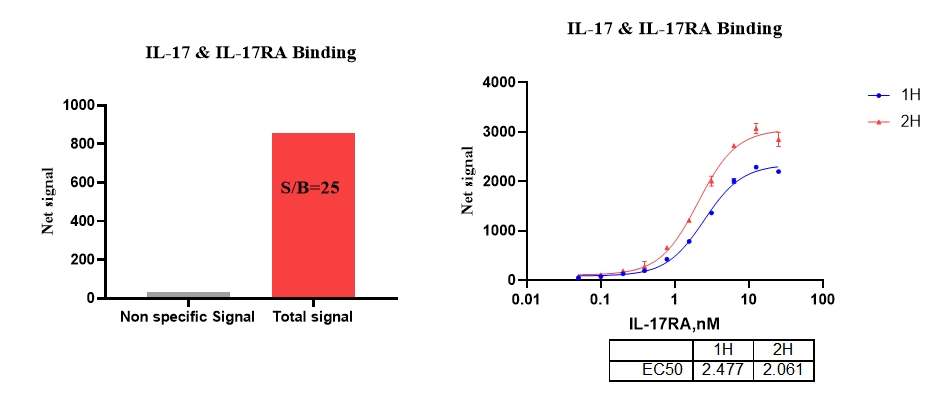
6、IL-17 & IL-17RA 结合
2. PROTAC靶向蛋白降解分子筛选系统
蛋白水解靶向嵌合体(PROTACs)是一种新兴的药物设计策略,其通过利用细胞内泛素-蛋白酶体系统选择性降解靶蛋白。近年来,随着PROTAC技术的持续发展,其应用范围已远超最初的肿瘤治疗领域,逐步拓展至免疫疾病、神经退行性疾病、心血管疾病、感染性疾病等多个领域。
在肿瘤治疗方向,PROTAC技术已取得显著进展。例如靶向雄激素受体(AR)的口服小分子PROTAC药物ARV-110,已进入治疗转移性去势抵抗性前列腺癌的I期临床试验。在非小细胞肺癌研究中,已开发出具有高效力的PROTAC分子,并在体外和体内实验中显示出良好疗效。此外,靶向EGFR的PROTAC分子在非小细胞肺癌治疗中也展现出优势。与传统靶向治疗常因靶蛋白突变或过表达导致耐药不同,PROTAC技术通过降解而非单纯抑制靶蛋白,展现出克服耐药机制的潜力。
PROTAC技术的应用不仅限于肿瘤治疗,在心血管疾病、神经系统疾病、代谢性疾病等多种疾病中也显示出广阔前景。例如采用PROTAC技术开发的靶向ER的口服药物ARV-471,在治疗ER阳性、HER2阴性乳腺癌的临床试验中已显现潜力。该技术为传统"不可成药"靶点的药物开发提供了新途径,例如针对激酶抑制剂非特异性和耐药性问题提供了新的解决方案。
PROTAC技术已引起学术界和工业界的广泛关注,在药物开发中展现出巨大潜力。但仍面临诸多挑战,如如何提高其细胞内外的稳定性和细胞渗透性,以及如何克服可能引起的潜在副作用等。总之,PROTAC技术通过其独特的作用机制,特别是克服传统药物局限性的能力,为多种疾病的治疗提供了新的可能性。
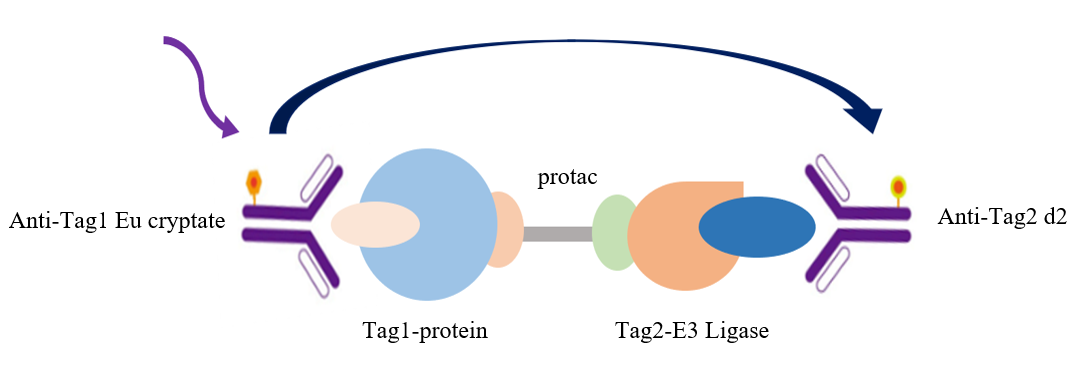
图3 TR-FRET筛选PROTAC分子原理模型
如图所示,本实验采用铕标记的抗Tag1抗体(TR-FRET供体)和受体标记的抗Tag2抗体(TR-FRET受体)来检测Tag1与Tag2的相互作用。由于分子胶PROTAC介导了Tag1与Tag2的结合,使供体抗体与受体抗体相互靠近。当激发供体抗体时,会触发荧光共振能量转移(FRET)至受体抗体,从而在665 nm波长处产生特异性信号。该信号强度与PROTAC和Tag1/Tag2的相互作用程度呈正比。这种均相实验操作简便,无需洗涤步骤。
相关试剂
| Catalog number | Product name | specification |
| abs560016 | Human BRD4/CRBN PROTAC Binding Kit | 500T |
| abs560012 | Human DDB1-CRBN&GSPT1 Binding Kit | 500T |
数据说明:以下数据不可替代实际实验获得的数据,仅作为示例展示。具体结果可能因所用TR-FRET兼容仪器的不同而有所差异。
1、DDB1/CRBN & BDR4,Protac : BET Degrader-1
2、DDB1/CRBN & GSPT1,Protac : CC-885
3. KRAS/cRAF小分子阻断剂筛选系统
KRAS蛋白是一种GTP酶,其功能是将GTP水解为GDP,这是细胞内信号传导过程中的关键步骤。作为RAS家族成员,KRAS蛋白是肿瘤发生中最常发生突变的基因之一,约占人类肿瘤的20-25%。该蛋白在肺癌、结直肠癌和胰腺癌等多种癌症类型中均存在突变。KRAS蛋白的突变常导致其持续激活,从而触发多条促癌信号通路,促进癌细胞增殖、存活和转移。
KRAS蛋白存在多种突变亚型,包括G12C、G12D和G12V等,其中G12C突变最为常见。针对KRAS G12C突变的小分子抑制剂已进入临床试验阶段,在非小细胞肺癌和结直肠癌患者中显示出潜在治疗效果。
MRTX1133是Mirati Therapeutics公司开发的靶向KRAS G12D突变体的小分子抑制剂。G12D是KRAS最常见的突变形式,广泛存在于多种实体瘤中,尤其在胰腺导管腺癌(PDAC)中,约93%的病例存在KRAS突变,其中G12D和G12V最为普遍。MRTX1133作为首个非共价、强效且选择性的KRAS G12D抑制剂,展现出良好的临床性能。
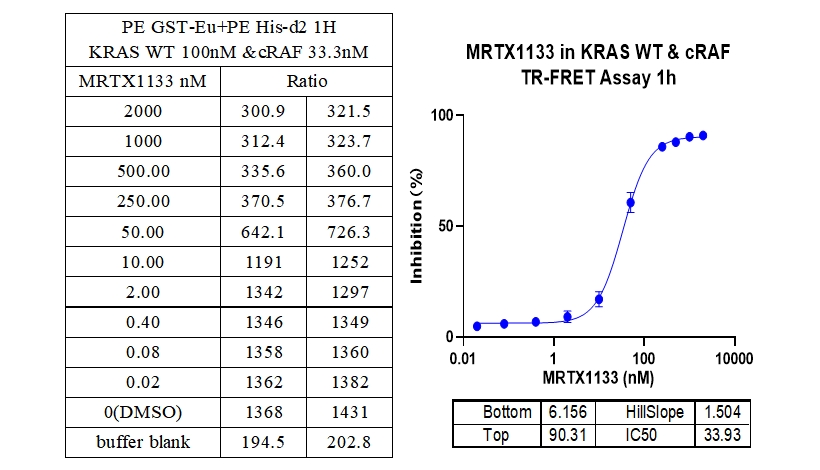
本实验采用铕标记的抗6xHis抗体和受体标记的GST蛋白,检测不同突变型Kras蛋白与cRAF(RAF1)蛋白的相互作用。MRTX1133从300 nM开始进行2倍系列稀释,孵育1小时后检测信号。数据显示该检测方法具有良好的信背比(~7倍)、高灵敏度和选择性(对G12D的IC50值最小)。
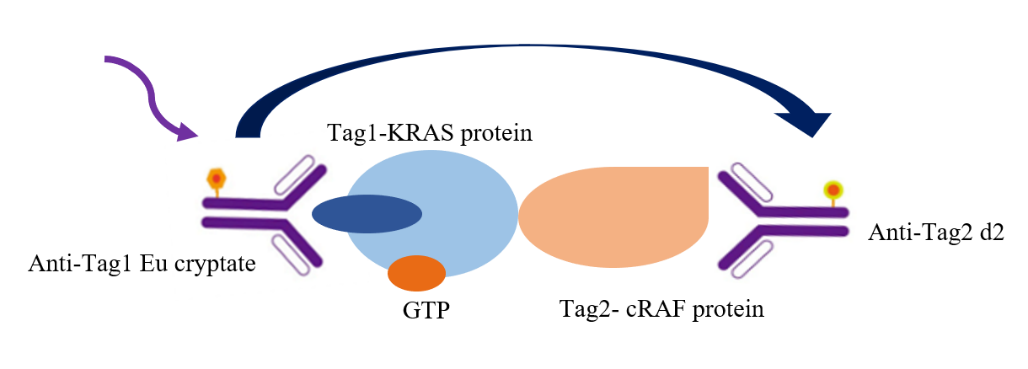
图4 TR-FRET筛选KRAS/cRAF小分子阻断剂原理
如图所示,本实验采用铕标记的抗Tag1抗体(TR-FRET供体)和受体标记的抗Tag2抗体(TR-FRET受体)检测KRAS野生型(WT)/GTP/cRAF三者的相互作用。由于KRAS WT/GTP/cRAF复合物的形成,使得供体抗体与受体抗体相互靠近。当激发供体抗体时,会触发荧光共振能量转移(FRET)至受体抗体,从而在665 nm波长处产生特异性信号。该信号强度与KRAS WT/GTP/cRAF相互作用程度呈正相关。这种均相实验操作简便,无需洗涤步骤。
相关试剂
| Catalog number | Product name | specification |
| abs560003 | Human KRAS WT&cRAF Binding Kit | 500T |
| abs560004 | Human KRAS G12C&cRAF Binding Kit | 500T |
| abs560005 | Human KRAS G12D&cRAF Binding Kit | 500T |
| abs560006 | Human KRAS G12R&cRAF Binding Kit | 500T |
| abs560007 | Human KRAS G12V&cRAF Binding Kit | 500T |
| abs560008 | Human KRAS G13C&cRAF Binding Kit | 500T |
| abs560009 | Human KRAS G13D&cRAF Binding Kit | 500T |
| abs560010 | Human KRAS Q61H&cRAF Binding Kit | 500T |
数据说明:以下数据不可替代实际实验获得的数据,仅作为示例展示。具体结果可能因所用TR-FRET兼容仪器的不同而有所差异。
1、KRAS WT & cRAF 结合抑制剂 : MRTX1133
2、KRAS G12C & cRAF 结合抑制剂 : MRTX1133
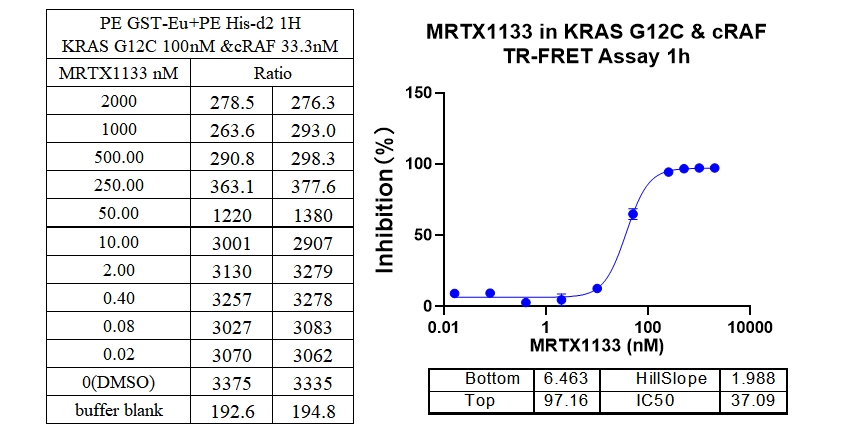
3、KRAS G12D & cRAF 结合抑制剂 : MRTX1133
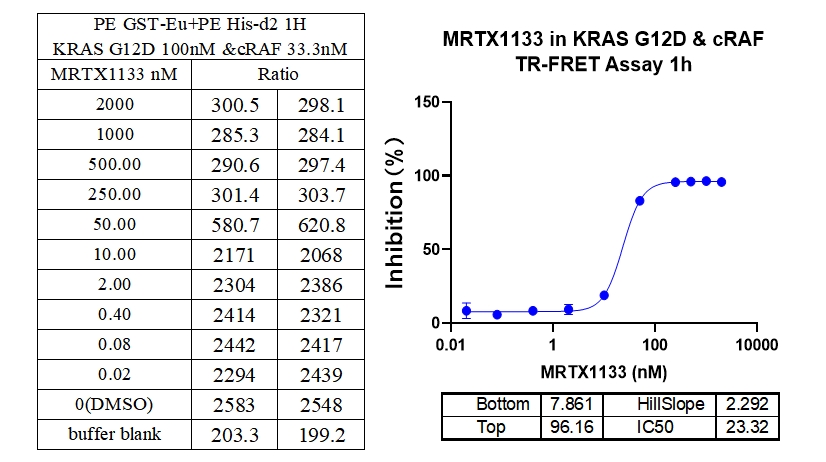
4、KRAS G12V & cRAF 结合抑制剂 : MRTX1133
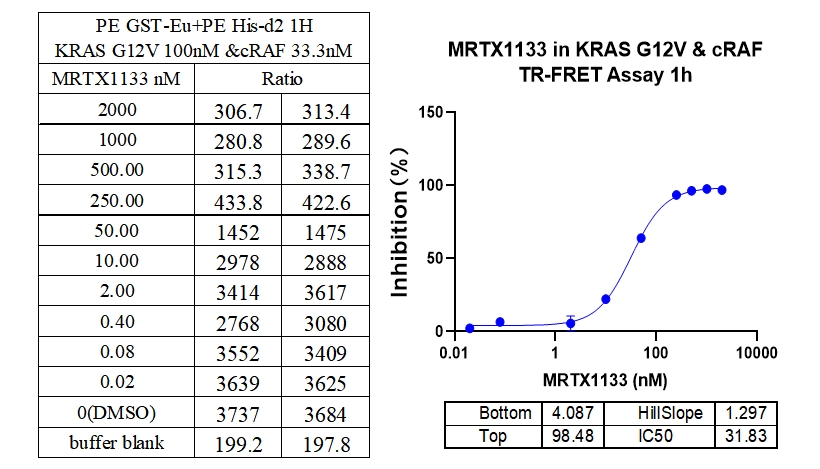
5、KRAS G12R & cRAF 结合抑制剂 : MRTX1133
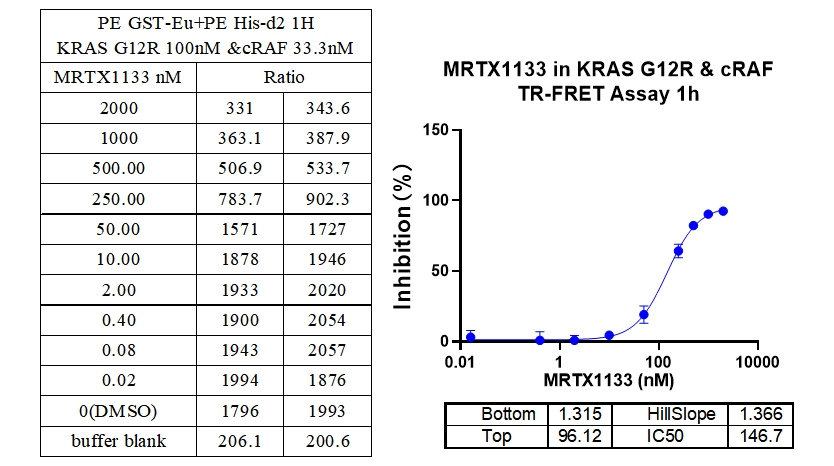
6、KRAS G13C & cRAF 结合抑制剂 : MRTX1133
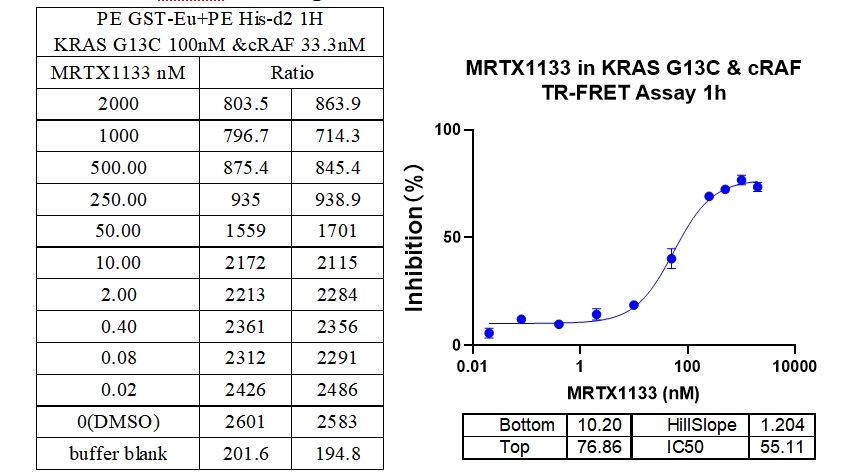
7、KRAS G13D & cRAF 结合抑制剂 : MRTX1133
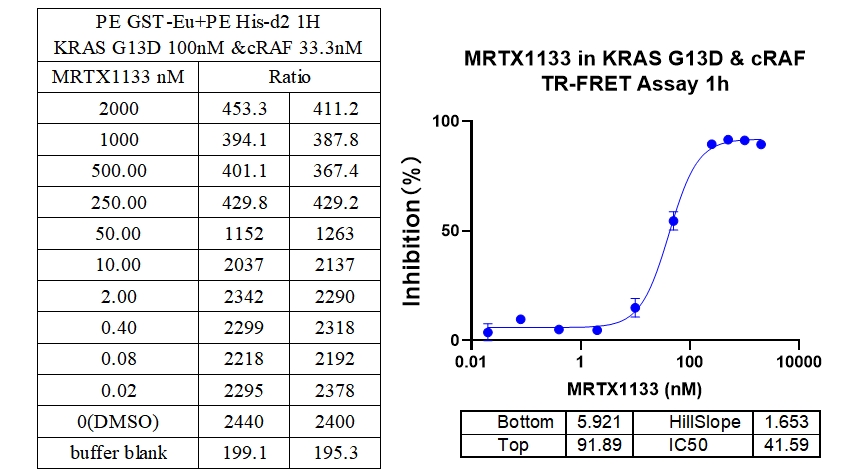
8、KRAS Q61H & cRAF结合抑制剂:MRTX1133
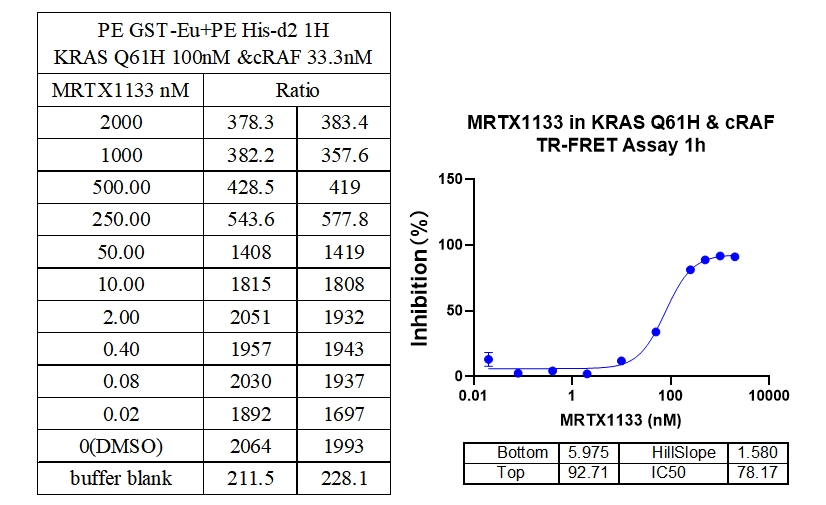
参考文献:
[1] Small Molecule Protein–Protein Interaction Inhibitors as CNS Therapeutic Agents: Current Progress and Future Hurdles.Richard R Neubig; Levi L Blazer
[2] Effects of 17-DMAG on non-small cell lung cancer cell lines A549 and H1975 being resistant to EGFR-TKI.Zhao, Lei; Cao, Fumin
[3] Latest Overview of the Cyclin-Dependent Kinases 4/6 Inhibitors in Breast Cancer: The Past, the Present and the Future.Zhang, Wei; Chen, Xiu; Xu, Weilin ; et al.
[4] Proteolysis targeting chimera (PROTAC) in drug discovery paradigm: Recent progress and future challenges,Zeng, Shenxin; Huang, Wenhai; Liyan Cheng; et al.
[5] Overcoming Cancer Drug Resistance Utilizing PROTAC Technology.Zheng, Guangrong; Burke, Matthew R; Smith, Alexis R