蛋白质组学技术揭秘帕金森病:LiP-MS、BAR、UltraID - LIPA 助力 α- 突触核蛋白研究
引言
实验室里飘着淡淡的试剂味,移液器“咔嗒”声和离心机的“嗡嗡”声搭着调,我盯着显微镜下发光的细胞 —— 今天依旧是跟 α-syn(α-突触核蛋白)死磕的一天!
这小东西可是帕金森病的 “关键捣蛋鬼”:要么在神经细胞里缠成乱糟糟的小团(异常聚集),要么放着突触运输的正经活不干(功能失调),咱们研究帕金森病这么久,最头疼的就是摸不清它到底咋一步步 “作妖”,把疾病给引出来。之前对着电镜看它聚成的团,只能干着急 —— 不知道它结构啥时候开始变的,也搞不清它跟哪些蛋白偷偷 “搭伙”,更追不上它从单个分子变成大聚集体的过程。
还好这两年蛋白质组学技术像开了窍!新上手的几个技术简直是 “破案神器”:有的像 “高清抓拍机”,连 α-syn 细微的结构变脸都能拍得明明白白;有的是 “蛋白社交仪”,能把它和其他蛋白的互动关系画得清清楚楚;还有的像 “动态录像机”,能盯着它从单个 “小颗粒” 慢慢抱成 “大团子”。
今天这笔记就好好记记这三个 “宝贝”,看它们围着 α-syn 这个核心,怎么帮咱们一点点拆开帕金森病的分子谜题,把那些藏在蛋白里的病理线索揪出来!
LiP-MS:捕捉 α-syn等蛋白质结构变化的 “高清摄像机”
《Nature Structural & Molecular Biology》的一项研究展示了有限蛋白酶解 - 质谱联用技术(LiP-MS)的强大能力 —— 这种技术如同 “高清摄像机”,能实时捕捉帕金森病中包括 α- 突触核蛋白在内的蛋白质结构变化,而非仅关注蛋白丰度的改变。
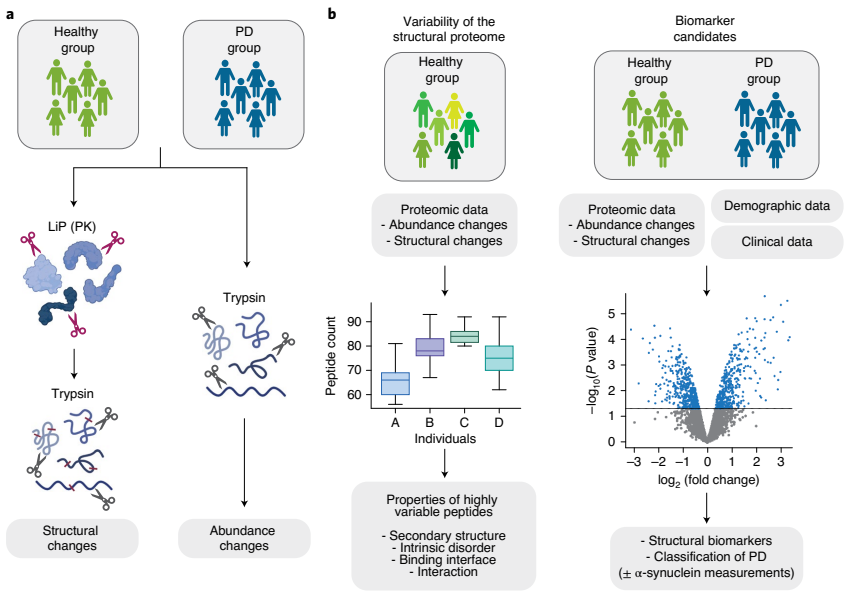
图1. LiP-MS 技术分析图
PD患者脑脊液中聚集的 α-syn,其聚集区域因空间封闭无法被蛋白酶K切割,在LiP-MS中表现为“特定肽段缺失”,而这一差异能通过LiP的酶解步骤暴露。研究人员通过分析帕金森病患者与健康人的脑脊液,共发现76个结构发生改变的蛋白质。这些蛋白质涉及突触维持、乙酰胆碱代谢等已知在帕金森病中失调的过程( α-syn 的结构异常正是导致突触功能紊乱的关键因素之一)。
技术亮点
LiP-MS 在该研究中的核心优势在于精准检测蛋白质结构变化,可捕获 α-syn 等蛋白的变构效应、活性位点占据、化学修饰及聚集倾向等功能相关改变,为理解蛋白质功能失调的分子基础提供直接依据。
研究发现
● 结构变化信息在区分健康人和帕金森病患者方面优于蛋白质丰度信息,并提高了基于 α-syn 脑脊液测量指标的判别性能;
● 过半数在脑脊液中检测到结构变化的蛋白质,在大脑样本中也显示出结构变化。
BAR技术:绘制 α- syn相互作用网络的 “测绘仪”
《Acta Neuropathologica Communications》的研究采用抗体识别生物素化技术(BAR)—— 这种技术像 “测绘仪” 一样,能在空间上精准标记(约 50-100 nm 半径内)与目标蛋白相互作用的分子,从而绘制帕金森病中 α-syn 的特异性相互作用网络图谱。
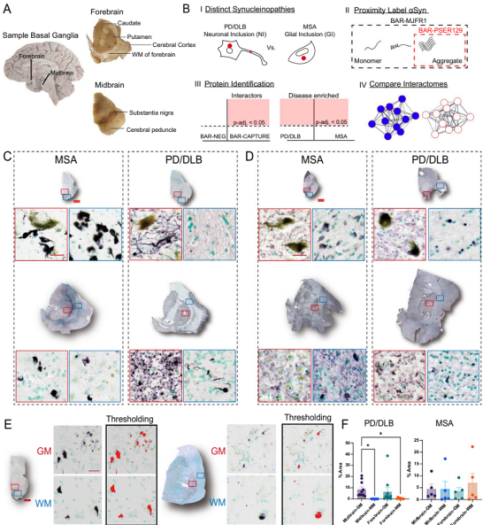
图2. BAR 技术相互作用组对比图
研究团队以 α-syn 为病理核心,比较了多系统萎缩(MSA)与帕金森病 / 路易体痴呆(PD/DLB)中的的相互作用组,最终鉴定出 79 个 PD/DLB 差异丰富的蛋白质,而 MSA 中仅发现 3 个差异丰富的蛋白质,明确了不同 PD/DLB的 α-syn 分子差异。
技术亮点
BAR 技术可提供高质量的 α-syn 相互作用组数据,其空间分辨率能精准定位与其发生相互作用的蛋白区域,避免非特异性相互作用的干扰,为解析 α-syn 的功能网络提供清晰视角。
研究发现
● PD/DLB的相互作用主要集中在囊泡/SNARE相关通路,而MSA则强烈富集于代谢/分解代谢、铁和细胞氧化剂解毒通路。
● 胞质抗氧化酶(过氧还蛋白)网络驱动了MSA中的细胞解毒通路富集。
UltraID-LIPA:追踪 α- syn聚集过程的 “时间机器”
《iScience》报道的 UltraID - 光诱导蛋白聚集技术(UltraID-LIPA),如同 “时间机器” 一般,能在活细胞内实时诱导并监测 α-syn 的聚集过程,尤其聚焦于疾病早期的寡聚化事件 —— 被认为是帕金森病病理发生的起始步骤。
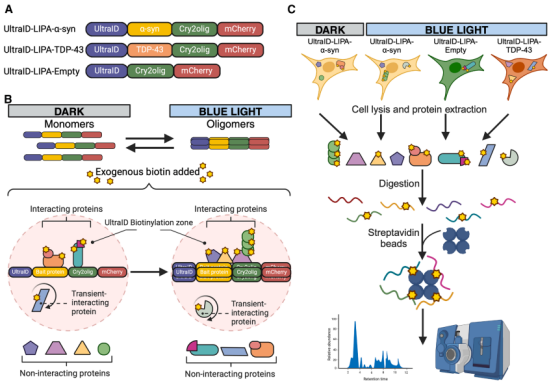
图3. UltraID-LIPA 聚集追踪示意图
该技术创新性结合了光诱导蛋白聚集系统(LIPA)与 UltraID 邻近依赖性生物素化分析:通过蓝光诱导 α-syn 聚集,同时利用 UltraID 标记聚集过程中与其相互作用的蛋白,最终成功鉴定出 38 个相互作用蛋白,其中既包括已知的关联蛋白,也包含此前未报道的候选蛋白。
技术亮点
UltraID-LIPA 具备无与伦比的时间分辨率,可在活细胞内动态追踪 α-syn 从单体到寡聚体的聚集过程,同时捕获早期聚集阶段的相互作用蛋白,填补了 “α-syn 早期聚集机制不明” 的研究空白。
研究发现
在 α-syn 早期寡聚化过程中,内溶酶体和膜相关蛋白显著富集—— 这一结果直接支持了 “α-syn与膜结合细胞器相互作用在其聚集早期阶段起关键作用” 的假设,为理解帕金森病中其异常聚集的起始机制提供了关键证据。
技术比较:以 α- syn为核心,多维度解析帕金森病
三种技术从不同维度围绕 α-syn 展开研究,各有独特优势与应用场景,共同构建了帕金森病分子机制研究的 “全景图”:
| 技术维度 | LiP-MS | BAR 技术 | UltraID-LIPA |
|---|---|---|---|
| 核心分辨率 | 结构分辨率 (解析 α- syn等蛋白的结构变化) | 空间分辨率 (定位 α- syn的相互作用区域) | 时间分辨率 (追踪 α- syn的聚集动态) |
| 核心研究目标 | 筛选帕金森病中 α- syn 等蛋白的结构异常标志物 | 绘制帕金森病(PD/DLB)特异的α- syn相互作用网络 | 捕捉 α- syn早期寡聚化及关联相互作用蛋白 |
| 关键应用场景 | 生物液体(如脑脊液)中 α- syn相关结构标志物的高通量筛选 | 疾病特异的 α- syn 相互作用机制解析 | 活细胞内 α- syn聚集动态及早期病理机制研究 |
| 技术核心依赖 | 专门的蛋白酶处理流程 | 高质量的 α- syn特异性抗体 | 光遗传学操控能力 及活细胞培养体系 |
未来展望:多技术融合推动帕金森病研究
这三种技术的出现和发展,正在推动帕金森病研究向更深层次发展:
- 机制研究:通过这些技术,我们不仅可以发现疾病相关的蛋白质和通路,更能理解这些变化的功能意义。
- 生物标志物开发:LiP-MS研究显示结构生物标志物可能比丰度生物标志物具有更好的诊断性能,为开发新型诊断工具提供了方向。
- 治疗靶点识别:BAR技术揭示的疾病特异性相互作用网络为开发靶向治疗提供了新思路。
- 技术融合:未来可能会出现结合多种技术优势的整合平台,如在时间分辨基础上加入结构分析能力,为研究蛋白质聚集提供更全面的视角。
结语
蛋白质组学技术的进步正在改变我们研究神经退行性疾病的方式。从LiP-MS的结构洞察,到BAR的相互作用图谱,再到UltraID-LIPA的时间分辨率,每种技术都在为我们理解帕金森病的分子机制提供独特视角。
对于研究者来说,根据具体科学问题选择合适的技术平台至关重要。而技术的交叉融合很可能孕育出更强大的研究工具,最终推动帕金森病的诊断和治疗进步。无论是技术开发者还是疾病生物学研究者,这些蛋白质组学新方法都值得密切关注。它们不仅扩大了我们的研究工具箱,更开启了理解疾病机制的新窗口。
参考文献
[1] Mackmull MT, Nagel L, Sesterhenn F, et al. Global, in situ analysis of the structural proteome in individuals with Parkinson's disease to identify a new class of biomarker. Nat Struct Mol Biol. 2022;29(10):978-989. doi:10.1038/s41594-022-00837-0
[2] Choi SG, Tittle TR, Barot RR, et al. Proximity proteomics reveals unique and shared pathological features between multiple system atrophy and Parkinson's disease. Acta Neuropathol Commun. 2025;13(1):65. Published 2025 Mar 23. doi:10.1186/s40478-025-01958-5
[3] Teixeira M, Sheta R, Musiol D, et al. Combining light-induced aggregation and biotin proximity labeling implicates endolysosomal proteins in early α-synuclein oligomerization. iScience. 2025;28(7):112823. Published 2025 Jun 6. doi:10.1016/j.isci.2025.112823
