Nature Genetics|空间蛋白组联合空间转录组发现非小细胞肺癌免疫治疗响应的预测标志物
非小细胞肺癌(NSCLC)患者对抗PD-1/PD-L1的免疫治疗反应不一,即使PD-L1高表达的患者中也有约40%出现原发性耐药。此外,免疫治疗可能引发严重的免疫相关毒性。因此,亟需能够精准预测疗效的生物标志物来指导患者分层,优化治疗效果。传统的生物标志物(如PD-L1肿瘤比例评分TPS)存在局限性。肿瘤免疫微环境(TIME)是一个复杂的生态系统,细胞的空间分布和相互作用对免疫应答至关重要。空间多组学技术能够在保留组织原位空间信息的前提下,同时分析蛋白和基因表达,从而更全面地揭示TIME的组成和功能状态。近期,一项发表在《Nature Genetics》的研究通过整合PhenoCycler-Fusion(PCF)空间单细胞蛋白组和DSP空间转录组数据,开发了一个稳健的机器学习框架,构建了能够预测NSCLC患者对一线免疫治疗(主要是PD-1抑制剂)反应的生物标志物。
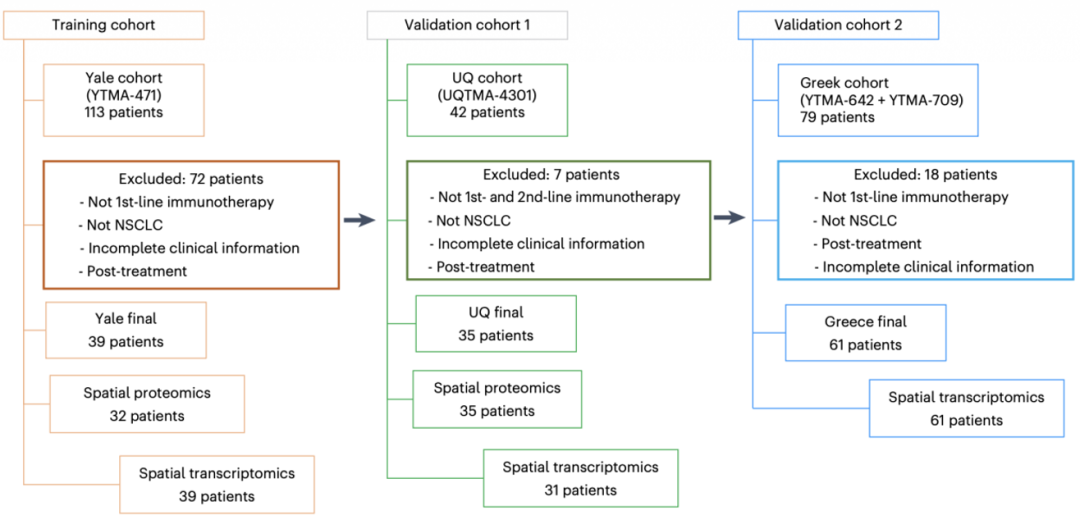
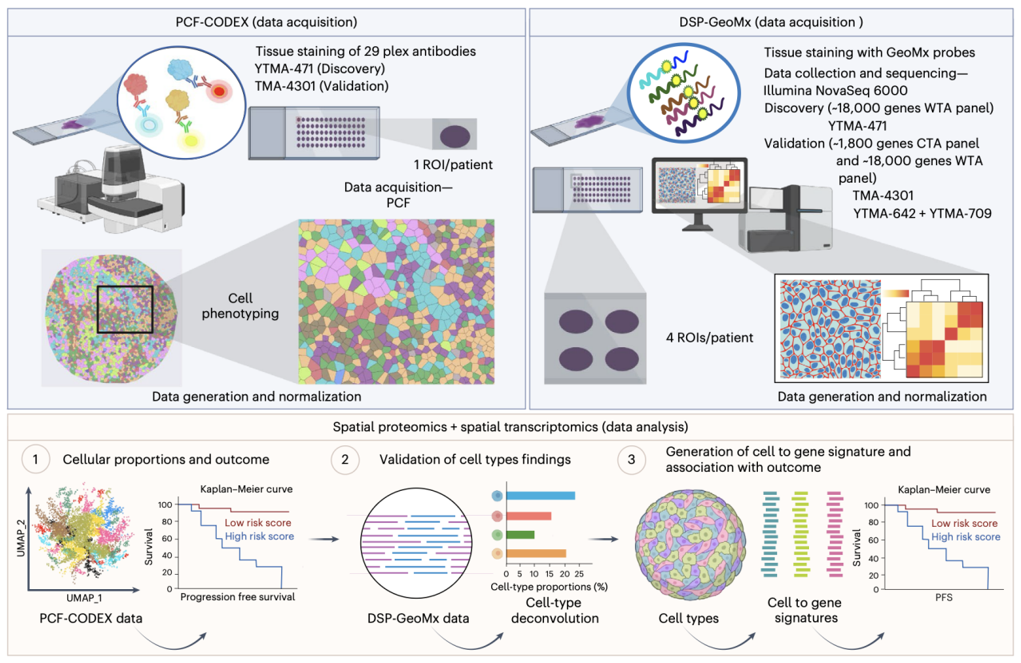
这项研究总共分析了3个队列的组织芯片(TMA)样本。发现队列(YTMA-471)聚焦于接受一线免疫治疗的患者,其中32例患者样本开展PCF空间单细胞蛋白组检测(29种抗体),39例患者样本开展DSP空间转录组检测。验证队列1(TMA-4301)包含了术后复发并接受PD-1抑制剂治疗的患者,其中35例样本开展PCF检测,31例进行了DSP检测。验证队列2(YTMA-642 + YTMA-709)大部分是接受一线免疫治疗的患者,共有61例样本进行DSP检测。
| PCF-29plex
该研究采用的策略是“细胞到基因”:先通过PCF空间单细胞蛋白组学确定有意义的细胞表型,再从其对应的空间转录组数据中提取基因特征,实现了信息的有效衔接。研究首先利用PCF空间单细胞蛋白组数据,在肿瘤和基质区域分别识别与不良预后(耐药)和良好预后(应答)相关的细胞群体,并且分析了细胞间的空间相互作用和微环境结构,阐释了潜在的生物学功能。然后基于上述细胞类型,从空间转录组学数据中衍生出与之对应的基因特征,并在独立的外部队列中验证这些细胞和基因特征的预测能力。
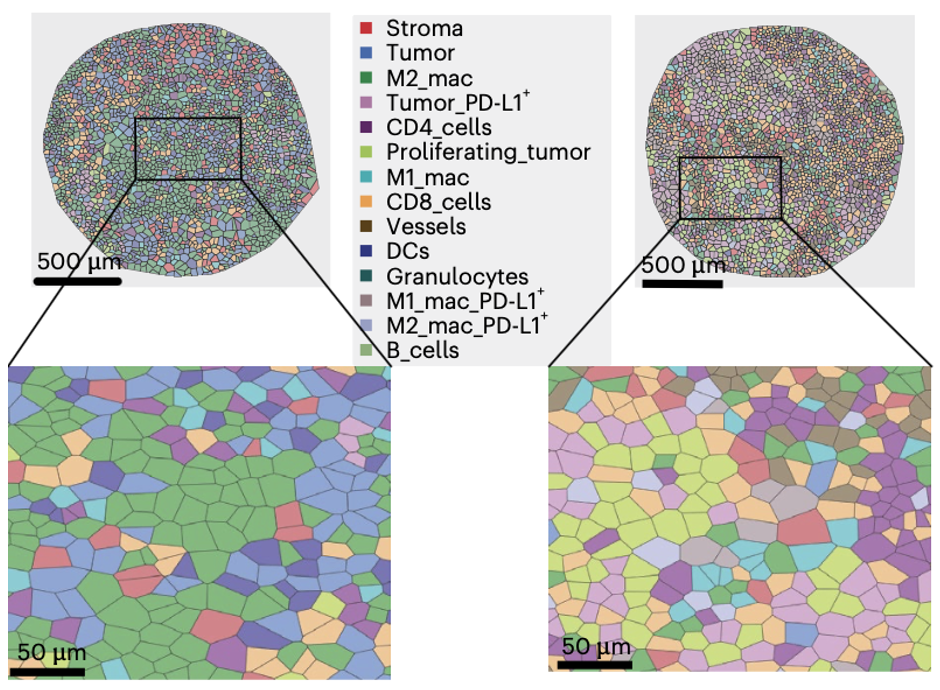
研究首先通过PCF空间单细胞蛋白组高质量的图像分析和聚类,鉴定和注释了14种主要的细胞类型。这些细胞类型涵盖了肿瘤细胞、免疫细胞和基质细胞。研究区分了肿瘤区域(PanCK+)和基质区域(PanCK-),通过差异比较、单变量Cox分析揭示了关键的预后相关细胞组成,之后利用稳健的机器学习流程,将单变量分析中发现的有潜力的细胞类型组合成预测模型。最终构建了两种模型,其中耐药模型由肿瘤区域内粒细胞、增殖性肿瘤细胞和血管细胞组成,该模型能显著区分高风险患者。应答模型由基质区域内的M1巨噬细胞、M2巨噬细胞和CD4+ T细胞组成,该模型与良好的预后显著相关。
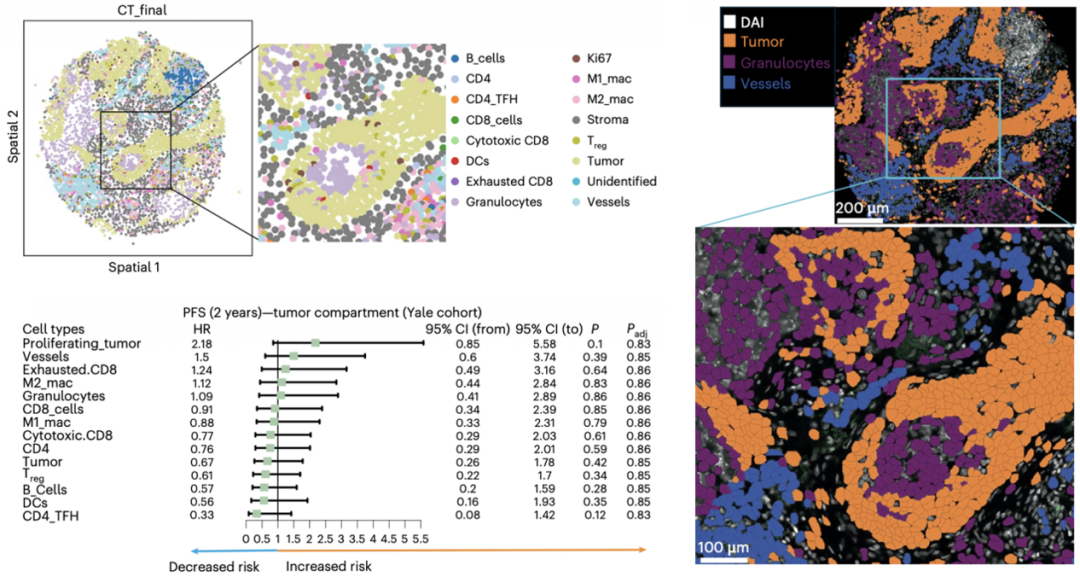
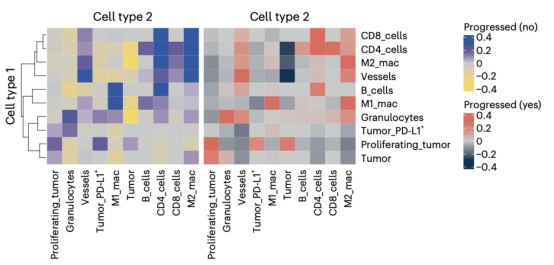
细胞邻域分析识别出了10个不同的细胞邻域。其中,增殖肿瘤细胞邻域在进展患者中更常见,支持了其在耐药中的作用。细胞互作分析发现了增殖肿瘤细胞与粒细胞、内皮细胞相互作用密切,提示其在肿瘤增殖和血管生成中协作。在应答患者中,M2巨噬细胞与CD4+和CD8+T细胞的相互作用增强,表明可能存在免疫调节作用。并且巨噬细胞上的PD-L1表达(而非肿瘤细胞上的PD-L1)与更长的PFS显著相关。这些空间分析为特征细胞的功能提供了空间生物学层面的解释,这些结果突出表明了肿瘤区域内的增殖/血管/粒细胞群构成了一个“耐药生态位”,而基质区域内的巨噬细胞和T细胞群则构成了一个“应答生态位”。空间信息的保留至关重要,因为如果将组织作为一个整体分析,这些具有相反预后价值的信号可能会相互抵消而被忽略。
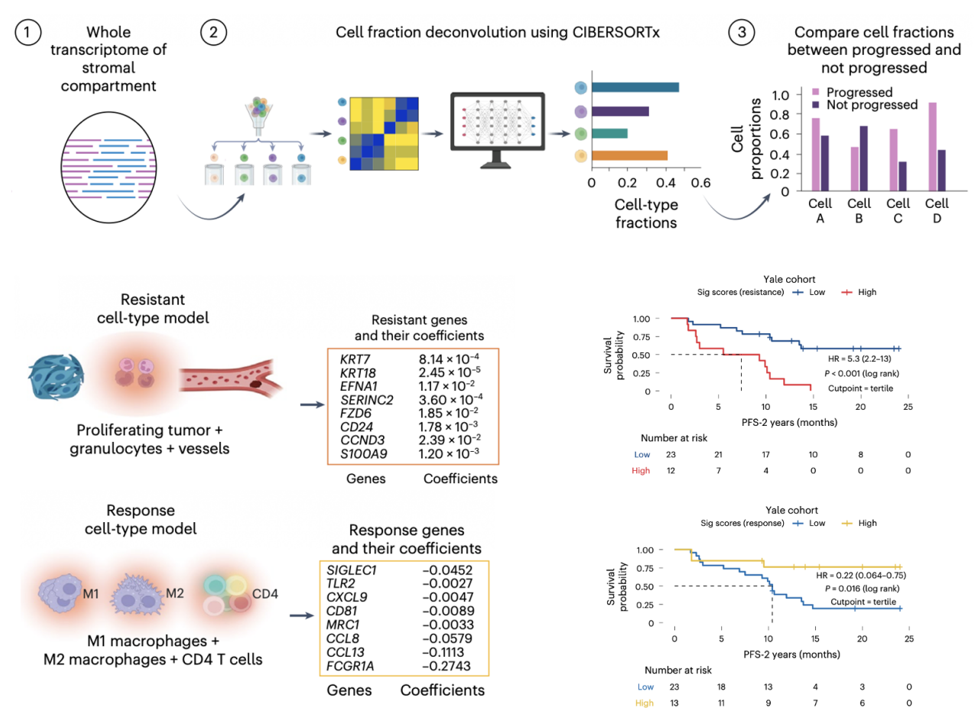
通过CIBERSORTx等工具对基质区域的DSP转录组数据进行细胞类型反卷积,验证了M2巨噬细胞在无进展患者中富集,与PCF发现一致。基于PCF发现的预后细胞类型,研究者提取了这些细胞类型的DSP转录组数据,构建了预后基因特征。其中耐药基因特征(来自肿瘤区域)包含8个基因(如KRT7, KRT18, S100A9等)。该特征在三个队列中均能预测不良预后。这些基因与上皮-间质转化(EMT)、血管生成和免疫抑制相关。而应答基因特征(来自基质区域)如CXCL9, TLR2, MRC1等富集于免疫细胞激活和招募等通路。该特征在三个队列中均能预测良好预后。
总结与讨论
该研究成功构建了一个从“空间”到“分子”,从“细胞”到“基因”的完整研究框架:首先利用高分辨率的PCF空间单细胞蛋白组学,在组织的原位上精准识别出与免疫治疗结局相关的关键细胞表型。基于细胞的空间坐标,进一步分析细胞邻域和相互作用,为这些细胞特征的功能提供了空间生物学层面的解释(如耐药生态位的构成,免疫应答的细胞协作)。从上述有明确空间和功能意义的细胞类型出发,在对应的空间分区转录组数据中,利用机器学习筛选出能代表这些细胞群体的基因集合。最终得到的细胞和基因特征在来自不同地区的独立队列中得到了稳健验证,证明了其预测价值的普适性。
总之,这项研究通过巧妙的实验设计和数据分析流程,将空间多组学数据有机整合,不仅发现了具有预测价值的生物标志物,还深入揭示了肿瘤免疫微环境的空间组织规律,为NSCLC的精准免疫治疗提供了重要的新见解和工具。
