【笔记】2.1.1.2 原电池与电解池
根据电化学反应发生条件与结果的不同,电化学系统可划分为原电池和电解池两类,两者均由电解液和电极组成。
定义
原电池:化学能→电能的装置。
电解池:电能→化学能 (与外电源组成回路,使得电流在电化学体系中通过并促使电化学反应发生)的装置。
最直接的判断方法就是有没有接外电源,无则是原电池(自己产电,把化学能转为电能),有则是电解池(靠外界电源把电能转为化学能)。
很容易看出,下图中左图是原电池,右图是电解池。
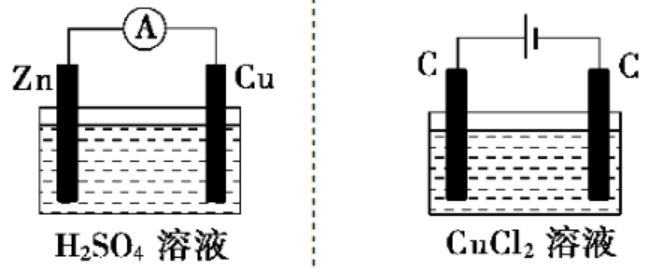
电解质溶液的导电机理
电极命名:
- 正极:电势高的电极
- 负极:电势低的电极
- 阳极:发生氧化反应的电极
- 阴极:发生还原反应的电极
原电池常常用正负极命名,电解池常用阴阳极命名。
为了保持电解液的电中性,荷电粒子必须在两极间运动。同时,电子需要通过外电路进行传输并避免其在电极上积累。电极反应是一种特殊的氧化还原反应,其发生在不同地点,但电子转移物质的量相等。
电流通过溶液是通过正负离子的定向迁移,电流在溶液和界面的连续是通过离子在电极上分别得失电子,发生氧化还原反应实现的。
记住:
- 电解池的正极就是阳极(失去电子,氧化反应)
- 电解池的负极就是阴极(得到电子,还原反应)
- 原电池的正极就是阴极(得到电子,还原反应)
- 原电池的负极就是阳极(失去电子,氧化反应)
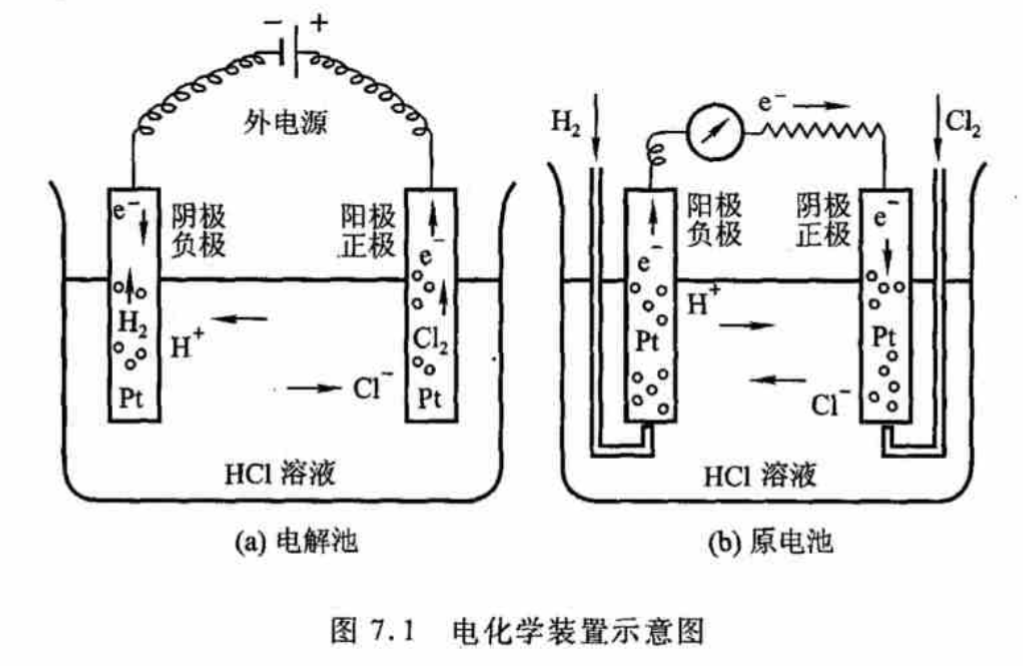
下图中,(a)是电解池,Pt电极插在HCl溶液内;(b)是原电池,把氢气和氯气冲到Pt电极上,插在Hcl溶液内。
(a)中,电解质内电流从正极流到负极。故Cl-往正极流,H+往负极流。
Cl-在正极失去电子,变成氯气。
2Cl−=Cl2+2e−2Cl^-=Cl_2+2e^-2Cl−=Cl2+2e−
H+在负极得到电子,变成氢气。
2H++2e−=H22H^++2e^-=H_22H++2e−=H2
总反应是:2HCl→H2+Cl22HCl\rightarrow H_2+Cl_22HCl→H2+Cl2
由于需要消耗电功的非自发反应,故ΔG>0\Delta G>0ΔG>0
(b)中,发生自发反应H2+Cl2→2HClH_2+Cl_2\rightarrow 2HClH2+Cl2→2HCl。
故氯气得到电子,变成Cl-:Cl2+2e−→2Cl−Cl_2+2e^-\rightarrow 2Cl^-Cl2+2e−→2Cl−
氢气失去电子,变成H+:H2→2H++2e−H_2\rightarrow 2H^++2e^-H2→2H++2e−
由于电极之间电子的得失,导致电势差的产生,从而在两个电极连接导线,会产生电流。通氯气那电极为正极,另一极为负极。
电流从正极流向负极,电解液中从负极流向正极。
故H+向氯气电极方向迁移,Cl-向氢气电极方向迁移。
法拉第定律
1833 年,法拉第在总结大量实验的基础上,提出法拉第第一定律及第二定律:
- 在电极上发生电极反应的物质质量与通过的电量成正比:m=MnFQm=\frac{M}{nF}Qm=
