【科研知识】常用细胞增殖检测方法
上期文章写到细胞增殖的检测方法有好多种,而我司常用的是MTT法、CCK-8法、CTL化学发光法以及EdU488法。本期就这四种方法详细展开讲讲它们的原理、实验步骤以及优缺点。
一、MTT法
MTT(3-(4,5)-dimethylthiahiazo (-z-y1)-3,5-di-phenytetrazoliumromide)是一种接受氢离子的黄色染料,商品名为噻唑蓝,1983年Mosmann建立MTT比色法,用于检测细胞存活和增殖。
原理:
活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为不溶于水的蓝紫色结晶甲臜(Formazan),并沉积在细胞中,而死细胞无此功能。二甲基亚砜(DMSO)能溶解细胞中的甲臜,用酶标仪在570nm波长处测定其光吸收值(OD值),可间接反映活细胞数量。在一定的细胞数量范围内,MTT结晶形成的量与细胞数成正比。根据测得的OD值来判断活细胞数量,OD值越大,细胞数量越多或活性越强(如果是测药物毒性,则表示药物毒性越小)。
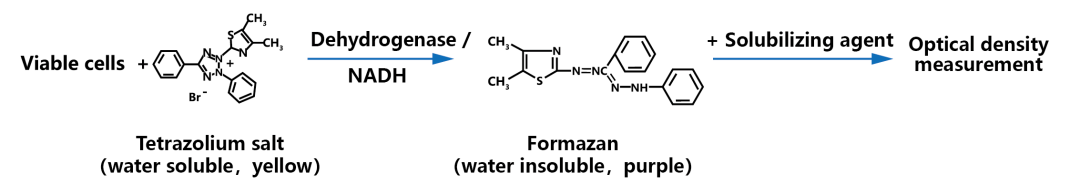
图1 活细胞中MTT四唑盐还原为甲臜示意图(Buranaamnuay K., 2021)。
实验流程:
(1)细胞铺板:一般用96孔板,收集对数期细胞,铺板密度为1×104/孔,每孔加100μL细胞重悬液,过夜培养;
(2)药物处理:根据实验目的选做;一般是前一天铺板,次日加药;
(3)加MTT:吸去细胞培养上清,每孔加入80~90μL培养基+10~20μL MTT溶液(MTT占比10~20%),继续培养4h;
(4)加DMSO:终止培养,小心吸去孔板内的细胞培养液,每孔加入100~150μL DMSO,置于摇床上低速振荡10min,使结晶物充分溶解;
(5)酶标仪检测:在570nm测量各孔的吸光值。
优缺点:
优点:简便、灵敏、经济、快速且无放射性,可用于所有细胞类型。
缺点:MTT经还原所产生的甲瓒产物不溶于水,需被溶解后才能检测,不仅增加工作量,还影响实验结果的准确性,且溶解甲瓒的有机溶剂有毒性。
二、CKK-8法
CCK-8是MTT的升级版,其检测试剂中含有WST-8——一种类似于MTT的化合物。WST-8是近年新开发的一种较WST-1更新的水溶性四唑盐,其检测灵敏度比MTT、XTT及MTS更高,尤其适合于悬浮细胞和高通量药物筛选。更重要的是,CCK-8细胞毒性低,细胞经检测后还可重复利用,具有更好的实用性,可替代MTT法,具有良好的应用前景。
原理:
WST-8在电子耦合试剂1-Methoxy PMS(1-甲氧基-5-甲基吩嗪鎓硫酸二甲酯)的作用下,可被线粒体中的脱氢酶还原为具有高度水溶性的橙黄色甲瓒产物。生成的甲臜物数量与活细胞数量成正比。用酶标仪在450nm波长处测定其OD值,可间接反映活细胞数量,细胞增殖越多越快,颜色越深;细胞毒性越大,则颜色越浅。
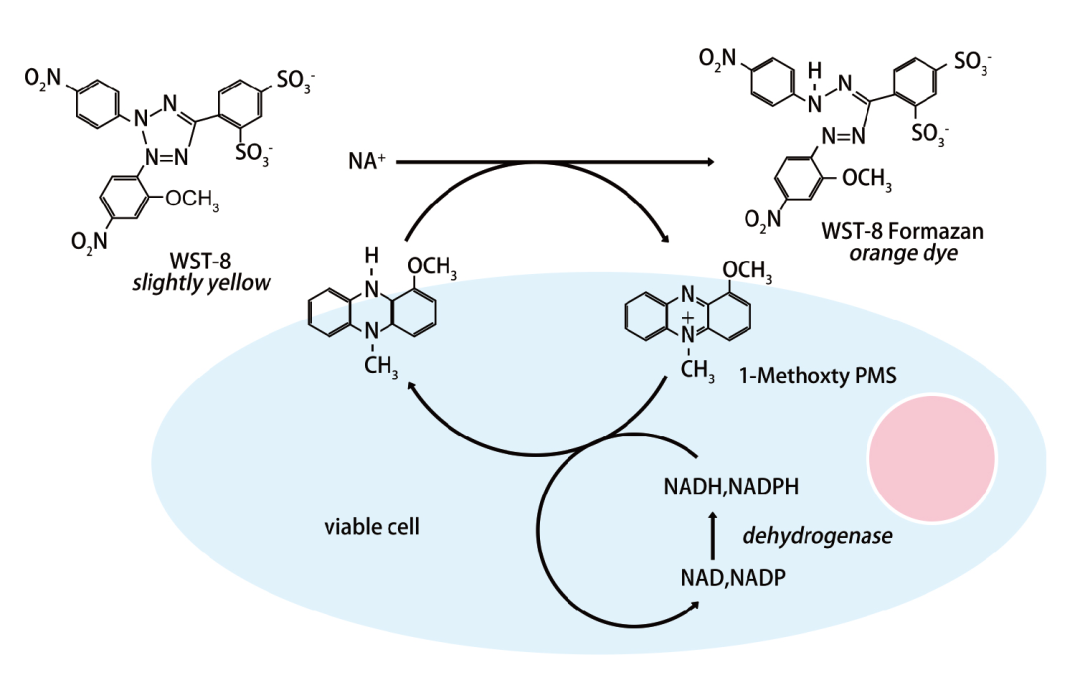
图2 CCK-8检测原理图。
实验流程:
(1)细胞铺板:一般用96孔板,收集对数期细胞,铺板密度为1×104/孔,每孔加100μL细胞重悬液,过夜培养;
(2)药物处理:根据实验目的选做;一般是前一天铺板,次日加药;
(3)加CCK-8:每孔加入10μL CCK溶液,继续培养3-4h;
(4)酶标仪检测:在450nm测量各孔的吸光值。
优缺点:
优点:
1、产生的甲瓒产物是水溶性的,可减小实验误差;
2、不需要放射性同位素和有机溶剂,对细胞的毒性小;
3、重复性优于MTT法;
4、检测试剂无需预制,即开即用;
5、灵敏度高,线性范围宽,数据可靠,重现性好;
6、操作简便,省时省力;
7、适合于高通量药物筛选。
缺点:
1、与MTT法相比,CCK-8价格较贵;
2、试剂的颜色为淡红色,与含酚红的培养基颜色接近,操作过程中容易多加或漏加。
三、CellTiter-Glo发光活细胞检测系统
CellTiter-Glo(CTG)是基于ATP检测的快速细胞活力检测法,是公认的高灵敏度发光检测法,是细胞活力检测的金标准,在国内外被广泛应用。
原理:
ATP腺嘌呤核苷三磷酸(简称三磷酸腺苷)参与生物体内多种酶促反应,是活细胞新陈代谢的一个指标,其含量直接反应了细胞的数量及细胞状态。实验过程中向细胞培养基加入等体积CTG试剂,利用荧光素酶Luciferase与其底物荧光素Luciferin的生物发光为基础,如果有ATP存在荧光素酶就会发光,而且其发光强度与ATP浓度成正比,而ATP又和活细胞数呈正相关。因此可在光信号和体系中,测量发光值,通过检测ATP含量得到细胞活力。
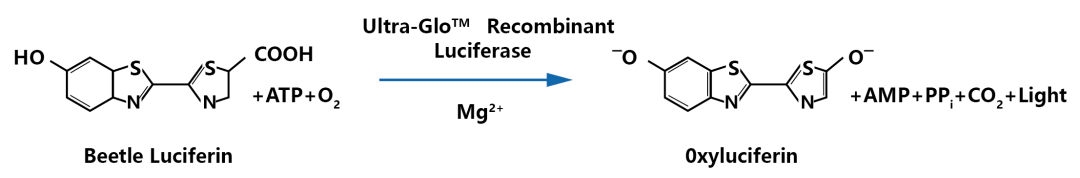
图3 CTG发光检测原理。
实验流程:
(1)细胞铺板:收集对数期细胞,96孔板铺板密度为1×104/孔,每孔加100μL细胞重悬液,培养至正常生长阶段;
(2)药物处理:根据实验目的选做;
(3)ATP标准曲线的设置:把自备的ATP标准溶液用PBS或细胞培养液稀释成适当的浓度梯度;
(4)加CTG:按照96孔板每孔100μL,室温振荡2min,孵育10min;
(5)酶标仪检测:使用具有检测化学发光功能的多功能酶标仪进行化学发光检测。
优缺点:
优点:
1、CTG和细胞培养中的常用培养基兼容,如RPMI 1640、MEM、DMEM、Ham's F12等,也不受酚红和有机溶剂的影响;
2、线性范围宽、发光强度高、检测灵敏度高、稳定性好;
3、操作简单,读数稳定,检测速度快,完成检测仅需约10分钟。
缺点:价格很贵,成本太高。
四、EdU法
EdU检测法是BrdU的替代方法,也是目前更广泛适用的方法。EdU(5-Ethynyl-2’-deoxyuridine)是一种胸腺嘧啶核苷类似物,能够在细胞增殖时期代替胸腺嘧啶(T)渗入正在复制的DNA分子中。
原理:
通过EdU与Apollo荧光染料的特异性共轭反应,使得染料标记到EdU插入的增殖中的细胞,进而快速检测细胞DNA复制活性。
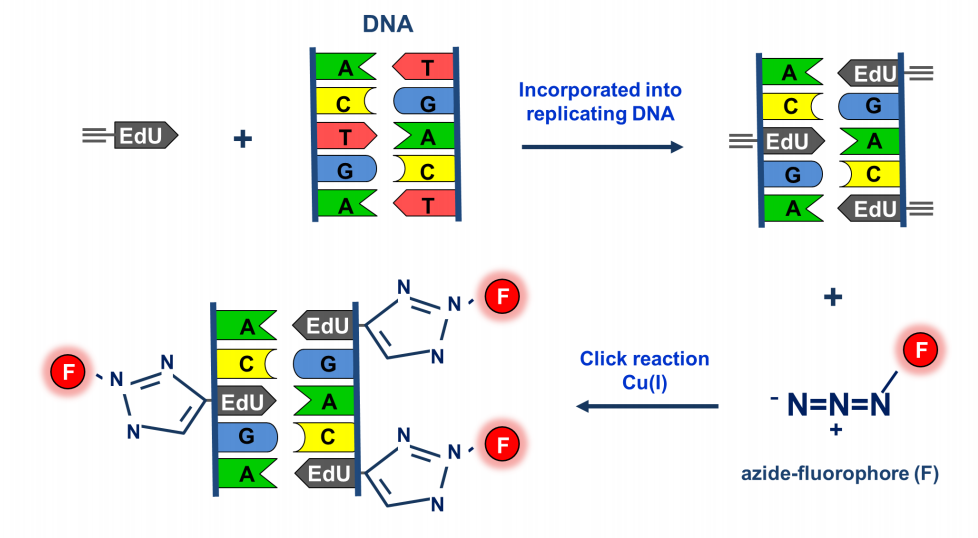
图4 EdU反应原理(Endaya B B., 2016)。
实验流程:
(1)细胞铺板:按每孔1×105~3×106个细胞接种于6孔板中,培养至正常生长阶段;
(2)药物处理:根据实验目的选做;
(3)EdU标记:EdU的标记浓度应根据所用的细胞类型做相应的优化选择,建议以10μM的EdU初始浓度进行摸索;
(4)固定:加入细胞固定液(含4%多聚甲醛)室温育30min,弃掉固定液,用洗涤液洗涤细胞3次,每次3~5min;
注:对于流式细胞仪检测,贴壁细胞胰酶消化后用培养液重悬后再固定;
(5)通透:去除洗涤液,加入通透液,室温孵育10~15min,去除通透液,用洗涤液洗涤细胞1~2次,每次3~5分钟;
(6)加Click:去除洗涤液,加入Click反应液室温避光孵育30min,吸除反应液,用洗涤液洗涤3次,每次3~5min;
(7)EdU检测:可在荧光显微镜下观察,或者使用流式细胞仪、多功能酶标仪进行荧光检测。
优缺点:
优点:
1、更简单:无需抗原抗体反应,基于小分子化学反应的检测方法简单高效,反应仅需要几分钟;
2、更灵敏:无需抗体,检测染料仅BrdU抗体的1/500,很容易扩散,即便是单个增殖细胞也能准确检测;
3、更快速:无需过夜,省却了抗原抗体反应的复杂繁琐步骤,完成整个检测周期仅需5h;
4、更准确:无需DNA变性(酸解、热解、酶解等),可有效避免变性带来的样品损伤,确保细胞核边缘清晰完整;
5、更兼容:对样品几乎无损伤,更容易与多种抗体或荧光蛋白同时标记,能够同时检测细胞其他性状特征;
6、多种染料可选,适用于各种动物细胞检测,对植物细胞亦适用。
参考文献
Buranaamnuay K. The MTT assay application to measure the viability of spermatozoa: A variety of the assay protocols. Open Vet J. 2021;11(2):251-269.
Endaya B B. Detecting Proliferating Tumour Cells for their Molecular Characterisation[J]. 2016.
