Paper reading - 03. Speech sequencing in the human precentral gyrus
Speech sequencing in the human precentral gyrus
这篇文献一直没来得及细读,关于speech sequencing的研究一直都存在一些疑问,所以通过这篇文献再一次了解speech sequencing的不同阶段以及涉及到的解刨区域
speech-motor sequencing
本文献中,作者认为语言产生过程有三个阶段:Higher level speech planning, Speech-motor sequencing, direct motor control
原文描述:“Speech-motor sequencing is an intermediate stage between higher level speech planning, involving lexical representations, and direct motor control to generate desired speech sounds.”
这是我第一次听speech-motor sequencing这个词,作者为什么觉得会有这三个阶段而不是“准备发音+发音”两个阶段,因为“语音失用症(Apraxia of Speech, AOS)” 这一临床疾病,证明 “Speech-motor sequencing” 是可独立受损的阶段(而非与其他语音加工阶段绑定):
AOS 的核心症状:患者能理解词汇、知道要发的音(即 “更高层级规划” 正常),也能控制发音器官完成单个简单动作(如单独发 “p” 或 “í”,即 “直接运动控制” 基本正常),但无法将多个发音动作按正确顺序串联 —— 导致 “发音错误随音节复杂度增加而增多”(如说单音节 “pí” 正常,说双音节 “píng” 就混乱,说多音节 “píng guǒ” 错误更严重)。
发音规划和发音涉及的解刨学区域以及有很多研究,但是Speech-motor sequencing是如何在大脑中实现的(即哪些脑区、哪种神经活动模式支持该过程),目前仍不清楚。
作者提出了“中央前回中部(mPrCG)是语音运动排序核心脑区” 的研究假设
作者如何提出假设的?我觉得这一部分的逻辑很值得学习!!!
-
文中首先梳理了当前主流 “语音感知 - 规划 - 产生模型” 的共性与分歧,为后续脑区功能讨论铺垫框架:
- 模型共性:所有模型均认同 “不同解剖脑区负责语音加工的不同环节”—— 即存在专门脑区分别支持 “感知(如聆听语音)”“规划(如词汇 / 音系目标确定)”“产生(如发音动作执行)”(参考文献 4、5、17)。
- 模型分歧:
- 串行级联模型(serial cascade)(参考文献 18):认为语音加工是 “感知→规划→产生” 的线性流程,前一环节完成后才启动后一环节;
- 并行反馈模型(parallel + feedback)(参考文献 5、19):认为 “感知、规划、产生” 存在并行激活的表征,且后一环节会向前一环节提供反馈(如发音动作的感觉信号反过来调整规划);
- 关键缺口:两种模型均未明确 “各环节的严格时间动态”(即不同脑区的活动何时启动、如何衔接),这为后续通过 “时间维度分析神经活动” 提供了研究空间。
-
核心争议点:布罗卡区(Broca’s area)的功能被重新质疑 —— 它不负责语音运动排序(speech motor sequencing)
- 最新反驳证据:
- 功能定位偏差:近年研究发现,布罗卡区实际更偏向 “更高层级的语音规划”(如词汇选择、音系目标确定),而非 “语音运动排序” 或 “发音控制”(参考文献 10、11、22、23);
- 损伤后结果不支持:布罗卡区损伤不会导致 “长期语音产生缺陷”(参考文献 24-26)—— 若其真负责语音运动排序(核心产生环节),损伤后应出现持续的发音 / 排序障碍,但实际并非如此。
- 关键问题引出:既然布罗卡区不负责语音运动排序,那么 “语音运动排序究竟由哪个脑区实现?”—— 这成为后文脑区定位的核心问题。
- 最新反驳证据:
-
线索:语音失用症(AOS)关联的其他脑区 —— 缩小核心脑区范围
文中通过 “语音失用症(AOS,语音运动排序障碍的典型疾病)的脑损伤定位”,筛选出可能负责语音运动排序的候选脑区,排除争议、聚焦关键区域:- AOS 关联的候选脑区:除布罗卡区外,AOS 还与以下脑区损伤相关:
- 岛叶(insula)(参考文献 27);
- 中央前回腹侧(vPrCG)(参考文献 28、29);
- 中央前回中部(mPrCG)(参考文献 30-33);
- 争议与聚焦:上述脑区中,“岛叶”“中央前回腹侧” 的定位证据存在较多争议(不同研究结果不一致),但中央前回中部(mPrCG)的证据逐渐清晰:
最新研究明确提出,mPrCG 中存在 “对语音运动排序有用的音系表征”(参考文献 34);且神经影像研究发现,“音节水平的语音排序加工” 会激活 mPrCG(参考文献 15、35)—— 这些证据直接指向 mPrCG 的核心作用。
- AOS 关联的候选脑区:除布罗卡区外,AOS 还与以下脑区损伤相关:
-
最终假设:中央前回中部(mPrCG)是语音运动排序的关键脑区
综合上述所有线索(模型缺口、布罗卡区功能排除、AOS 关联脑区证据),作者明确提出本研究的核心脑区假设.
妙啊妙啊~!
显著电极筛选
最近显著电极筛选一直让我非常困惑,尝试了多种筛选方法都没有合理的解决显著电极筛选的问题,阅读该文献了解到了FDR矫正,我之前使用的是Bonferroni 矫正,漏掉了许多真实的显著电极,因为Bonferroni 矫正更加严格控制假阳性的出现。尝试FDR之后终于解决了漏掉很多显著电极的问题。
筛选显著电极流程
利用这篇文献,重新梳理一下筛选显著电极的流程。
该研究通过 “非参数统计检验 + 多重比较校正” 筛选显著电极,具体步骤如下:
-
核心检验方法:采用单侧 Wilcoxon 秩和检验(non-parametric one-sided Wilcoxon rank-sum test)
实验前会先筛选合理有效的trials- 统计值计算:
- 对每个电极,分别计算 “任务相关活动的试次平均值” 和 “基线活动的试次平均值”(也就是erp),形成两组分布(任务组 vs 基线组)。
- 通过 Wilcoxon 秩和检验比较两组分布,得到每个电极在每个任务阶段的原始 p 值。
- 检验逻辑:单侧检验的原假设(H₀)为 “任务相关活动≤基线活动”,备择假设(H₁)为 “任务相关活动>基线活动”—— 仅当任务引发的神经活动显著高于基线时,该电极才被视为 “显著电极”。
- 多重比较校正:
- 采用FDR 校正(False Discovery Rate correction),对 “所有电极 ×4 个任务阶段” 的组合进行校正(控制整体假阳性发现率)。
- 校正后 p 值显著(通常 p<0.05)的电极,被判定为 “显著电极”(即该电极在对应任务阶段的神经活动显著高于基线)。
- 统计值计算:
-
基线(baseline)的定义
基线活动的选取严格控制 “无任务干扰”,具体标准:- 时间窗口:每个试次之间的 1 秒间隔(inter-trial windows)。
- 环境条件:该窗口内 “无额外噪音、无参与者发声、任务笔记本屏幕无任何内容”—— 确保基线仅反映 “纯静息状态” 的神经活动,排除感知输入或运动输出的干扰。
-
任务时间窗口定义
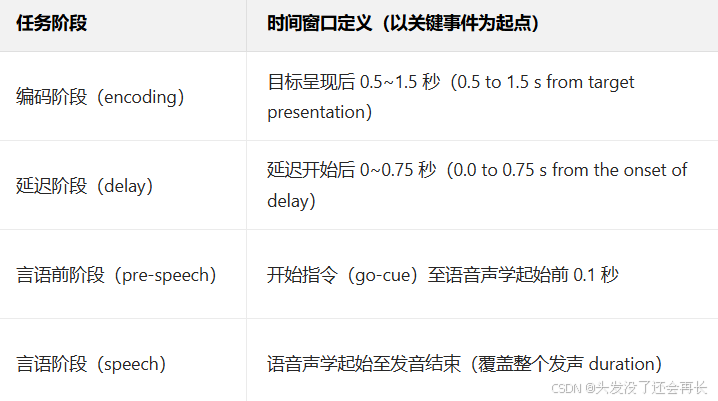
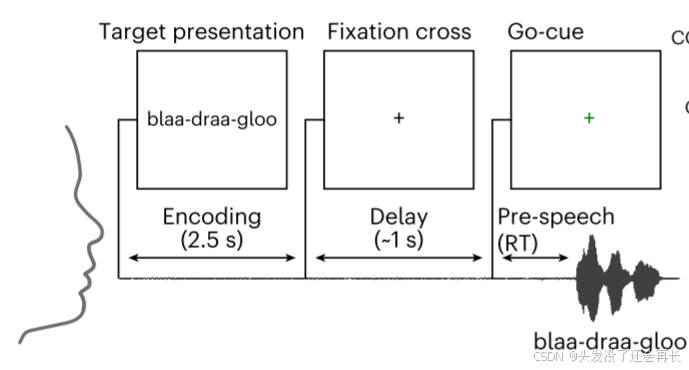
FDR矫正
这里使用的FDR 校正(False Discovery Rate correction,假发现率校正)是一种多重比较校正方法,核心目的是控制 “在多次统计检验中,错误判定为‘显著’的结果(假阳性)占所有‘显著’结果的比例”,而非像 Bonferroni 校正那样控制 “至少出现 1 次假阳性的概率(FWER)”。
为什么需要 FDR 校正?
当进行多次检验(如文中 “多个电极 ×4 个任务阶段” 的检验)时,即使所有原假设(H₀)都为真(即无真实显著效应),仅靠随机概率也会有部分检验的 p 值小于 0.05(假阳性)。例如:
若进行 1000 次检验,按 p<0.05 的标准,约 50 次会误判为显著(假阳性);
传统 Bonferroni 校正通过将阈值设为 0.05/1000=0.00005,虽能严格控制假阳性,但会大幅提高 “漏判真实显著结果” 的概率(假阴性),尤其在检验次数多、效应量小时极不友好。
FDR 校正的优势在于平衡假阳性与假阴性:允许少量假阳性存在,但确保假阳性在所有 “显著结果” 中的占比不超过预设水平(通常设为 0.05),更适用于脑科学、基因组学等需大量检验的场景(如文中的电极筛选)。
“sustained electrodes” 中单个电极的神经活动探究
作者发现了一些在四个任务种都持续活动的电极,但是这些电极分布在大脑不同区域。
作者使用聚类将这些电极分为四个cluster,这些电极存在不同的活动模式,但每种模式都不是存在单一脑区的电极,只不过每个cluster内的主导电极的解剖学区域不同
接下来分析核心是探究 “持续神经活动” 的功能意义——即这种活动是反映 “单一神经过程”(如全程维持序列信息),还是 “随任务阶段动态变化的多功能过程”。
分析方法:统计检验 + 电极分类对比
- 统计检验 —— 用 Friedman 检验 + 事后检验判断 “电极能否区分任务阶段”
目的是量化 “单个电极的持续活动在 4 个阶段是否存在显著差异”- Friedman 检验(非参数 ANOVA)
- 初步判断 “单个电极在 4 个阶段的活动是否存在整体差异”
- 对每个电极,计算其在 “4 个任务阶段” 的 HGA(高频 gamma 活动,反映神经激活强度)均值,检验这 4 组均值是否存在显著差异(即活动是否随阶段变化)
- 原假设:4 个阶段的 HGA 无差异(活动是单一功能);
- 备择假设:至少 2 个阶段的 HGA 有差异(活动随阶段变化);
- 显著性阈值:P<0.05,FDR 校正(控制多重检验假阳性)。
- 事后 Wilcoxon 符号秩检验
- 进一步定位 “哪些阶段之间存在差异”,并筛选 “能区分所有 4 个阶段的电极”
- 对 Friedman 检验显著的电极,进行 “两两阶段” 的事后比较,筛选出 “在所有 4 个阶段间均存在显著差异” 的电极
- 双侧检验(two-sided),同样用 FDR 校正;
- 目的:从 “有阶段差异的电极” 中,进一步筛选出 “差异最显著、能完整区分所有阶段” 的子集。
- Friedman 检验(非参数 ANOVA)
- 组间对比 —— 持续电极 vs 非持续电极的 “阶段区分能力” 差异
计算 “区分能力指标”:对每个电极,用 Friedman 检验的卡方统计量(chi-square statistic) 衡量其 “阶段区分能力”—— 卡方值越大,说明该电极在 4 个阶段的活动差异越显著,区分能力越强。- 统计对比:用Wilcoxon 秩和检验(two-sided) 比较 “持续活动电极” 与 “非持续活动电极” 的卡方统计量中位数:
- 检验目的:判断两类电极的 “阶段区分能力” 是否存在显著差异;
- 统计细节:P<0.001,z=4.80(强统计显著性,说明差异可靠)。
- 统计对比:用Wilcoxon 秩和检验(two-sided) 比较 “持续活动电极” 与 “非持续活动电极” 的卡方统计量中位数:
结论
- 持续活动不是 “单一功能”:大部分持续活动电极(蓝色标记)能区分至少 2 个任务阶段,部分电极(橙色三角形)甚至能区分所有 4 个阶段,说明其活动随阶段动态变化,支持 “多功能过程”(编码→维持→运动准备→执行的功能转换)。
- 持续电极的 “功能动态性” 更强:持续电极的卡方统计量中位数显著高于非持续电极,说明其在 “适应不同任务阶段需求” 上的能力更突出,这可能是持续活动的核心功能价值。
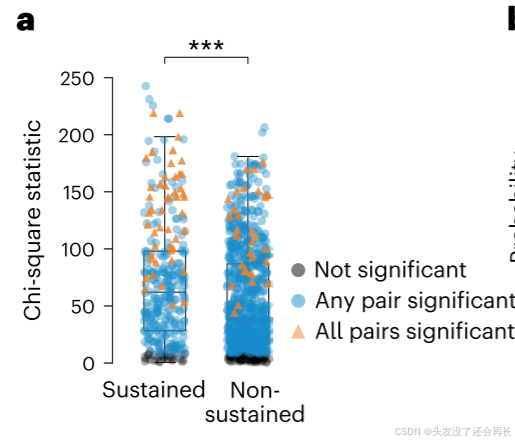
“sustained electrodes” 的群体水平的神经活动探究
既然大多的单电极无法准确区分四个任务,这种 “单个电极能力不足” 是否是因为 “信息分散在多个电极中”?那群体水平的电极是否能区分四个任务呢?
实验设计
作者使用了最常用的数据解码范式,训练了一个logistic regression分类器取预测不同阶段的活动。但是可视化的结果具有参考意义
可以参考:
- 统计所有持续活动电极的HGA强度,计算mean erp。每个时间窗口对应的时间点都会有一个阶段标签(0-4)
- 使用所有电极的活动作为输入训练分类器,优化目标就是,最小化 “预测阶段标签” 与 “真实阶段标签” 的交叉熵损失
- 训练完成后,用测试集验证分类器性能,并通过 “概率时间序列” 可视化解码结果
结果
作者得到了四个阶段的解码概率随时间变化的曲线,展示了分类器如何根据任务进程预测阶段。直观反映 “分类器能否跟随任务进程动态预测阶段”—— 概率变化与任务阶段切换高度同步。
支持 “持续活动的多功能性”:群体解码能准确区分 4 个阶段,说明持续活动的群体模式随阶段动态变化,进一步佐证 “持续活动不是单一功能,而是服务于不同阶段的多功能过程”。
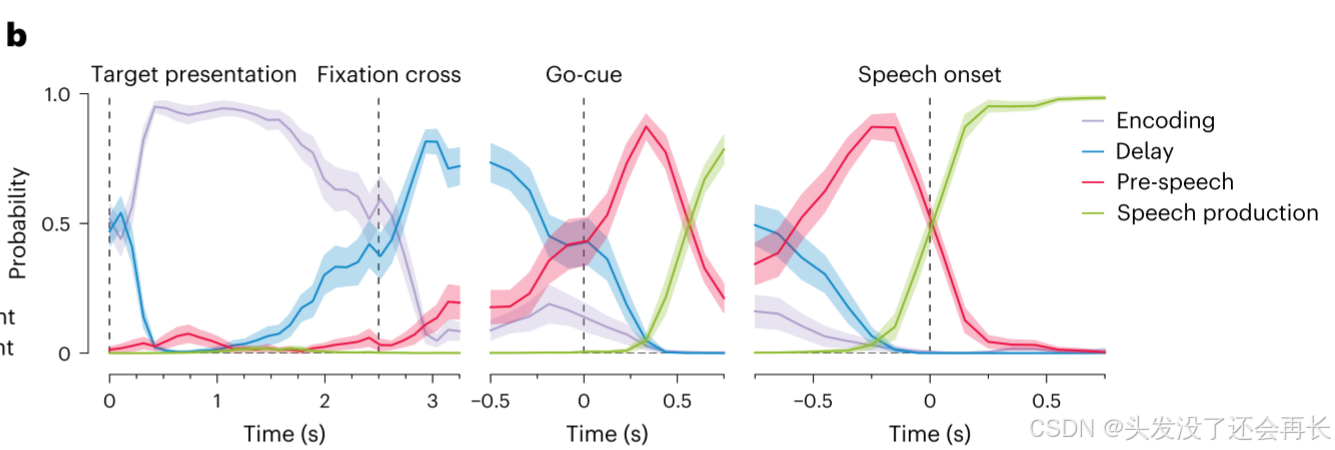
除此之外,作者也统计了不同解刨学区域的解码准确率对比,以及持续电极和非持续电极的解码准确率对比,最后发现,The ==mPrCG == was found to have the closest accuracy relative to that when using all sustained electrodes (closely followed by the vPrCG)。也就是说mPrCG的持续电极可能在解码种占主导地位的电极。
“sustained electrodes” 的表征空间探究
既然前面证明了,持续活动的电极确实能够区分不同任务,那这些电极在不同任务阶段是否反映相似的神经过程,还是独立的processing?也就是说,这些电极再不同任务中的神经表征是否独立?是否存在独立的表征空间?
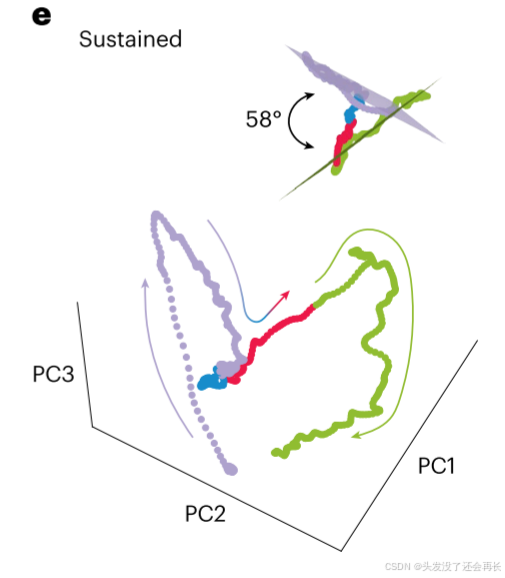
实验设计—— “PCA 降维 + 状态空间轨迹分析”
轨迹与表征的关系:在低维状态空间中,“不同阶段的持续活动” 会形成 “时间轨迹”—— 若轨迹位置可区分、且对应不同的 “表征平面”,则说明阶段间的神经加工过程是独特的;若轨迹重叠或共享平面,则说明加工过程相似。
- 数据预处理 —— 提取 “试次平均的持续活动数据”
- 这一步就是针对每个持续活动的电极,计算所有试次在单个电极上的mean HGA,最终得到 时间点x电极数 的2维矩阵
- PCA 降维 —— 构建 “低维神经状态空间”
- 将上一步得到的2维矩阵降维,选择前3个主成分——解释了82.7%的方差
- 降维后的数据变成 时间点x3 的低维矩阵
- 绘制 “阶段轨迹”—— 观察状态空间中的阶段差异
- 将不同任务阶段的 “神经状态点” 按时间顺序连接,形成 “阶段轨迹”
- 拟合 “表征平面”—— 量化阶段轨迹的空间独立性
3 维空间中,一条连续轨迹可被近似为 “2 维平面内的曲线”(若轨迹复杂度低);拟合的平面代表 “该阶段持续活动的核心表征空间”;用 “调整后 R²” 评估平面拟合优度 ——R² 越接近 1,说明轨迹越贴近平面- 平面关系计算:计算两个拟合平面的 “夹角”—— 这是判断表征是否独立的关键指标:
- 正交平面(夹角 90°):代表两个阶段的表征空间完全独立(加工过程无重叠);
- 平行平面(夹角 0°):代表两个阶段的表征空间完全共享(加工过程相似);
- 平面关系计算:计算两个拟合平面的 “夹角”—— 这是判断表征是否独立的关键指标:
- 对不同解剖学区域的电极做同样的分析,并拟合到同一个平面内
结果
最后得到拟合和平面如下图,可以看到encoding(紫色)和speech production(绿色)两个阶段产生的轨迹是位于两个不同的平面的,且编码期平面 R²=0.96,产生期平面 R²=0.86,均接近 1,说明拟合有效;两条曲线夹角 58.4°,更接近正交(90°)而非平行(0°),说明表征空间是独立的而非完全共享。
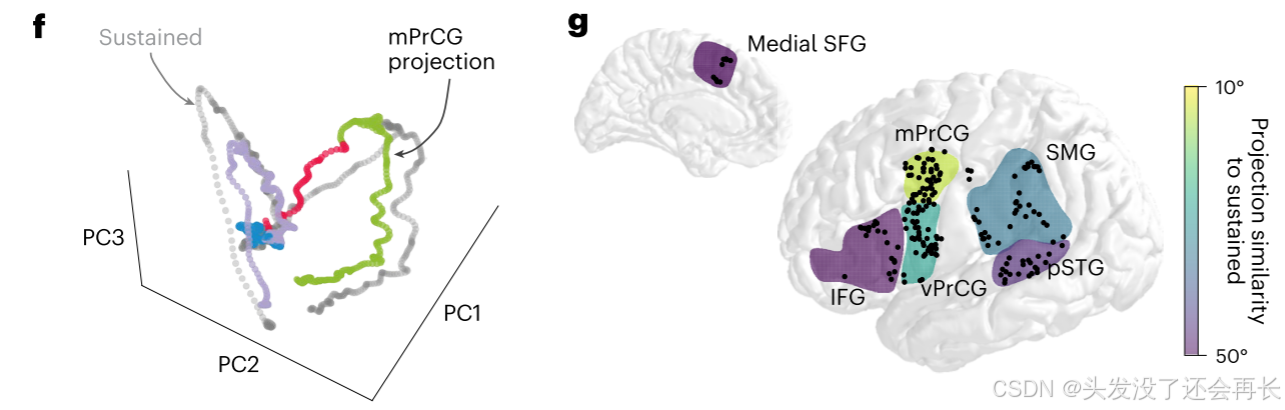
第五步的结果可以得出结论:
- mPrCG 是持续活动网络的核心脑区:
mPrCG 的持续活动轨迹与全脑轨迹高度相似(平面拟合 R²≈0.97,夹角最小),且在 “阶段区分能力” 上与全脑网络一致 —— 说明 mPrCG 能代表整体持续活动网络的功能,是网络中的 “关键节点”; - 持续活动的动态性反映 “跨阶段功能转换”:
全脑与 mPrCG 的轨迹在不同阶段分布在不同平面,且随任务进程平滑切换 —— 证明持续活动不是 “重复同一过程”,而是随 “刺激感知→计划→执行” 的阶段转换动态调整,服务于跨阶段的功能衔接;
先读到这里,消化一下,这篇文献里面的PCA分析方法是我第一次看到使用平面轨迹来证明不同阶段任务的表征空间相似性,为我的研究提供了性的视野。
