《人形机器人的觉醒:技术革命与碳基未来》——生物混合肌肉:技术原理和进展、比较优势和不足、材料技术要求及材料限制
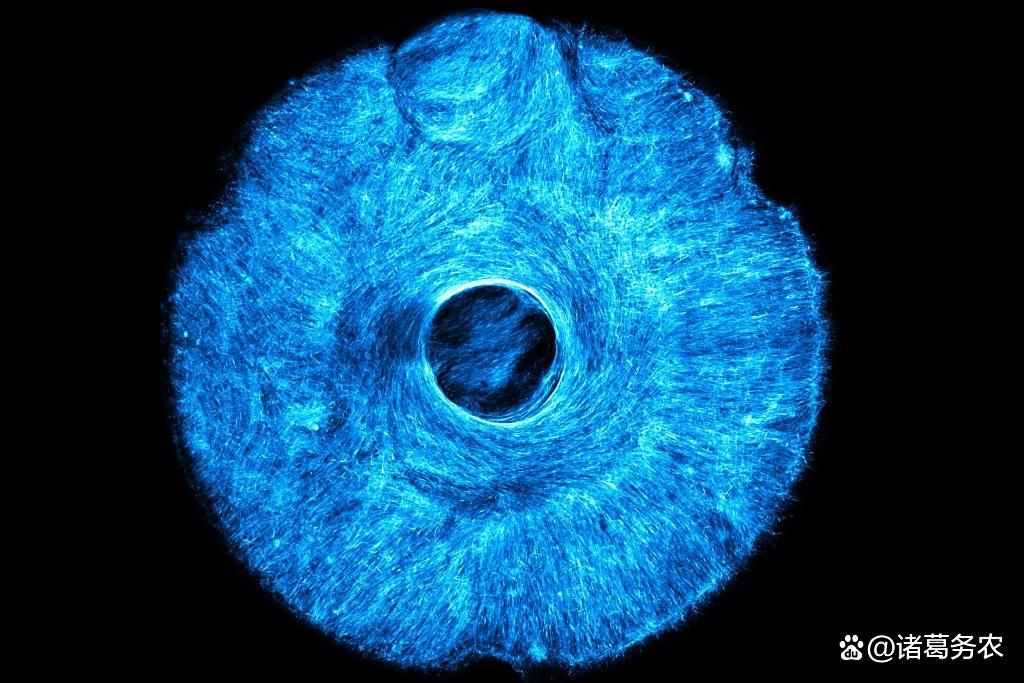
可以向心径向拉动模拟眼球扩缩人工肌肉
一、生物混合肌肉技术原理和开发进展
(一)技术原理
1. 肌肉组织工程基础
支架设计:采用合成聚合物(如PCL、PLGA)或天然材料(胶原蛋白、纤维蛋白)构建3D微环境,通过静电纺丝、3D生物打印等技术模拟细胞外基质(ECM)结构,引导肌纤维定向排列。
细胞来源:以人体成肌细胞、诱导多能干细胞(iPSCs)为主,辅以共培养系统(如与神经元、血管细胞协同)提升组织成熟度28。
外部刺激优化:电刺激,20Hz强直刺激(tetanus stimulation)可提升肌肉环收缩力至2.6mN,接近胎儿骨骼肌水平(4.6mN/mm²);机械训练,生物反应器施加多轴应力(如拉伸、剪切)促进肌管成熟,硬度8-17kPa的基底最利于肌节排列。
2. 收缩力增强策略
结构创新:肌肉环(Muscle Rings),减少ECM体积(从17.5μl降至4.3μl)并增加成肌细胞密度,结合高刚度(1-3MPa)柱状支撑,提升力传导效率;多肌肉组织驱动器(MuMuTA),将细长肌肉纤维束卷成“寿司卷”结构,解决营养渗透问题,实现8mN收缩力与4mm收缩距离。
界面工程:C形锚定结构表面涂覆MPC聚合物,降低肌肉-锚点界面摩擦,弯曲角度提升2倍。
3. 力-运动转换机制
仿生传动:通过3D打印骨架与线驱动系统(类似人体肌腱),将肌肉线性收缩转换为关节旋转(如手指弯曲130°)。
多自由度控制:麻省理工团队开发STAMP技术(微地形图案化),在人工虹膜中集成放射状与同心圆肌肉纤维,实现瞳孔状多向收缩。
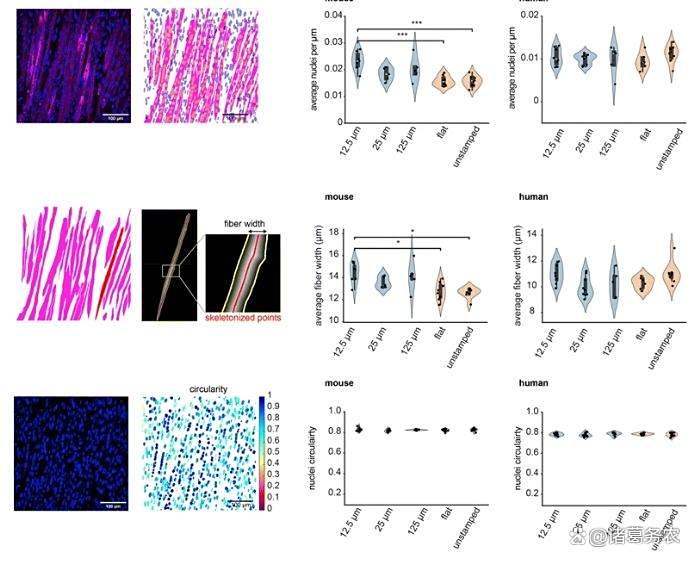
STAMP对肌肉成熟和纤维形态的影响
(二)开发进展与代表性成果
1. 尺寸与运动复杂度突破
18cm生物混合机械手(东京大学 & 早稻田大学):全球最大尺寸,五指独立驱动,通过MuMuTA执行抓取移液器吸头、剪刀手等精细动作。连续工作30分钟出现疲劳,1小时休息后恢复,模拟真实肌肉特性。
多关节机器人系统:夹持型机器人,三单元肌肉环串联,抓取直径1cm物体;蠕动型机器人,三对拮抗肌肉环堆栈(每栈4环),10秒前进8.8mm。
2. 驱动性能优化
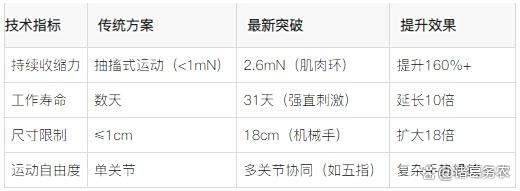
生物混合肌肉驱动性能优化
3. 跨学科融合应用
假肢开发:MuMuTA驱动器为高精度仿生假肢提供无需外部电源的驱动方案。
药物测试平台:人源肌肉组织响应药物特性与生物体相似,可实时监测收缩力变化评估药效。
软体机器人:强直刺激驱动的肌肉环替代传统电机,实现柔性抓取与适应性运动。
(三)总结:技术挑战与未来方向
1. 核心瓶颈
血管化与营养供给:大尺寸肌肉内部仍易坏死,需开发仿血管微通道或灌注系统。
自主控制缺失:依赖外部电刺激(如防水电极),未来需集成光遗传学或神经接口实现意念驱动。
回弹机制不足:手指弯曲后依赖浮力复位,需引入弹性材料或拮抗肌设计(如伸肌)。
2. 前沿探索方向
体内-体外融合:植入式生物混合装置(如与人体神经融合的义肢)。
智能材料迭代:自愈合水凝胶、光响应聚合物提升耐用性与刺激多样性。
AI驱动控制:结合深度学习优化多关节运动协调性,适应复杂环境任务。
3. 小结
生物混合肌肉技术通过组织工程革新(如MuMuTA、肌肉环) 与跨学科协同(机器人学+生物学),正突破尺寸、力量与寿命限制,从实验室演示迈向医疗假肢、药物测试及柔性机器人等实用场景。未来需在长效存活、神经融合、能源自主化等方向持续突破,以实现人机共生愿景。
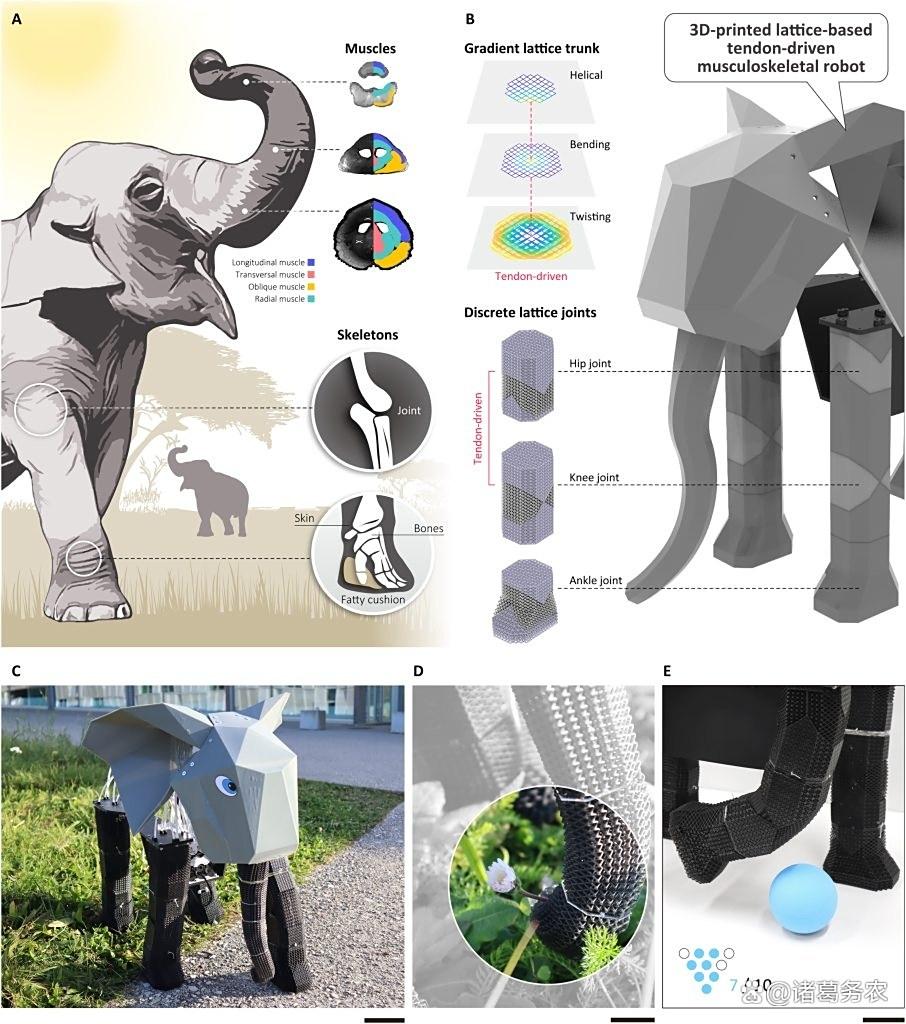
单一材料来模拟肌肉和骨骼的机械复杂性
二、生物混合肌肉在人形机器中的应用优势与不足及发展趋势
(一)核心优势
1. 高能量效率与仿生运动
肌肉组织的能量转换效率(化学能→机械能)可达40%,远超电机(通常<20%)。收缩应变率达40%,可模拟人类肌肉的柔顺运动(如手指弯曲130°),避免传统机械的刚性冲击。
2. 环境适应性
生物材料具备自调节特性:东京大学的MuMuTA驱动器在4-37℃环境下保持功能,室温时收缩力接近生理温度水平。对非结构化环境(如不平地面、柔性物体)的适应性优于纯机电系统。
3. 生物相容性与感知潜力
人源成肌细胞构建的肌肉组织可减少植入式设备的排异反应,为未来人机融合奠定基础。肌肉本身可作为生物传感器,实时反馈力度和疲劳状态,提升控制精度。
增强型生物质凝胶人工肌肉
(二)关键不足
1. 营养供给与血管化瓶颈
肌肉尺寸>1cm时,内部细胞因缺氧/缺营养易坏死(东京大学通过“寿司卷”设计MuMuTA缓解此问题,但仅限厘米级)。目前依赖外部培养基,无法实现长期自主供能。
2. 控制精度与响应延迟
电刺激需精确参数(如1.5V/mm电场+600ms脉冲),且存在0.5-1秒响应延迟,难以匹配高速动作需求。多关节协同时易受串扰影响(嵌入式X电极将选择性指数提升至0.96,但位移仅0.45mm)。
3. 寿命与耐久性限制
强直刺激下最长工作寿命为31天(肌肉环),而东京大学的机械臂肌肉可维持178天但收缩力持续衰减。缺乏高效回弹机制,手指弯曲后需依赖浮力或外部材料复位,影响连续运动。

可灌注微通道网络生物打印骨骼肌组织
(三)技术进展(2024-2025)
1. 尺寸与力量突破
18cm人形机械手(东京大学):MuMuTA驱动器将8条人肌纤维卷成“寿司卷”,收缩力达8mN,支持五指独立运动,可完成抓取吸管、剪刀手势等任务。
肌肉环增强系统:通过减少ECM体积(17.5μl→4.3μl)和优化支撑刚度(1-3MPa),收缩力提升至2.6mN,接近胎儿肌肉水平(4.6mN/mm²)。
2. 运动控制创新
拮抗肌设计:蠕动机器人采用三对肌肉环堆栈,实现双向运动(10秒前进8.8mm)。
仿生传动:3D打印中空指骨+人造肌腱,将线性收缩转化为多关节旋转(如130°手指弯曲)。
3. 材料与制造升级
洛桑联邦理工学院(EPFL):单一弹性树脂通过晶格拓扑调控(杨氏模量25-300kPa),模拟肌肉-骨骼系统,支撑4kg负载。
波兰Clone Robotics:McKibben液压人造肌肉+500W电动泵“心脏”,驱动200自由度双足机器人行走。
(四)未来趋势
1. 长效化与智能化
血管仿生通道:微流控技术模拟毛细血管网,解决大尺寸肌肉营养供给。
光遗传/神经接口:替代外置电极,实现意念控制(如将运动皮层信号直接转换为肌肉刺激)。
2. 应用场景拓展
医疗优先:假肢(如MuMuTA驱动的无电源义肢)、肌肉疾病模型构建(实时监测药物响应)。
家庭与工业:结合具身智能(如VLA模型),从单一任务(物流分拣)向多任务(家务、陪护)演进。
3. 产业生态协同
成本下降:人形机器人价格将从60万+降至10-20万区间(如特斯拉Optimus目标成本<2万美元)。
模块化设计:生物混合单元(如肌肉环)与谐波减速器、行星滚柱丝杠等机电部件集成,提升通用性。
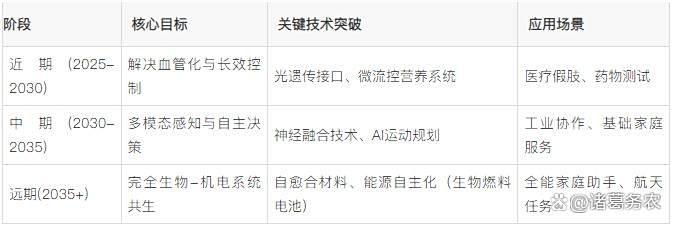
生物混合肌肉人形机器人发展阶段趋势
(五)小结
生物混合肌肉凭借类人运动柔顺性与高效能量转换,成为人形机器人突破刚性驱动瓶颈的关键路径。当前在尺寸(18cm机械手)、力量(8mN收缩力)及寿命(178天)上取得突破,但仍受限于血管化缺失与控制延迟。未来将向神经融合自主控制、仿生血管集成及低成本模块化发展,推动人形机器人从实验室走向医疗康复与家庭服务场景。
一种人造肌肉材料的制备过程
三、生物混合肌肉涉材料技术进展及与限制
生物混合肌肉技术通过融合活体细胞与合成材料,旨在模拟天然肌肉的驱动特性,但其性能高度依赖于材料技术的创新。
(一)生物混合肌肉涉及的核心材料技术
1. 生物墨水与支架材料
天然高分子水凝胶:海藻酸钠-羧化壳聚糖通过静电交联形成双性凝胶,提供仿生ECM环境,但力学强度不足(需添加纳米增强相)。
光交联改性材料:甲基丙烯酰化明胶(GelMA)搭配羟基磷灰石(HAP)纳米粒子,通过UV固化实现多层骨骼肌打印(如仿生骨/肌纤维膜),支撑细胞定向排列。
牺牲材料技术:Pluronics温度响应牺牲墨水用于构建可灌注微通道(直径200μm),解决厘米级肌肉内部营养输送问题。
2. 导电与驱动增强材料
MXene掺杂海藻酸钠提升导电性(替代易氧化金属电极);透明质酸修饰金纳米颗粒(HA-AuNPs)嵌入肌肉束,增强电信号传导及分化效率,驱动应变提升40%。
3. 纳米导电材料:
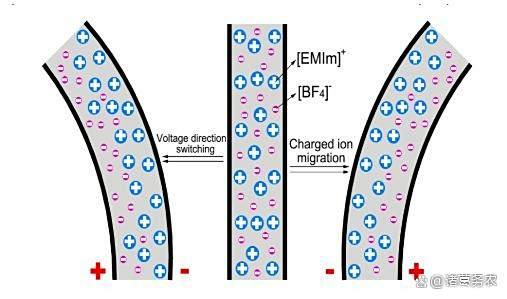
离子液体改性:海藻酸钠掺杂[EMIm][BF4]离子液体,通过多孔离子通道提升机电响应速度与稳定性。
4. 仿生结构材料
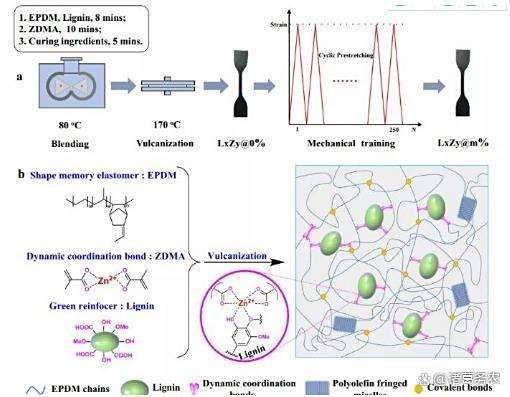
自增强合成弹性体:EPDM-木质素-Zn²⁺配位网络经机械训练(预拉伸600%)后,模量从2 MPa增至33 MPa,实现J形应力-应变曲线,匹配骨骼肌应变硬化特性。
生物-非生物界面材料:低熔点合金(LMPA)填充X形锚定结构,实现3mm间距内高选择性电刺激(SSI=0.96)。
5. 活体-合成融合技术
微藻赋能肌肉(MAM):莱茵衣藻(C. reinhardtii)与C2C12成肌细胞共培养,通过光合作用原位供氧,收缩力提升3倍。
细胞改造基底:镀金洋葱表皮细胞利用不对称电极实现双向弯曲,但需氟化涂层防水以延长寿命。
(二)当前材料技术的不足与限制
1. 血管化与营养供给缺陷
现有微通道(如GelMA-海藻酸盐墨水)仅支持≤1cm肌肉存活,>1cm时内部细胞坏死率>60%。依赖外部培养基灌注,缺乏仿生血管网络的主动输送机制,限制长效运行(最长仅31天)。
2. 界面稳定性与力传导效率低
水凝胶-电极界面易剥离(如MXene/海藻酸钠电极经1000次弯曲后电阻增加300%)。肌肉-锚点力传导损耗>40%,传统柱状电极位移衰减显著(5cm肌肉仅产生270μm位移)。
3. 驱动性能与耐久性瓶颈
合成弹性体自增强需预训练(600%应变),过程耗时且不可逆。生物组分(如C2C12细胞)在电刺激下易疲劳,收缩力1小时内衰减50%。
4. 制造兼容性差
多材料生物打印中,GelMA与牺牲墨水(Pluronics)交联温度窗口窄(±2℃),易堵塞喷嘴。
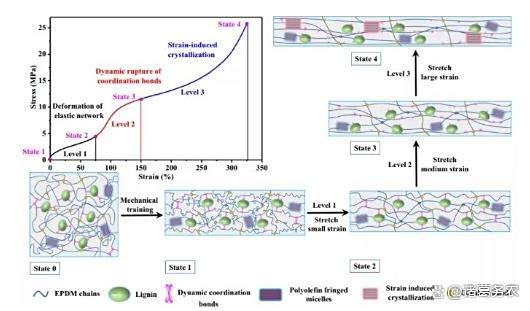
人造肌肉机械训练自增强机理示例
(三)理想材料与技术的关键性能特征
1. 多尺度灌注能力
仿血管微通道:需具备分级网络(主通道>200μm + 毛细血管<50μm),支持对流-扩散协同输运,目标:5cm肌肉核心区氧分压>10%。
自供能代谢系统:集成光合微藻或生物燃料电池,实现葡萄糖/O₂原位生成。
2. 智能响应与稳定性
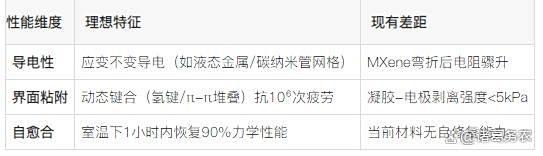
生物混合肌肉智能响应与稳定性差距
3. 类生物机械性能
应变自适应:J形应力-应变曲线(小应变模量0.1-1 MPa → 大应变模量30-50 MPa),匹配人体骨骼肌。
双向驱动:拮抗肌构型(如嵌入式X电极)+ 快速回弹材料(介电弹性体),实现毫秒级复位。
4. 制造与集成友好性
4D生物打印:水凝胶墨水需兼具剪切变稀(粘度10-100 Pa·s)与快速光固化(<30s)特性。
模块化接口:标准化锚定接口(如C形扣+MPC涂层),支持肌肉单元即插即用。
(四)总结:材料技术发展路径
生物混合肌肉的突破依赖于 “血管化材料”、“智能界面” 与 “类生命代谢系统” 三者的协同创新:
近期(2025-2030):开发光固化微流道生物墨水(如GelMA-HA复合体系),结合导电水凝胶涂层(如PEDOT:PSS/MXene),解决厘米级肌肉存活与电刺激效率问题。
远期(2030+):推动光合-合成杂化系统(微藻+生物燃料电池)与神经接口集成,实现能源自主与意念控制,最终应用于人形机器人及植入式医疗设备。
生物混合肌肉的材料技术已从单一仿生走向“活体-合成”深度融合,唯有突破 血管化、界面衰变 和 能量自主化 三大瓶颈,方能实现从实验室奇观向产业革命的跨越。
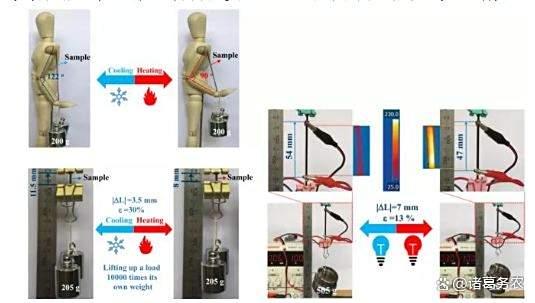
生物混合肌肉热控和电控可编程制动性能
【免责声明】本文主要内容均源自公开信息和资料,部分内容引用了Ai,仅作参考,责任自负。
