Co-IP—验证蛋白互作的不二之选
蛋白互作在细胞生命活动中起着至关重要的作用,并在不同的时空层面上参与多种细胞活动,因此研究蛋白互作对于理解分子调控网络至关重要。而在植物中筛选到潜在的互作蛋白后,大多数情况下,获得表达两种蛋白的稳定转化植株费时又费力。在这种情况下,如果不需要非常严格地在植物体内研究两个蛋白的互作的话,大家可以考虑一种瞬时表达系统来快速表达目的蛋白并检测蛋白互作。目前,最常用且较稳定的植物瞬时表达系统是用含有表达假定相互作用蛋白质粒的农杆菌(Agrobacterium tumefaciens)菌株混合物注射本氏烟草叶片(Hirsch et al., 2009; Fernández-Bautista et al., 2017; Muñoz et al., 2017)。一旦植物蛋白被瞬时表达,即可采用免疫共沉淀(Co-immunoprecipitation, Co-IP)(Takahashi, 2015)方法检测互作。
原理简介
免疫共沉淀(Co-IP)是以抗体和抗原之间的专一性作用为基础的用于研究蛋白质相互作用的经典方法,是确定两种蛋白质在完整细胞内生理性相互作用的有效方法。
其原理是使用靶蛋白特异性抗体间接捕获与特定靶蛋白结合的蛋白来鉴定体内相关的蛋白-蛋白相互作用,是研究蛋白质互作的经典方法。特异性抗体捕获样品中的靶蛋白,形成抗体-靶蛋白复合物,然后利用能够与抗体结合的珠状支持物(例如Nanoab-Agarose)来固定和沉淀复合物,同时与靶蛋白相互作用的蛋白也会被沉淀下来,最后洗去与靶蛋白相结合的非特异性蛋白,再通过SDS-PAGE进行分析、Western blot检测得到我们要验证的结果。因此,Co-IP的实验步骤可大致概括为以下4步:(1)裂解蛋白,得到蛋白的混合物;(2)将靶蛋白的抗体与蛋白混合物共同孵育;(3)洗脱,得到拉下来的蛋白;(4)再将拉下来的蛋白当作样本,用其互作蛋白的抗体进行检测。
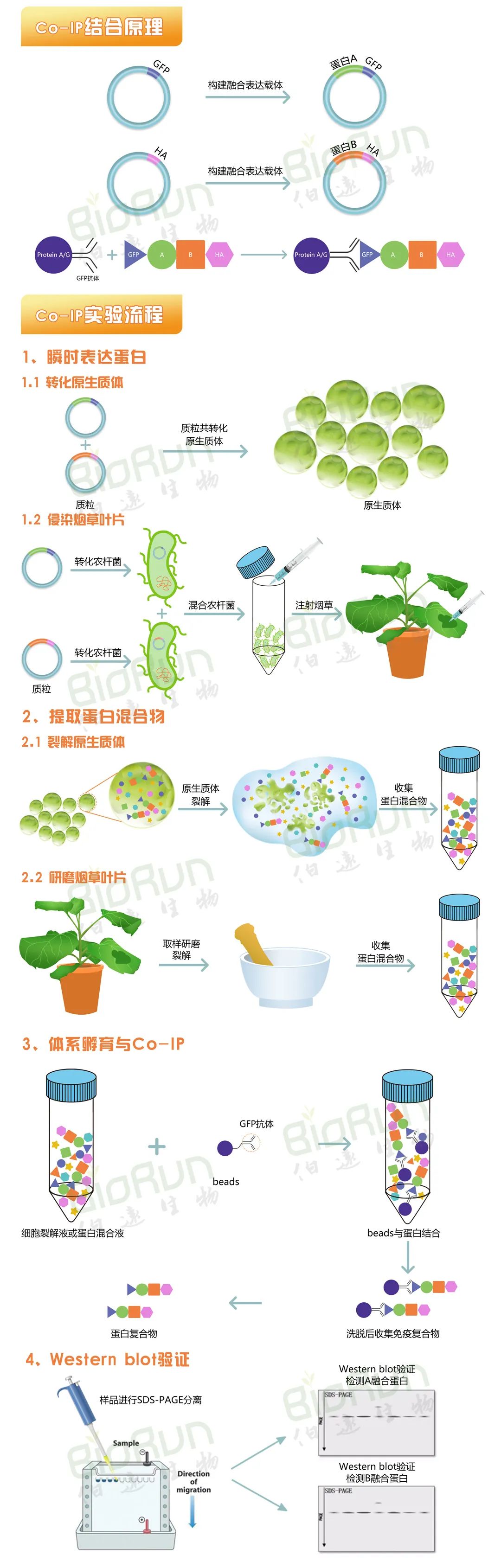
图1 Co-IP实验原理及流程(伯远生物科研绘图)。
Co-IP结果如何看?
虽然了解过Co-IP的原理,但是很多小伙伴在看文献的时候表示仍然看不懂Co-IP的结果图,针对这个问题,小远在之前的文章中有介绍过一些。今天就再给大家简单举例说明一下,强化大家对Co-IP的理解,如果大家想了解更多内容可以阅读小远发布的往期文章:Co-IP与信号通路研究、Co-IP以及IP-MS相关实验问题解惑,相信大家看完会有不一样的收获哦!
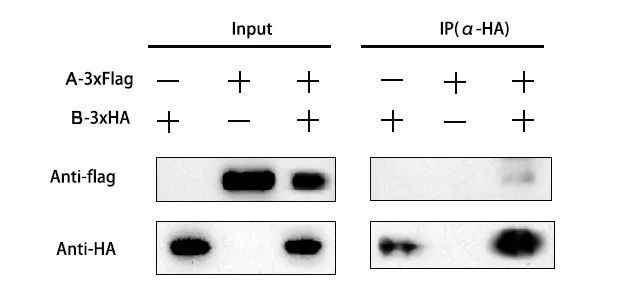
图2 验证蛋白A与B是否存在相互做用(我司项目案例)。
该图为验证A蛋白与B蛋白之间是否存在相互作用的结果图。从图中可以得到,A蛋白带有Flag标签,B蛋白带有HA标签;该Co-IP实验被分为三组,第一组为B-3×HA蛋白,第二组为A-3×Flag蛋白,第三组包括A-3×Flag蛋白和B-3×HA蛋白;图中共有两组胶图,分别是Input组和IP(α-HA)组。基本情况了解后,开始进行具体的分析:
首先观察Input组,第一块胶图是利用Anti-Flag检测Flag标签,结果显示第二泳道和第三泳道均检测到条带,说明第二组和第三组实验都存在A-3×Flag蛋白;第二块胶图是利用Anti-HA检测HA标签,结果显示第一泳道和第三泳道均检测到条带,说明第一组和第三组实验都存在B-3×HA蛋白。
随后观察IP(α-HA)组,该组第二块胶图表示的是利用Anti-HA对B-3×HA蛋白进行沉淀,结果显示第一泳道和第三泳道均检测到条带,说明第一组和第三组实验的B-3×HA蛋白均被沉淀下来了。第一块胶图表示的是在IP(α-HA)的基础上进一步利用Anti-Flag检测Flag标签,结果显示第三泳道有条带,说明B-3×HA把A-3×Flag蛋白共沉淀下来了。说明B-3×HA蛋白可以与A-3×Flag蛋白相互作用,由此可得到结论:A蛋白可以与B蛋白存在相互作用。
小远叨叨
为了帮助大家更好的理解实验结果图,小远在这里对Co-IP实验结果图中常出现的一些名词进行一个解释。
Input:假设要验证蛋白A和蛋白B相互作用,那么前提是我们提供的细胞裂解液里要有蛋白B和蛋白A,如果没有,那这个实验就没有意义了。那怎么证明细胞裂解液里有蛋白A和B呢?很简单,直接取细胞裂解液做蛋白A和蛋白B的WB,验证细胞裂解液中确实是有蛋白A和蛋白B就可以了。该过程一般标注Input,也称为阳性对照。
IB:IB即免疫印迹(Immunoblotting),其实可以理解为与Western blot一个意思,就是把分离好的蛋白转移到膜上然后用相应的抗体对其进行检测的方法。
IP:IP即免疫沉淀(Immunoprecipitation),是指利用抗体可与抗原特异性结合的特性,将抗原(常为靶蛋白)从混合体系沉淀下来。
Co-IP:Co-IP即免疫共沉淀(Coimmunoprecipitation),是一种在体外检测两个蛋白分子间是否存在特异性相互作用的一种方法。如果两个蛋白在体外能够发生特异性相互作用,那么当用一种蛋白的抗体进行免疫沉淀时,另一个蛋白也会被同时沉淀下来。
Co-IP的应用
了解完Co-IP的实验原理以及Co-IP结果图如何看之后,接下来就和伯小远一起看看Co-IP在研究过程中的具体应用吧!
>>>>
案例一
2021年10月14日,何祖华教授团队在Cell杂志上发表了题为:Ca2+ sensor-mediated ROS scavenging suppresses rice immunity and is exploited by a fungal effector的研究论文,该研究揭示了水稻钙离子新感受子ROD1如何精细调控水稻免疫,降低水稻因广谱抗病而引发的生存代价,平衡水稻抗病性与生殖生长和产量性状的分子机制。在该论文中,作者为了阐明ROD1介导的免疫抑制的分子机制,首先以ROD1为诱饵,利用酵母双杂交(Y2H)筛选出了可能与ROD1相互作用的蛋白。然后利用Co-IP进行点对点验证了ROD1与两个E3泛素连接酶APIP6、RIP1的互作关系(图3)。CO-IP结果显示,APIP6和RIP1均可以把ROD1蛋白共沉淀下来了。说明ROD1蛋白可以与APIP6或RIP1蛋白存在相互作用。

图3 通过本氏烟叶片中的免疫共沉淀(Co-IP)检测ROD1与RIP1和APIP6的相互作用(Gao et al., 2021)。由于全长RIP1和APIP6蛋白在植物中的不稳定性,因此使用缺少RING结构域的截短版本进行相互作用测定。
此外,通过Y2H还筛选到了一种过氧化氢酶CatB,为了确定ROD1与CatB存在互作关系,作者同样使用Co-IP的方法来验证互作关系(图4)。从结果图中可以看出,ROD1能够与CatB进行互作。
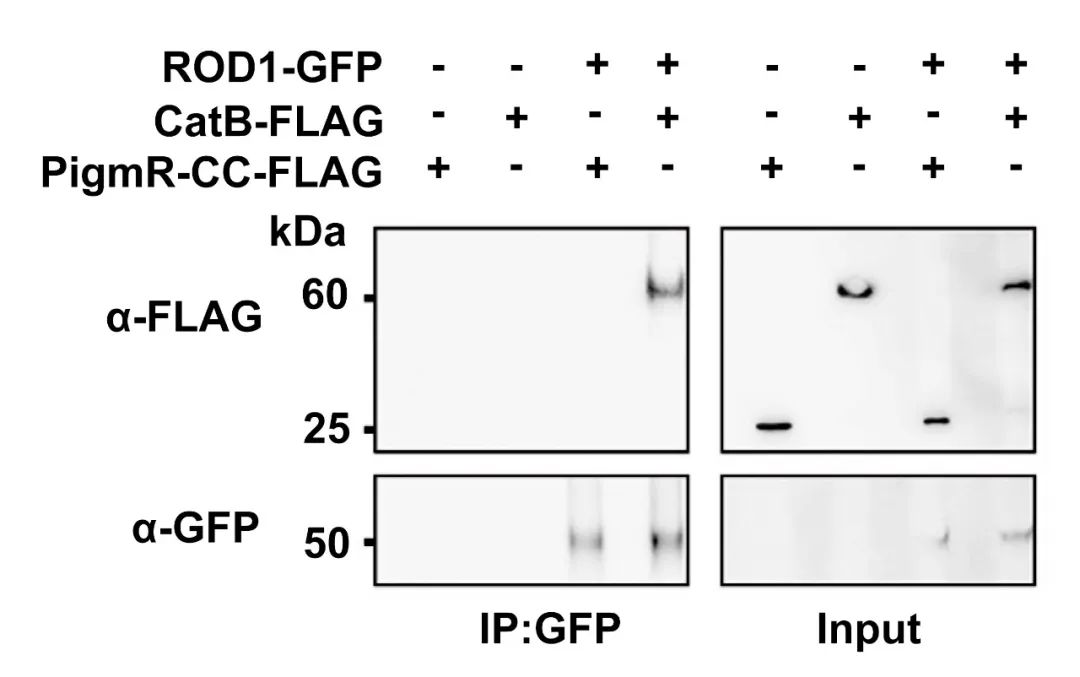
图4 通过Co-IP检测到ROD1与CatB相互作用(Gao et al., 2021)。NLR蛋白PigmR(PigmR-CC)的卷曲螺旋(CC)结构域不与CatB相互作用,作为阴性对照。
总结:从这个案例中,我们可以了解到,在日常的研究过程中,通过酵母双杂筛库获得目的蛋白的潜在互作蛋白后,可以通过Co-IP来进一步验证蛋白与蛋白的相互作用。
>>>>
案例二
2018年12月4日,朱健康教授团队在PNAS上发表了题为:Leucine-rich repeat extensin proteins regulate plant salt tolerance in Arabidopsis的研究论文,该研究发现特异性细胞壁结构蛋白(LRXs),小肽(RALFs)和质膜定位受体样激酶(FER)可作为协调细胞壁完整性、植物生长和盐胁迫反应的信号通路。在该论文中,作者为了研究LRX蛋白在生长调控和耐盐性中的作用机制,使用35S::LRX3-YFP-HA、35S::LRX4-YFP-HA和35S::LRX5-YFP-HA转基因植物进行了免疫沉淀-质谱(IP-MS)分析,以确定LRXs的潜在相互作用蛋白。同时以表达35S::GFP的转基因植株作为对照。结果发现,在LRX转基因植物的IP-MS样本中鉴定出了4个系统发育相关的RALF多肽:RALF22、RALF23、RALF24和RALF31,但在对照样本中没有发现。作者利用荧光素酶互补实验证实了LRX3和LRX4与所有这四种RALF肽的相互作用,Co-IP测定则进一步证实了LRX3和LRX4的LRR结构域(命名为LRR3和LRR4)与RALF22和RALF23的相互作用。
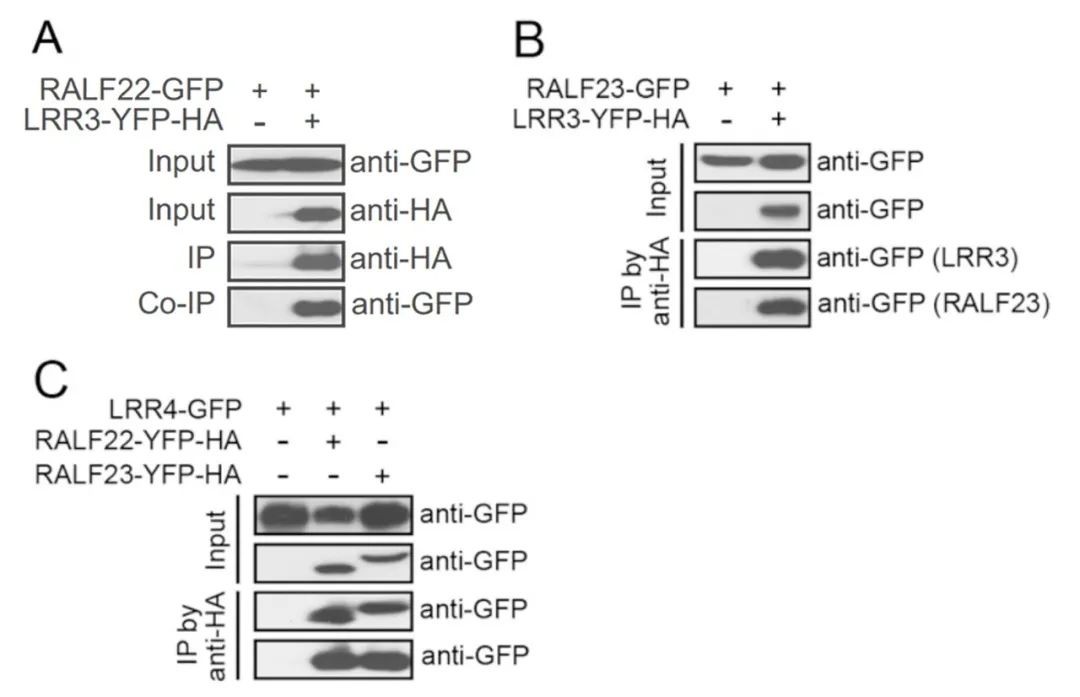
图5 用Co-IP检测LRR3和LRR4与RALF22和RALF23的相互作用(Zhao et al., 2018)。(A)显示LRR3和RALF22相互作用的免疫共沉淀结果;(B)显示LRR3和RALF23相互作用的免疫共沉淀结果;(C)显示LRR4和RALF22或RALF23相互作用的免疫共沉淀结果。
总结:从这个案例中我们可以了解到,在寻找一个蛋白的未知互作蛋白时,大家除了想到酵母双杂筛库的实验之外,IP-MS也是我们应该想到的方法。相比与酵母双杂筛库,IP-MS筛选的是天然状态下的蛋白互作,在一定程度上更能反应生物体内的真实情况,并且不用担心诱饵蛋白会存在自激活作用。因此,以后在研究一个未知蛋白的互作蛋白时可以首先考虑IP-MS哦!另外,大家如果想了解更多关于IP-MS的内容,可以查阅小远的往期文章:筛选目的蛋白的互作蛋白方法之IP-MS、你还在小瞧质谱吗?
案例三
2019年4月15日,He等人在Plant Physiology上发表了题为:Mitochondrial Pyruvate Carriers Prevent Cadmium Toxicity by Sustaining the TCA Cycle and Glutathione Synthesis的研究论文,该研究揭示了线粒体丙酮酸载体(MPC)通过维持TCA循环和谷胱甘肽合成来预防镉的毒性。在该论文中,作者通过查阅前期研究资料发现,MPC1可以与哺乳动物中的MPC2以及酵母中的MPC2或MPC3形成蛋白质复合物(Bricker et al., 2012; Herzig et al., 2012),为了研究MPC如何在植物中相互作用并发挥功能。作者首先用双分子荧光互补(BiFC)来测定AtMPC1与AtMPC2或AtMPC3之间的相互作用。在阳性对照和两个测试的蛋白质组中检测到荧光信号,而与空载体相互作用的候选物未显示任何信号。由于BiFC系统无法避免自激活荧光,因此,作者进行了Co-IP分析来进一步验证。结果表明AtMPC1可以与AtMPC2或AtMPC3互作形成复合物(图6)。

图6 用Co-IP检测AtMPC1与AtMPC2或AtMPC3在体内的相互作用(He et al., 2019)。用FLAG抗体检测FLAG::AtMPC1,用C-MYC抗体检测C-MYC::AtMPC2和C-MYC::AtMPC3。IB:免疫印迹;IP:免疫沉淀。
总结:在研究两个蛋白的相互作用时,每个方法都存在一定的缺陷,有的方法假阳性比较高,因此为了确定两个蛋白是否真的存在相互作用,就需要用到多种方法进行相互验证,若多种方法相互验证的结果一致,那么我们就能下结论,两个蛋白之间确实存在相互作用!该案例中作者就先利用BiFC验证了AtMPC1与AtMPC2或AtMPC3之间的相互作用,然后又用Co-IP的方法进行了再次验证!
案例四
2022年1月18日,韦朝领教授团队在The Plant Journal上发表了题为:Alternative splicing of CsJAZ1 negatively regulates flavan-3-ols biosynthesis in tea plants的研究论文。该研究发现茶树CsJAZ1(Jasmonate ZIM-domain,JAZ)及其两个不同的可变剪切体(CsJAZ1-2和CsJAZ1-3)协同抑制茉莉酸(JA)介导的黄烷-3-醇生物合成。在该论文中,作者首先选取了不同生长月份和不同生长阶段的茶树叶片为实验材料,整合代谢组和转录组构建了代谢物-基因共表达网络。通过分析发现,内源性激素茉莉酸(JA)、黄烷-3-醇和多个基因之间存在显著正相关关系。对转录组数据的进一步挖掘发现,JA信号途径抑制因子CsJAZ1与黄烷-3-醇的含量呈负相关关系。接着作者通过在茶树中沉默CsJAZ1的表达,可显著降低黄烷-3-醇的含量,表明CsJAZ1是黄烷-3-醇生物合成的负调控因子。
确定了CsJAZ1的调控作用后,作者为了研究CsJAZ1的下游互作蛋白,通过数据分析最终锁定了JA信号途径关键基因CsMYC2,并结合实验确定了在CsJAZ1产生的三个不同的转录本中CsJAZ1-1和CsJAZ1-2可与CsMYC2相互作用,而CsJAZ1-3与CsMYC2无互作信号。此外,作者还通过Co-IP的方法确定了,在JA处理条件下,CsJAZ1-3可提高CsJAZ1-1–CsMYC2和CsJAZ1-2–CsMYC2蛋白复合体稳定性(图7)。
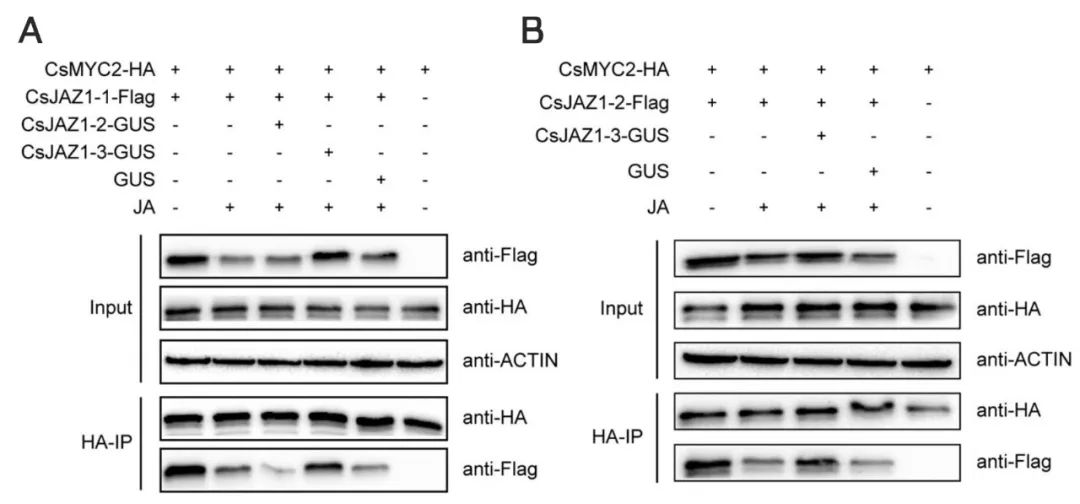
图7 免疫共沉淀结果显示,CsJAZ1-3增强了烟草中CsMYC2和CsJAZ1-1(A)或CsJAZ1-2(B)之间的蛋白-蛋白相互作用(Zhu et al., 2022)。
总结:通过这个案例,我们可以了解到在Co-IP的基础上,还可以进一步探究不同处理条件对互作蛋白复合体稳定性的影响。所以说,打破固有思维,把实验灵活运用起来,才能开发出实验的潜在魅力,大家在日常的研究中也要多多思考,灵活运用哦!
文章至此就告一段落了,在本文中伯远生物(https://plant.biorun.com)主要给大家讲解了Co-IP的原理、实验流程、结果展示以及Co-IP实验在研究中的多种典型应用案例。希望大家通过阅读本文可以加深对Co-IP的理解,日后在研究蛋白—蛋白相互作用时,能够立马想到Co-IP!另外在筛选目的蛋白的未知互作蛋白时,大家除了可以用酵母双杂筛库,还可以用IP-MS哦,它不仅可以得到与酵母双杂类似的结果,还具有更多的优势,有关IP-MS的讲解小远除了在往期文章中书写过之外,还专门请了我们的小叶师兄录制了“蛋白互作分析整体解决方案”,大家感兴趣的话可以前往伯远生物(https://plant.biorun.com)的视频号或B站主页进行查看哦!
References:
Bricker DK, Taylor EB, Schell JC, et al. A mitochondrial pyruvate carrier required for pyruvate uptake in yeast, Drosophila, and humans. Science. 2012, 337(6090): 96-100.
Fernández-Bautista N, Fernández-Calvino L, Muñoz A, et al. HOP3, a member of the HOP family in Arabidopsis, interacts with BiP and plays a major role in the ER stress response. Plant Cell Environ. 2017, 40: 1341-1355.
Gao M, He Y, Yin X, et al. Ca2+ sensor-mediated ROS scavenging suppresses rice immunity and is exploited by a fungal effector. Cell. 2021, 84(21): 5391-5404.
Hirsch S, Kim J, Muñoz A, et al. GRAS proteins form a DNA binding complex to induce gene expression during nodulation signaling in Medicago truncatula. Plant Cell. 2009, 21: 545-557.
Herzig S, Raemy E, Montessuit S, et al. Identification and functional expression of the mitochondrial pyruvate carrier. Science. 2012, 337(6090): 93-6.
He L, Jing Y, Shen J, et al. Mitochondrial Pyruvate Carriers Prevent Cadmium Toxicity by Sustaining the TCA Cycle and Glutathione Synthesis. Plant Physiol. 2019, 180(1): 198-211.
Muñoz A, Mangano S, González-García MP, et al. RIMA-dependent nuclear accumulation of IYO triggers auxin-irreversible cell differentiation in Arabidopsis. Plant Cell. 2017, 29: 575-588.
Takahashi Y. Co-immunoprecipitation from transfected cells. Methods Mol Biol. 2015, 1278: 381-9.
Zhu J, Yan X, Liu S, et al. Alternative splicing of CsJAZ1 negatively regulates flavan-3-ol biosynthesis in tea plants. Plant J. 2022, 110(1): 243-261.
Zhao C, Zayed O, Yu Z, et al. Leucine-rich repeat extensin proteins regulate plant salt tolerance in Arabidopsis. Proc Natl Acad Sci U S A. 2018, 115(51): 13123-13128.
