通过重构大肠杆菌中的甲基与硫供给系统实现麦角硫因的高效生产--文献精读169
Efficient ergothioneine production through reconstruction of the methyl and sulfur supply systems in Escherichia coli
通过重构大肠杆菌中的甲基与硫供给系统实现麦角硫因的高效生产

研究亮点
在大肠杆菌中开发了一种新型麦角硫因(ERG)生物合成策略,无需补充氨基酸即可实现高效生产,创下 7.2 g/L 的产量和 0.075 g/(L・h) 的生产效率纪录。
整合无机硫代谢通路,既拓宽了麦角硫因生物合成的硫供体来源,又减轻了因半胱氨酸需求带来的细胞代谢负担。
该策略为含甲基和硫的天然产物大规模生物合成搭建了通用平台,为可持续生物制造开辟了新路径。
技术成熟度
本研究通过新型生物合成策略,为麦角硫因(ERG)的工业化生产提供了极具潜力的技术方案。研究人员对大肠杆菌进行基因工程改造,引入甜菜碱驱动的甲基供给系统和无机硫源模块,不再需要补充昂贵的蛋氨酸和半胱氨酸,大幅降低了生产成本。
在 5 升发酵罐中,该方案实现了 7.2 g/L 的麦角硫因产量纪录,不仅超越了以往的基准水平,还为麦角硫因及其他含甲基、硫的天然产物生产,提供了可规模化且成本效益高的平台。
从摇瓶培养 456 mg/L 的产量,成功放大到更大发酵体积下 7.2 g/L 的产量,这一过程凸显了基因工程菌株的稳定性和可扩展性。因此,该技术当前的技术成熟度等级(TRL)处于 5 级至 6 级之间。
迈向商业化的后续步骤包括:在工业级发酵罐中进行验证,以及开发可规模化的下游纯化工艺。总体而言,该平台为传统提取方法提供了可持续且环境友好的替代方案,在食品、保健品、医药和化妆品行业具有广泛应用前景。通过整合先进的代谢工程、组学指导的优化技术和可规模化发酵工艺,该技术成为天然产物制造领域极具可行性的前瞻性解决方案。
摘要
麦角硫因(ERG)是一种具有多种生物活性的稀有氨基酸,在食品、化妆品和医药行业具有较高应用价值。相较于传统的食用菌提取法,微生物发酵法具备更强的可扩展性,但该方法的可行性很大程度上取决于生产产量与成本。本研究开发了一种新型麦角硫因生物合成策略,无需在发酵过程中补充昂贵的蛋氨酸与半胱氨酸。研究人员通过在大肠杆菌中重构甜菜碱驱动的甲基供给系统和无机硫供给模块,构建出高效产麦角硫因的菌株。该菌株可利用甜菜碱作为甲基供体,利用无机硫作为硫源。结果显示,在不添加外源蛋氨酸和半胱氨酸的情况下,摇瓶发酵的麦角硫因产量达到 456±9 mg/L。后续通过一系列优化策略 —— 包括增强胞内组氨酸合成、缓解蛋氨酸反馈抑制、提升麦角硫因转运效率 —— 将摇瓶产量进一步提高至 1.2 g/L,较初始菌株提升 24 倍。在 5 升发酵罐中进行放大培养时,通过进一步优化发酵条件,麦角硫因产量最终达到 7.2 g/L。综上,本研究提出的代谢工程策略,为麦角硫因及其他含甲基、硫的天然产物的工业化生产,提供了可规模化且成本效益高的平台。
引言
麦角硫因(ERG),又称 2 - 硫代 - L - 组氨酸甜菜碱,是一种稀有的天然含硫氨基酸。它属于三甲基化组氨酸衍生物,其结构特点是咪唑环上带有一个硫原子,且 α- 氮原子发生三甲基化。自 1909 年查尔斯・唐雷(Charles Tanret)首次在紫色麦角菌(Claviceps purpurea)中发现麦角硫因以来 [1],其独特的化学结构与多样的生物学功能,使其在生命科学领域备受关注 [2, 3, 4]。
麦角硫因的生物学意义主要体现在其强大的抗氧化特性上。它能有效清除细胞内的活性氧(ROS)与自由基,维持氧化还原稳态;还可通过螯合金属离子,抑制芬顿反应(Fenton reaction)产生羟基自由基,从而保护 DNA 等关键生物分子免受氧化损伤 [5, 6, 7, 8]。这些细胞保护功能,是麦角硫因在延缓衰老 [9]、抑制炎症 [10]、促进神经再生 [11] 及保护心血管 [12, 13, 14] 等方面发挥重要作用的基础。值得注意的是,麦角硫因已被列为 “十大新兴健康长寿维生素” 之一 [15]。尽管它广泛存在于微生物、植物和动物组织中,但人体无法自身合成,只能通过膳食摄入 [16],这也凸显了其作为新型膳食补充剂的潜力。
麦角硫因的生产主要有三种方法:天然提取法、化学合成法和微生物生物合成法。其中,从食用菌中提取的方法虽已得到广泛研究 [17, 18, 19, 20],但存在成本高、产量低的固有局限,难以满足工业化大规模生产需求。化学合成法虽能生产高纯度麦角硫因,却常产生有毒副产物或残留试剂,既限制了大规模生产,也引发消费者对安全性的担忧 [21]。相比之下,微生物发酵法(参见术语表)具有产量高、可扩展性强、产物安全等显著优势,已成为可持续生产麦角硫因的主流趋势。
麦角硫因的天然生物合成以组氨酸、S - 腺苷甲硫氨酸(SAM)和半胱氨酸为前体分子,但在真菌与细菌系统中遵循不同的酶促途径(详见在线补充资料图 S1)。在真菌中,组氨酸通过 S - 腺苷甲硫氨酸依赖性甲基转移酶(Egt1,酶学编号:2.1.1.44)发生三甲基化,添加三个甲基后形成组氨醇(HER)[22];随后 Egt1 催化组氨醇与半胱氨酸结合,生成组氨醇半胱氨酸亚砜;该产物再经组氨醇半胱氨酸亚砜裂解酶(Egt2,酶学编号:4.4.1.36)裂解,释放丙酮酸与氨,最终生成麦角硫因 [23]。
在细菌中,麦角硫因的生物合成涉及五种关键酶:γ- 谷氨酰半胱氨酸连接酶(EgtA,酶学编号:6.3.2.2)、组氨醇加氧酶(EgtB,酶学编号:1.14.99.50)、γ- 谷氨酰 - 组氨醇半胱氨酸亚砜水解酶(EgtC,酶学编号:3.5.1.118)、组氨酸 N-α- 甲基转移酶(EgtD,酶学编号:2.1.1.44)和组氨醇半胱氨酸亚砜裂解酶(EgtE,酶学编号:4.4.1.36)。其合成过程始于 EgtD 催化的、依赖 S - 腺苷甲硫氨酸的 L - 组氨酸甲基化反应,生成组氨醇(HER);接着 EgtA 催化半胱氨酸与谷氨酸合成 γ- 谷氨酰半胱氨酸(γ-GC);随后 EgtB 将组氨醇与 γ- 谷氨酰半胱氨酸转化为 γ- 谷氨酰 - 组氨醇半胱氨酸亚砜(γGC-HER);该产物经 EgtC 水解生成组氨醇半胱氨酸亚砜(Cys-HER);最终 EgtE 将组氨醇半胱氨酸亚砜转化为麦角硫因 [24]。
目前,通过途径工程与优化,大肠杆菌(Escherichia coli)、酿酒酵母(Saccharomyces cerevisiae)等模式生物的基因工程菌株已成功实现克级麦角硫因生产 [21, 25, 26, 27]。此外,通过关键生物合成基因的异源表达,非传统底盘微生物(如解脂耶氏酵母 Yarrowia lipolytica、谷氨酸棒状杆菌 Corynebacterium glutamicum、甲基杆菌属 Methylobacterium spp.)也已具备麦角硫因合成能力(详见表 1)。
Table 1. Comparison of ERG production across engineered microbial strainsa, b
| Strain | Medium | Precursor addition | Ergothioneine titer |
| Escherichia coli | M9 + yeast extract | Met, His | 24 mg/l |
| SM1 minimal medium, Trypton, yeast extract | Met, His | 275 mg/l; 1.3 g/lA | |
| Synthetic medium, glucose, yeast extract | Met, His | 657 mg/l | |
| Synthetic rich medium | Met, His, Cys | 290 mg/l; 5.3 g/lB | |
| Yarrowia lipolytica | Mineral medium, glucose | NS | 158 mg/l; 1.6 g/lC |
| Saccharomyces cerevisiae | Synthetic medium, glycerol | His | 20.6 mg/l |
| NS | 176 mg/l; 1.14 g/lD | ||
| Synthetic medium, glucose | NS | 106 mg/l; 2.3g/lE | |
| Synthetic Complete (SC) medium, glucose | Met, His, Cys | 82 mg/l; 0.59g/lF | |
| Methylobacterium spp | Middlebrook 7H9 (mineral medium for Mycobacterium spp), methanol | His, Cys | 10 mg/l |
| Mycolicibacterium neoaurum | Synthetic medium, glucose, glycerol | Met, His | 148 mg/l; 1.5g/lG |
| Methylobacterium species yeast | Synthetic rich medium | Met, His | 24 mg/l |
| Corynebacterium glutamicum | Synthetic medium, yeast extract | NS | 132 mg/l; 0.26g/lH |
| Ustilago siamensis CBS9960 | YM medium, glucose | His | 74 mg/l |
| Ustilago shanxiensis CBS10075 | YM medium, glucose | Met | 34 mg/l |
| E. coli | Synthetic rich medium, glycerol | Betaine, Na2S2O3 | 1206 mg/l; 7.2 g/lI |
a缩写说明:Cys,半胱氨酸;His,组氨酸;Met,蛋氨酸;NS,不补充。
b除非标注上角标(A-I),否则所有报道的产量均来自摇瓶发酵。上角标代表 5 升发酵罐在特定条件下的数据:A,216 小时时产量 1.3 g/L;B,96 小时时产量 5.3 g/L;C,220 小时时产量 1.6 g/L;D,240 小时时产量 1.14 g/L;E,160 小时时产量 2.3 g/L;F,84 小时时产量 0.59 g/L;G,216 小时时产量 1.5 g/L;H,36 小时时产量 0.26 g/L;I,96 小时时产量 7.2 g/L。
然而,目前用于麦角硫因生物合成的微生物发酵方法,均需外源补充蛋氨酸、半胱氨酸和组氨酸作为前体 [25,28,29]。这种补充不仅会增加生产成本,还可能对细胞生长产生不利影响 [30,31]。例如,胞内半胱氨酸浓度过高(>1 mM)会对大肠杆菌产生毒性,抑制其生长 [32,33]。
与蛋氨酸相比,甜菜碱(甘氨酸的三甲基化衍生物)是更具成本效益的甲基供体替代物,且甲基供体能力更优 —— 这一点已在多种生物制造平台的成功应用中得到证实 [34]。同时,组氨酸是麦角硫因合成的结构骨架,其胞内可利用量(无论是内源性合成还是外源性摄取)直接决定麦角硫因的产量上限。因此,传统策略中仅依赖外源补充氨基酸,或通过过度重定向代谢流来提供甲基和硫供体,都可能导致细胞毒性和代谢失衡。
为实现麦角硫因的大规模、低成本微生物发酵生产,必须解决这三种氨基酸前体补充带来的高成本问题。为此,本研究在产麦角硫因的大肠杆菌菌株中,构建了基于甜菜碱的甲基供给系统和无机硫供给模块,使菌株可利用甜菜碱作为甲基供体、无机硫作为硫源,用于麦角硫因的生物合成。该新型策略为麦角硫因的工业化发酵提供了兼具成本效益与可扩展性的方案。
结果
基于甜菜碱的甲基供给系统构建
在传统麦角硫因生产途径中,甲基供体 S - 腺苷甲硫氨酸(SAM)主要来源于蛋氨酸。但甲基供体的可利用量有限,会阻碍细胞的甲基化代谢,进而降低甲基依赖性产物的合成效率。
为突破这一限制,本研究旨在为大肠杆菌构建不依赖蛋氨酸的麦角硫因甲基供给系统。具体而言,我们将甜菜碱驱动的甲基供给再生循环引入麦角硫因生物合成途径,并将大肠杆菌中重构的途径分为两个模块(图 1A)。
在需要大量甲基供体的工业应用中,甜菜碱是成本效益更高的选择 [35]。它不仅是简单高效的甲基供体,对代谢系统造成的细胞压力极小;而且作为甜菜制糖过程中的天然副产物,其来源十分丰富。
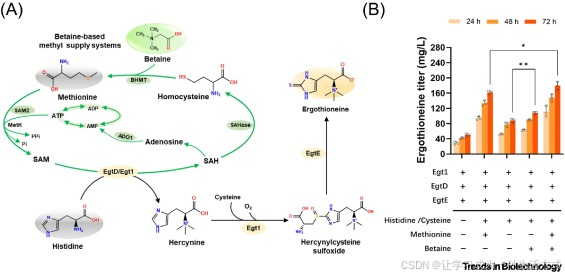
图 1 提升传统甲基供体库的策略
(A)用于麦角硫因(ERG)合成的、基于甜菜碱的甲基循环供给系统示意图。(B)在大肠杆菌 YJb105 菌株中评估传统合成途径的产量。为评估甲基供给模块,我们用甜菜碱替代蛋氨酸,在测试条件下将其作为替代甲基供体。其中,蛋氨酸腺苷转移酶(MetK)是大肠杆菌的内源酶,其余酶均为异源酶。空心圆点代表单个数据点。数据为至少三次生物学重复的平均值 ± 标准差,采用 Student's t 检验分析;*P <0.05;**P <0.01。缩写说明:ADO1,腺苷激酶;Egt1,S - 腺苷甲硫氨酸(SAM)依赖性甲基转移酶;EgtD,组氨酸 N-α- 甲基转移酶;EgtE,组氨醇半胱氨酸亚砜裂解酶;SAH,S - 腺苷 - L - 高半胱氨酸;SAHase,S - 腺苷 - L - 高半胱氨酸水解酶;SAM,S - 腺苷甲硫氨酸;SAM2/MetK,蛋氨酸腺苷转移酶;TnBHMT,甜菜碱 - 高半胱氨酸甲基转移酶。
我们首先通过导入异源基因,在大肠杆菌中构建麦角硫因生物合成途径:这些基因包括来自粗糙脉孢菌(Neurospora crassa)的 egt1,以及来自耻垢分枝杆菌(Mycobacterium smegmatis)的 egtD 和 egtE。构建得到的菌株 YJb105(详见在线补充资料表 S1)在摇瓶中发酵 72 小时后,其麦角硫因产量如下:在不补充蛋氨酸、半胱氨酸和组氨酸的培养基中,产量为 50±3.1 mg/L;在补充上述三种氨基酸的培养基中,产量为 161±4.5 mg/L(图 1B)。
在相同发酵条件下,省略蛋氨酸或用甜菜碱替代蛋氨酸,均会显著降低麦角硫因产量:省略蛋氨酸时产量为 87±4.5 mg/L,用甜菜碱替代时产量为 107±3.5 mg/L(图 1B)。值得注意的是,同时补充蛋氨酸和甜菜碱可进一步提升麦角硫因产量,达到 179±10.4 mg/L,较仅补充蛋氨酸、半胱氨酸和组氨酸的培养基提升 11%。这些结果表明,甜菜碱可作为麦角硫因生物合成的替代甲基源,有望在发酵过程中取代蛋氨酸。
由于 YJb105 菌株缺乏甜菜碱 - 高半胱氨酸甲基转移酶(BHMT),无法将甜菜碱代谢为甲基供体,因此本实验中补充甜菜碱的主要目的,是评估其能否在大肠杆菌中提升麦角硫因产量。在微生物发酵中,甜菜碱常被用作渗透压胁迫调节剂和保护剂,已有研究表明它可同时促进细胞生长与产物合成 [36]。
为验证上述假设,我们向产麦角硫因的 YJb105 菌株中导入基于甜菜碱的甲基供给模块。首先,我们导入来自硝酸还原硫杆状菌(Thioclava nitratireducens)的 BHMT,该酶可催化甜菜碱与高半胱氨酸转化为蛋氨酸(图 1A)。构建得到的 YJb111 菌株在补充甜菜碱、半胱氨酸和组氨酸的培养基中摇瓶发酵 72 小时后,麦角硫因产量为 119±7.5 mg/L,较 YJb105 菌株提升 18.2%。这一提升表明,即使在甲基循环模块未完全发挥功能的情况下,过表达 TnBHMT 也能促进大肠杆菌利用甜菜碱合成胞内蛋氨酸。
然而,仅过表达 TnBHMT 无法显著提升麦角硫因产量,原因可能在于以下限制:组氨醇(麦角硫因合成的前体物质)的直接前体是 SAM,而 SAM 的下游合成过程存在瓶颈;或高半胱氨酸的供给不足(图 1A)。为突破 SAM 合成的限制,我们进一步导入来自酿酒酵母(S. cerevisiae)的蛋氨酸腺苷转移酶(SAM2),该酶可促进蛋氨酸转化为 SAM。构建得到的 YJb112 菌株在补充甜菜碱、半胱氨酸和组氨酸的培养基中摇瓶发酵 72 小时后,麦角硫因产量达到 139±9.9 mg/L,较 YJb105 菌株提升 38.1%。
为进一步优化甲基循环,我们还导入了两种酶:一是来自高效棒状杆菌(Corynebacterium efficiens)的 S - 腺苷 - L - 高半胱氨酸(SAH)水解酶(SAHase),可将 SAH 水解为高半胱氨酸;二是来自微小隐孢子虫(Cryptosporidium parvum)的腺苷激酶(ADO1),可通过增强 ATP 再生来支持内源性 SAM 合成。但实验结果显示,无论是过表达 SAHase 的菌株(YJb113),还是过表达 ADO1 的菌株(YJb114),其麦角硫因产量均未出现显著提升。
我们推测,过表达 SAHase 效果有限的原因,可能是大肠杆菌自身存在内源性 SAH 水解途径 —— 在甲基循环模块部分激活的条件下,该内源途径已能维持足够的高半胱氨酸循环。而对于 ADO1,尽管其腺苷激酶活性可提升 ATP 利用率,从而支持内源性蛋氨酸合成 SAM,但由于缺乏专门的蛋氨酸供给模块(如 BHMT 介导的甜菜碱转化途径),细胞生长需求与麦角硫因生物合成之间可能出现失衡。这一瓶颈表明,内源性蛋氨酸库不足以同时支撑这两个过程。
为解决这些相互关联的限制,我们随后尝试组合过表达 TnBHMT、SAM2、SAHase 和 ADO1,以系统性协调蛋氨酸供给、SAM 合成与甲基循环通量。有趣的是,仅组合过表达 TnBHMT 和 ADO1 的菌株(YJb120),其性能优于携带完整或部分甲基循环模块的菌株。在补充甜菜碱的摇瓶中发酵 72 小时后,YJb120 菌株的麦角硫因产量达到 203±19 mg/L,较 YJb121 菌株提升 18%,较缺乏甲基循环供给系统的菌株(YJb105)提升 101%(图 2)。
我们推测,ADO1 介导的 ATP 过量生成,可促进大肠杆菌内源 MetK 利用 TnBHMT 产生的蛋氨酸,将其转化为 SAM。但 TnBHMT 的活性相对较低,不足以支撑菌株中甲基循环模块的完整运转,导致前体物质积累,最终限制了途径效率。为解决这一问题,我们进一步提高了 YJb120 和 YJb121 菌株中 TnBHMT 的表达量。结果显示,将 TnBHMT 表达量翻倍后,两个菌株的麦角硫因合成均显著提升。
其中,整合了完整重构甲基循环模块的 YJb127 菌株,在 48 小时时的麦角硫因产量达到 213±6 mg/L:较单拷贝过表达 TnBHMT 的菌株(YJb121)提升 57%,较组合表达 TnBHMT 与 ADO1 的菌株(YJb120 和 YJb126)分别提升 32% 和 34%(详见在线补充资料图 S2)。
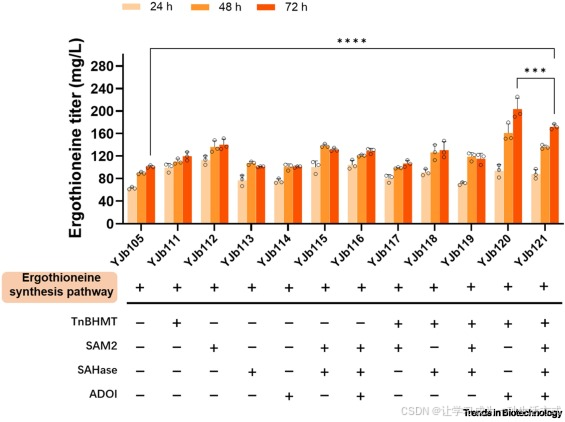
图 2 甲基循环模块中不同基因表达组合对麦角硫因(ERG)产量的影响
空心圆点代表单个数据点。数据为至少三次生物学重复的平均值 ± 标准差,采用 Student's t 检验分析;***P <0.001;****P <0.0001。缩写说明:ADO1,腺苷激酶;SAHase,S - 腺苷 - L - 高半胱氨酸水解酶;SAM2/MetK,蛋氨酸腺苷转移酶;TnBHMT,甜菜碱 - 高半胱氨酸甲基转移酶。
利用无机硫高效合成麦角硫因
半胱氨酸是麦角硫因合成的主要硫供体,其胞内浓度对麦角硫因的合成效率起决定性作用。但半胱氨酸代谢流过高或积累过多,会干扰微生物的细胞代谢、引发毒性,并触发自身调节反馈机制 [37],最终限制麦角硫因合成。
为此,本研究探索使用无机硫作为麦角硫因合成的替代硫供体,以维持胞内半胱氨酸稳态。具体而言,我们采用一种含硫氰酸酶结构域的蛋白 EanB,催化一步转硫反应 —— 以硫代硫酸盐为硫源,将组氨醇转化为麦角硫因(图 3A)[38,39]。
在野生型 BL21(DE3)菌株中,共过表达 EgtD、Egt1 和 EanB 三个基因后,该菌株在补充蛋氨酸、组氨酸和硫代硫酸钠的培养基中摇瓶发酵 72 小时,麦角硫因产量达到 105±2.9 mg/L(图 3B)。
相比之下,在相同发酵条件下,以下情况均未检测到麦角硫因生成:仅过表达 EanB;EanB 与 EgtD 或 Egt1 共表达;以及仅共表达 EgtD 与 Egt1。此外,向培养基中外源补充组氨醇时,同样未检测到麦角硫因,推测原因是细胞对组氨醇的摄取效率较低(详见在线补充资料图 S3 和图 S5)。
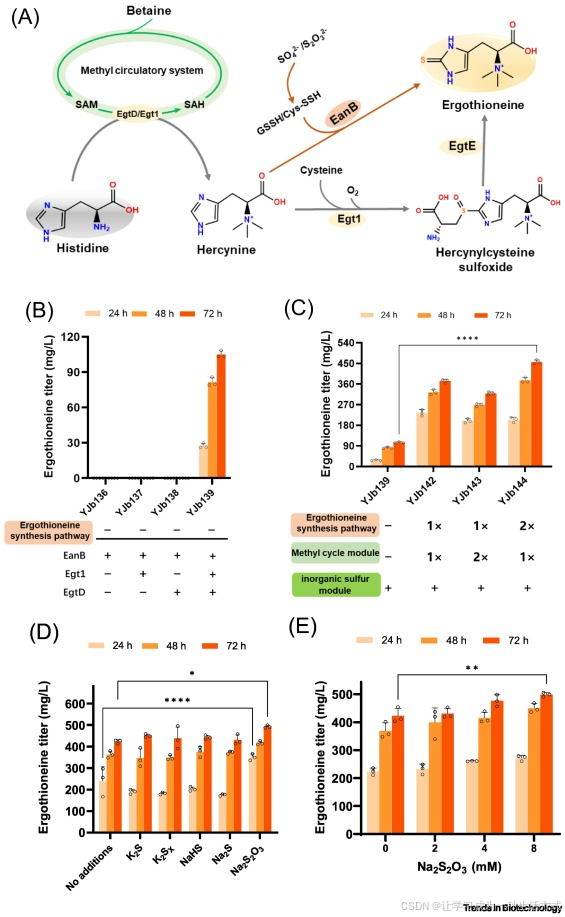
图 3 麦角硫因(ERG)生产中硫供体的优化
(A)利用无机硫源合成麦角硫因的示意图。(B)在野生型大肠杆菌中评估 EanB 的活性。(C)不同模块组合对麦角硫因产量的影响。(D)不同无机硫源对麦角硫因产量的影响。(E)硫代硫酸钠(Na₂S₂O₃)浓度对麦角硫因产量的影响。空心圆点代表单个数据点。数据为至少三次生物学重复的平均值 ± 标准差,采用 Student's t 检验分析;*P <0.05;**P <0.01;****P <0.0001。缩写说明:Cys-SSH,半胱氨酸氢过硫化物;GSSH,谷胱甘肽二硫化物。
接下来,我们将基于甜菜碱的甲基供给系统与无机硫供给模块,共同整合到麦角硫因合成菌株中。改造后的菌株可同时利用蛋氨酸和甜菜碱作为甲基供体,以及半胱氨酸和无机硫作为硫供体,用于麦角硫因合成。构建得到的 YJb144 菌株,在补充甜菜碱、硫代硫酸盐和组氨酸的培养基中摇瓶发酵 72 小时后,麦角硫因产量达到 456±9 mg/L。
此外,我们还评估了多种形式的无机硫源,包括硫化钠(Na₂S)、硫氢化钠(NaHS)、硫化钾(K₂S)、多硫化钾(K₂Sₓ)和硫代硫酸钠(Na₂S₂O₃),这些硫源均能有效促进麦角硫因生产(图 3D)。其中,硫代硫酸钠(Na₂S₂O₃)因对胞内硫代谢影响温和,成为优选硫源。
为阐明 Na₂S₂O₃在无机硫同化途径中的作用,我们重新评估了发酵菌株 YJb105、YJb121 和 YJb139 的麦角硫因产量。发酵结果显示,在含有无机硫途径的菌株中,外源添加 Na₂S₂O₃可显著提高麦角硫因产量(详见在线补充资料图 S4)。
对 Na₂S₂O₃浓度的进一步优化表明,麦角硫因产量随补充浓度的升高而持续增加:当浓度为 8 mM 时,产量较 0 mM 对照组提升 17.7%(图 3E)。
通过优化胞内组氨酸、蛋氨酸合成及麦角硫因外排提升产量
组氨酸作为麦角硫因的结构骨架前体,对总产量起决定性作用。为避免麦角硫因生物合成中对外源组氨酸的依赖,我们采取措施增强其胞内合成。
首先,我们用反馈抑制抗性突变体 hisG_Cg(WP_003856149.1,突变位点:N215K/L231F/T235A)替换内源 hisG 基因,以缓解组氨酸介导的反馈抑制。其次,我们过表达组氨酸生物合成操纵子中的 6 个基因(hisA、hisB、hisC、hisD、hisF/H、hisI),同时过表达甘油利用途径相关基因(glpF、dhaK、gldA)。这些改造使组氨酸产量提升至 1.3±0.1 g/L;将组氨酸操纵子拷贝数翻倍后,产量进一步提升至 2.0±0.14 g/L。
此外,我们敲除了 purF 基因 —— 该基因会竞争代谢前体 5 - 磷酸核糖 - 1 - 焦磷酸(PRPP)并消耗 ATP。经此改造,摇瓶发酵中最终组氨酸产量达到 2.4±0.29 g/L(菌株 YJb149)。
随后,我们将麦角硫因生物合成途径(Egt1、EgtD、EgtE)、基于甜菜碱的甲基供给模块(TnBHMT、SAM2、SAHase、ADO1)及无机硫供给模块(Egt1、EgtD、EanB),共同组装到前体增强菌株 YJb149 中。构建得到的 YJb162 菌株,在仅补充甜菜碱和硫代硫酸盐的培养基中摇瓶发酵 72 小时后,麦角硫因产量为 156±14 mg/L(图 4C)。
为进一步提升产量,我们优化了硫供给模块与传统麦角硫因途径的共表达组合。在 YJb173 菌株中实现双模块共表达后,72 小时摇瓶发酵的麦角硫因产量提升至 436±9.2 mg/L,较 YJb162 菌株提升 179%(详见在线补充资料图 S6)。
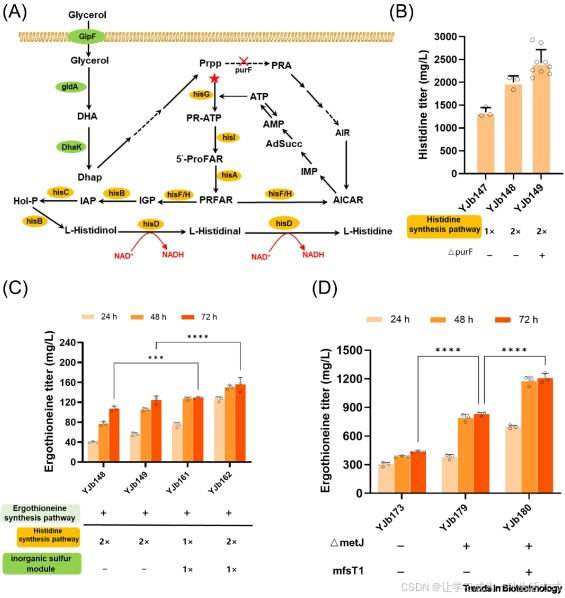
图 4 通过优化组氨酸与蛋氨酸途径、模块组合及外排效率提升麦角硫因(ERG)产量
(A)组氨酸生物合成途径示意图。(B)基因改造后组氨酸产量的提升效果。(C)产麦角硫因菌株中模块组合的优化 —— 整合的三个模块分别为:基于甜菜碱的甲基供给模块、无机硫供给模块及组氨酸合成增强模块。(D)敲除 metJ 基因与过表达 mfsT1 基因对麦角硫因产量的影响。红色星号代表关键反应步骤,红色 “×” 代表基因敲除。空心圆点代表单个数据点。数据为至少三次生物学重复的平均值 ± 标准差,采用 Student's t 检验分析;***P <0.001;****P <0.0001。缩写说明:AdSucc,腺苷琥珀酸;AICAR,5 - 氨基咪唑 - 4 - 甲酰胺核糖核苷酸;AIR,5 - 氨基咪唑核糖核苷酸;DHA,二羟基丙酮;Dhap,二羟基丙酮磷酸;Hol-P,L - 组氨醇磷酸;IAP,咪唑乙酰磷酸;IGP,咪唑甘油磷酸;IMP,肌苷单磷酸;PRA,磷酸核糖胺;PRFAR,磷酸核糖亚胺基 - AICAR - 磷酸;Prpp,5 - 磷酸核糖 - 1 - 焦磷酸;ProFAR,磷酸核糖亚胺基 - 5 - 氨基咪唑 - 4 - 羧酸核糖核苷酸(注:原文 ProFAR 后无完整释义,此处为该缩写常规对应术语)。
由于 S - 腺苷甲硫氨酸(SAM)依赖性转录调控因子 MetJ 会抑制蛋氨酸调节子及 SAM 生物合成酶的表达 [40,41],我们推测敲除该基因可提升麦角硫因总产量。实验结果证实,在 YJb173 菌株中敲除 metJ 后,麦角硫因产量几乎翻倍 —— 摇瓶发酵 72 小时后产量达到 829±18 mg/L。
此外,我们还探究了麦角硫因外排效率对总产量的影响。过表达来自新金色分枝杆菌(Mycolicibacterium neoaurum)的 mfsT1 基因(WP_030133796.1)—— 该基因已知可促进麦角硫因转运 [42]—— 后,菌株在补充甜菜碱和硫代硫酸盐的培养基中摇瓶发酵 72 小时,麦角硫因产量进一步提升至 1206±50 mg/L,较 YJb179 菌株提升 45.4%(图 4D)。
补料分批发酵生产麦角硫因
最后,为评估优化后菌株 YJb180 中麦角硫因生物合成的可扩展性,我们在 5 升生物反应器中进行补料分批发酵,按《STAR★METHODS》中的详细说明控制甘油、甜菜碱和硫代硫酸盐的补料(图 5A)。
补料过程中,通过氨水将 pH 值维持在 6.8,同时将溶解氧(DO)和甘油浓度分别控制在 28% 和 5 g/L(图 5B)。高效液相色谱(HPLC)与液相色谱 - 质谱联用(LC-MS)分析证实,最终发酵产物的分子量和色谱柱保留时间,与麦角硫因标准品一致(图 5C、D)。
结果表明,大规模补料分批发酵显著提升了麦角硫因产量:YJb180 菌株在 96 小时时的麦角硫因产量达到 7.2±0.2 g/L,产率为 0.035±0.001 g/g,生产效率为 0.075±0.002 g/(L・h)。据我们所知,这是目前已报道的最高麦角硫因产量和生产效率,分别较此前报道提升 35.8% 和 36.3%[24]。尤为重要的是,该高产水平无需外源补充氨基酸即可实现,充分体现了基因工程菌株的高效性。
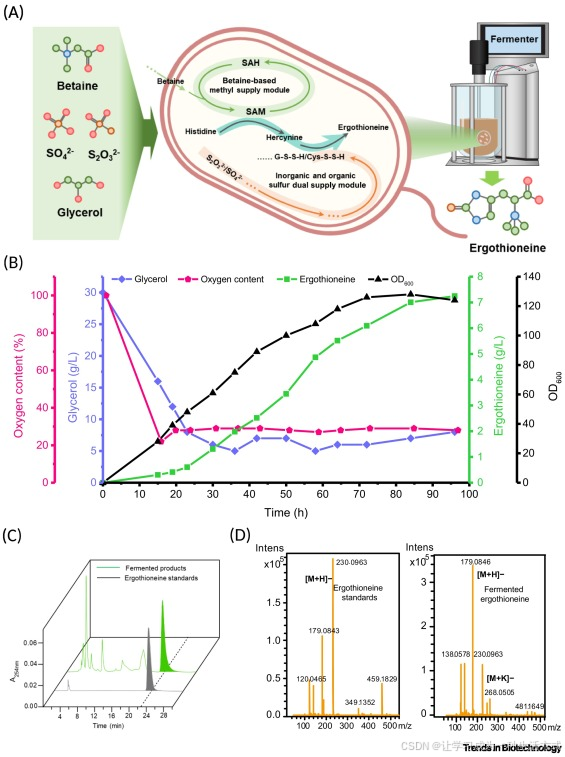
图 5 以甘油、无机硫和甜菜碱为原料的补料分批发酵生产麦角硫因(ERG)
(A)本研究构建的基因工程菌株及发酵工艺示意图,该工艺以甘油、无机硫和甜菜碱为原料合成麦角硫因。(B)补料分批发酵过程中麦角硫因产量的时间变化曲线:红线代表溶解氧,深蓝色线代表甘油浓度,黑线代表 600 nm 处的光密度值(OD₆₀₀),绿线代表麦角硫因生产效率。(C)采用氨基酸色谱柱的高效液相色谱(HPLC)分析:绿色峰对应麦角硫因标准品,灰色峰对应发酵液上清。(D)电喷雾电离质谱(ESI-MS)分析验证麦角硫因身份:(i)标准品样本;(ii)发酵液样本。缩写说明:Cys-SSH,半胱氨酸氢过硫化物;GSSH,谷胱甘肽二硫化物;SAH,S - 腺苷 - L - 高半胱氨酸;SAM,S - 腺苷甲硫氨酸。
讨论
利用基因工程微生物细胞工厂发酵生产麦角硫因时,通常需补充蛋氨酸(作为甲基供体)和半胱氨酸(作为硫供体),这会大幅增加生产成本 [43,44]。本研究通过在麦角硫因合成菌株中重构基于甜菜碱的甲基供给系统与无机硫供给模块,使菌株可利用甜菜碱作为甲基供体、无机硫作为硫源,用于麦角硫因的生物合成。
甜菜碱(三甲基甘氨酸)是高效的甲基供体,可通过甜菜碱 - 高半胱氨酸甲基转移酶(BHMT,酶学编号:2.1.1.5)催化高半胱氨酸再甲基化为蛋氨酸,进而提高 S - 腺苷甲硫氨酸(SAM)的可利用量 [35,36]。但大肠杆菌缺乏内源性的、依赖 BHMT 的甜菜碱分解代谢途径,使其难以将甜菜碱用作 SAM 依赖性生物合成的甲基源。
Liu 等人曾在大肠杆菌中构建了甜菜碱驱动的蛋氨酸 / SAM 循环,使阿魏酸的产量和生产效率分别提升 12.6 倍和 15.9 倍 [34]。该甜菜碱驱动的甲基供给系统还成功应用于 L - 脂 aphorine 的生物合成 [45]。本研究采用类似策略,通过异源表达 BHMT、优化 ATP 再生及增强 SAHase 途径,使 YJb127 菌株的麦角硫因产量提升 114.4%,达到 218±8.4 mg/L。
然而,BHMT 的催化活性有限,极大限制了甜菜碱向高半胱氨酸的甲基转移效率。值得注意的是,即使甜菜碱脱甲基生成二甲基甘氨酸后,该代谢产物仍具有较强的甲基供体潜力。结合实际生产中甲基供体的供给效率,未来可通过基因编辑或体内连续进化等策略,针对性提升 BHMT 的甲基转移酶活性;同时拓展 BHMT 的底物特异性,使其能依次利用二甲基甘氨酸和一甲基甘氨酸,这将显著提高甜菜碱中甲基资源的利用率,进而提升麦角硫因产量。
甜菜碱的成本约为 700 美元 / 吨,仅为蛋氨酸成本的 20%(表 S1),其作为甲基供体的经济优势十分显著。除参与甲基化反应外,甜菜碱还可作为胁迫保护剂,保护细胞和酶免受渗透压、温度等胁迫影响。已有研究表明,发酵过程中添加甜菜碱可促进多种生物产物的合成,包括 D - 乳酸 [46]、乙醇 [47]、L - 苏氨酸 [48,49]、L - 精氨酸 [50] 及维生素 B12 [51]。
无机硫化合物作为替代硫供体,具有双重代谢优势:不仅可促进胞内半胱氨酸的生物合成,还能在 EanB 等特定酶的催化下,直接作为无机硫源参与组氨醇到麦角硫因的一步转化反应。本研究开发了 “双硫供体” 策略(图 1A、3B),在保留传统半胱氨酸依赖性生物合成途径的同时,整合了创新性的无机硫利用途径。该策略可实现麦角硫因的高效发酵,且无需外源补充半胱氨酸。
通过系统性筛选,我们最终选择硫代硫酸钠(Na₂S₂O₃)作为最优无机硫源,原因在于其反应活性温和且细胞毒性低。值得注意的是,这一选择与部分此前研究存在差异 —— 已有研究显示,在体外 EanB 催化的麦角硫因合成中,多硫化钾(K₂Sₓ)的效果更优 [37]。这种差异可能源于体外实验中可控的缓冲环境:该环境可减轻细胞毒性,同时提升转化效率。
在微生物代谢中,硫代硫酸根(S₂O₃²⁻)可通过内源性硫转移酶参与半胱氨酸的生物合成,并参与形成硫烷硫物种(如过硫化物 RSSH、多硫化物 RSₙR(n>2)、氢多硫化物 H₂Sₙ(n>1))[52,53],这可能会增强细胞的抗氧化能力。尽管其确切调控机制尚不明确,但它在麦角硫因生产中的重要性已得到证实。
麦角硫因生物合成中的关键反应是 C-H 键向 C-S 键的转化。研究表明,EanB 采用新型催化机制,以多硫化物为直接硫源,一步实现该转化 [37,54]。相比之下,传统的半胱氨酸依赖性途径需 Egt1、EgtE 等多种酶协同作用,通过分步反应实现类似转化 [44]。但 EanB 驱动的无机硫利用确切机制仍不明确。
EanB 能够直接利用多硫化物作为硫源,这可能与其进化起源相关 —— 它源自绿色硫细菌,这类细菌生活在富含多硫化物的环境中,硫代谢产物在其硫代谢和能量产生过程中发挥关键作用 [55]。未来深入研究 EanB 的催化机制与硫转移过程,或可为提升麦角硫因生物合成效率提供新策略。
对于麦角硫因的工业化生产,大规模菌株优化至关重要。尽管已在不同底盘菌株中应用多种优化策略,但目前麦角硫因的发酵产量仍相对较低,且多数策略需外源补充多种氨基酸(表 1)。此前报道的最高麦角硫因产量为 5 升发酵罐中 5.3 g/L,但该过程需添加三种氨基酸前体 [24]。
相比之下,本研究构建的基因工程菌株具有更优的工业化潜力:即使与添加前体氨基酸的发酵工艺相比,本研究的摇瓶发酵产量(1.2 g/L)和 5 升发酵罐产量(7.2 g/L)均为目前已报道的最高水平。研究结果表明,甲基供体通量是决定麦角硫因产量的关键因素,而胞内组氨酸产量与硫供体可利用量也会显著影响最终产量。
在代谢途径优化中,关键在于确保前体物质充足供给,同时最大限度减少胞内能量资源的过度竞争 —— 这种平衡对于大规模生产尤为重要。
综上,本研究通过代谢工程策略优化并构建了高产麦角硫因菌株 YJb180,该菌株无需外源补充组氨酸、蛋氨酸或半胱氨酸,为麦角硫因的工业化生物合成提供了可规模化、高成本效益的平台。
结论与展望
随着麦角硫因(ERG)的功能价值与健康益处日益得到认可,其全球市场规模有望实现大幅增长。微生物发酵为麦角硫因生产提供了成本高效、可规模化且环境友好的途径,是资源密集型提取法的理想替代方案。这一技术进步推动麦角硫因在化妆品、保健品和医药领域的广泛应用,为全球健康产业的可持续发展开辟了新路径。
本研究通过重构甜菜碱驱动的甲基供给系统与无机硫源模块,建立了创新性的麦角硫因生物合成策略。该策略无需补充蛋氨酸或半胱氨酸即可实现高效发酵,突破了传统生产工艺中的主要成本瓶颈。在摇瓶培养和 5 升补料分批培养中,麦角硫因产量均达到目前报道的最高水平,充分证明了该策略的可扩展性与工业化潜力。除麦角硫因外,该平台还为多种含甲基、硫的天然产物大规模生物合成奠定了通用基础,为可持续生物制造开辟了新方向。
未来要进一步提升菌株性能,需结合组学分析、代谢网络模型指导的优化策略,以及先进的进化工程技术,以实现符合商业化规模需求的更高产量(参见 “待解决问题”)。同时,下游分离纯化技术的同步突破,对麦角硫因高效、低成本商业化至关重要。
待解决问题
如何平衡硫供体、甲基供体的代谢通量与组氨酸生物合成,在最大化麦角硫因产量的同时,最小化细胞能量竞争?
大肠杆菌中甜菜碱 - 高半胱氨酸甲基转移酶(BHMT)的活性受哪些因素限制?如何通过酶工程与定向进化技术提升其甲基转移效率?
如何使 BHMT 依次利用二甲基甘氨酸和一甲基甘氨酸,优化甜菜碱来源甲基的利用效率?
调控 EanB 介导的硫掺入过程的机制是什么?如何利用这些机制改进麦角硫因生物合成中硫供体的整合效率?
实验模型与研究对象详情
所有产麦角硫因(ERG)的大肠杆菌菌株均以实验室保存的模式菌株 —— 大肠杆菌 BL21 (DE3) 为基础构建。所有用于表达载体构建的菌株均为商用大肠杆菌 DH5α。本研究未涉及人类或动物实验对象。所有菌株均以甘油菌形式保存在 - 80°C,培养时使用添加相应抗生素的 LB 培养基(Luria-Bertani 培养基)和发酵培养基。
实验方法详情
化学试剂与常规分子生物学技术
所有化学试剂均购自美国密苏里州圣路易斯市的 Sigma-Aldrich 公司。本研究使用的寡核苷酸由中国天津 Azenta 生命科学公司旗下的 GENEWIZ 合成。大肠杆菌来源的基因通过聚合酶链式反应(PCR)从大肠杆菌 BL21 (DE3) 的基因组 DNA 中扩增获得;其他生物来源的基因经大肠杆菌密码子偏好优化后,由中国天津 Azenta 生命科学公司旗下的 GENEWIZ 合成。
DNA 构建采用融合 PCR 与等温组装技术(Gibson 组装)[65] 完成。所有构建的质粒(详见在线补充资料表 S3)均通过 DNA 测序验证,测序工作由中国天津 Azenta 生命科学公司旗下的 GENEWIZ 完成。
菌株与质粒
大肠杆菌 DH5α 用于标准克隆操作与质粒制备;大肠杆菌 BL21 (DE3) 作为麦角硫因异源生物合成及后续途径工程改造的主要微生物底盘。本研究中所用及构建的所有菌株详见在线补充资料表 S2。
细菌表达载体 pET-28a 与 pACYCDuet 用于构建质粒,以过表达麦角硫因生物合成途径、甲基供体模块、无机硫利用途径及麦角硫因转运相关的单个或组合基因。工具质粒 pEcCas 与 pTargetF 用于基因组编辑 [66]。
本研究使用的所有质粒与寡核苷酸的详细信息详见在线补充资料表 S3 与表 S4;所用酶的氨基酸序列详见在线补充资料表 S5。
基因组改造
大肠杆菌的基因敲除与整合通过基于 CRISPR-Cas9 的基因组编辑工具 ——pEcCas/pTargetF 系统完成 [66]。每条线性供体 DNA 片段均包含上游同源臂(约 500 bp)、目的基因表达盒(敲除时无表达盒)与下游同源臂(约 500 bp),通过融合 PCR 组装获得。
每个基因组位点的靶向序列(N20)根据敲除或整合区域的序列设计,并导入 pTarget 质粒。整合位点 BL1-BL9 的基因组位置详见表 S2 的注释。所有涉及基因敲除或染色体整合的菌株均通过阳性与阴性对照进行基因分型,随后通过测序验证目的开放阅读框(ORF)的移除或整合 DNA 片段的存在。
摇瓶发酵
摇瓶发酵在 250 ml 带挡板的三角烧瓶中进行,烧瓶内装有 20 ml 培养基,于 28°C、200 rpm 振荡培养。从 LB 琼脂平板上挑取新鲜转化的单菌落,接种到 5 ml 含卡那霉素(50 μg/ml)或氯霉素(34 μg/ml)抗性的 LB 培养基中,培养 10-12 小时。
随后按 2%(体积比)的接种量,将种子液转移至装有 20 ml 发酵培养基的 250 ml 带挡板三角烧瓶中,于 37°C 培养。当 600 nm 处光密度值(OD₆₀₀)达到约 4-5 时,将培养温度降至 28°C,并用 1 mM 异丙基 -β-D - 硫代半乳糖苷(IPTG)诱导表达。每个发酵实验均设置 3 次生物学重复。
发酵培养基(1 升)的组成如下:24 g 酵母提取物、12 g 胰蛋白胨、5 g 氯化钠(NaCl)、2 g 磷酸氢二钾(K₂HPO₄)、0.5 g 七水合硫酸镁(MgSO₄・7H₂O)、30 g 甘油、0.06 g 柠檬酸铁铵(AFC)、2 g 甜菜碱、8 mM 硫代硫酸钠(Na₂S₂O₃)。补充的蛋氨酸与半胱氨酸终浓度均为 0.1%。
补料分批发酵
补料分批发酵在 5 升发酵罐中进行。将 37°C 培养 10-12 小时的新鲜种子液按 5%(体积比)的接种量,接入装有 2 升发酵培养基的 5 升发酵罐中。初始培养温度为 37°C,当生物量达到适宜水平后,将发酵罐温度降至 28°C,并用 1 mM IPTG 诱导表达。
麦角硫因发酵过程中,通过添加氨水将 pH 值维持在 6.8;通过调节发酵罐搅拌桨转速,将实时溶解氧(DO)维持在 30%。通气速率与搅拌转速根据溶解氧的实时测量值自动调节。
初始甘油浓度设定为 30 g/L,当甘油浓度降至 8 g/L 以下时,连续添加混合补料液(800 g/L 甘油、15 g/L 甜菜碱、20 g/L 硫代硫酸钠),使残留甘油浓度维持在 6 g/L 以下,并根据需要额外补充甜菜碱与硫代硫酸钠。
补料分批发酵培养基(每升)的组成如下:24 g 酵母提取物、12 g 胰蛋白胨、5 g 氯化钠(NaCl)、5 g 磷酸氢二钾(K₂HPO₄)、1 g 七水合硫酸镁(MgSO₄・7H₂O)、0.1 g 柠檬酸铁铵(AFC)、0.02 g 盐酸吡哆醇、1.5 g 柠檬酸钠、0.02 g 七水合硫酸亚铁(FeSO₄・7H₂O)。
分析方法
细胞生长通过紫外分光光度计(Eppendorf BioSpectrometer)测量 600 nm 处光密度值(OD₆₀₀)进行监测。培养基中的组氨酸浓度通过自动氨基酸分析仪(日本日立 HITACHI L-8900)按制造商标准操作规程定量。
甘油通过高效液相色谱(HPLC)检测,使用示差折光检测器(RID)与 Aminex HPX-87H 阳离子交换柱;流动相为 5 mM 硫酸(H₂SO₄),流速 0.6 ml/min,柱温 60°C。
麦角硫因的分析检测:取不同发酵时间点的样品,用蒸馏水适当稀释。取 1 mL 稀释后的样品转入 2 mL 离心管,在金属浴中 98°C 孵育 10 分钟;随后将处理后的样品以 13000 rpm 离心 5 分钟。为保证纯度,上清液经 0.22 μm 滤膜过滤后,参照已建立的方法 [67],通过 HPLC 与液相色谱 - 质谱联用(LC-MS)进行分析。
HPLC 分析使用氨基柱(Zorbax NH₂,4.6×250 mm,5 μm,安捷伦);流动相为 80% 乙腈与 20% 水,流速 1.0 ml/min;进样量 20 μl,检测波长 254 nm,柱温 35°C。
定量与统计分析
采用 Student's t 检验进行适当的统计分析。统计显著性定义为:P < 0.05()、P < 0.01()或 P < 0.001()。
发酵产物中麦角硫因的测定,除非另有说明,所有实验组均设置 3 次生物学重复。图中所有误差线均代表指定生物学重复的标准差(SD)。
由于菌株发酵存在固有的批次间差异,所有比较分析均使用同一实验批次的样品,且统计比较仅在单个实验内进行。
