SPR 实验笔记:从原理到实操,解锁天然产物筛选、靶点验证与膜蛋白互作的“金标准”技术
开篇:为什么 SPR 是科研人的 “分子天平”?
表面等离子体共振(SPR)技术凭啥能写入中美药典,成为生物分子互作研究的 “金标准”?答案藏在它的三个核心优势里:无标记干扰(避免荧光标记破坏分子活性)、实时动态监测(全程记录结合 - 解离全过程)、定量精度高(精准计算亲和力参数)。
更关键的是,它能解决科研中的三大痛点:从中药提取物里 “钓” 活性成分、验证药物与靶点的直接结合、破解膜蛋白与小分子的互作谜题。这篇笔记就带你吃透 SPR 的原理、实操和前沿应用。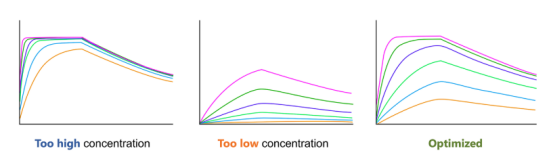
5 分钟看懂 SPR 原理:光与金属的“互动游戏”
SPR 的核心是一场发生在芯片表面的光学魔术,关键流程可简化为 3 步:
1. 激发共振:偏振光以特定角度照射芯片表面的金 / 银纳米薄膜,激发自由电子形成 “表面等离子体波”,此时反射光强度骤降(形成共振角)。
2. 互作触发:将蛋白(配体)固定在薄膜上,当小分子(分析物)流经表面并结合时,薄膜附近折射率改变,共振角随之偏移。
3. 信号转化:偏移量被转化为 “响应单位(RU)”,1 RU≈1pg/mm² 的质量变化,最终生成实时结合 - 解离曲线。
【核心参数解读】
▶ 结合速率常数(ka):分子“相遇结合”的快慢
▶ 解离速率常数(kd):结合物“分手解离”的难易
▶ 平衡解离常数(KD=kd/ka):亲和力指标,KD 越小结合越牢固
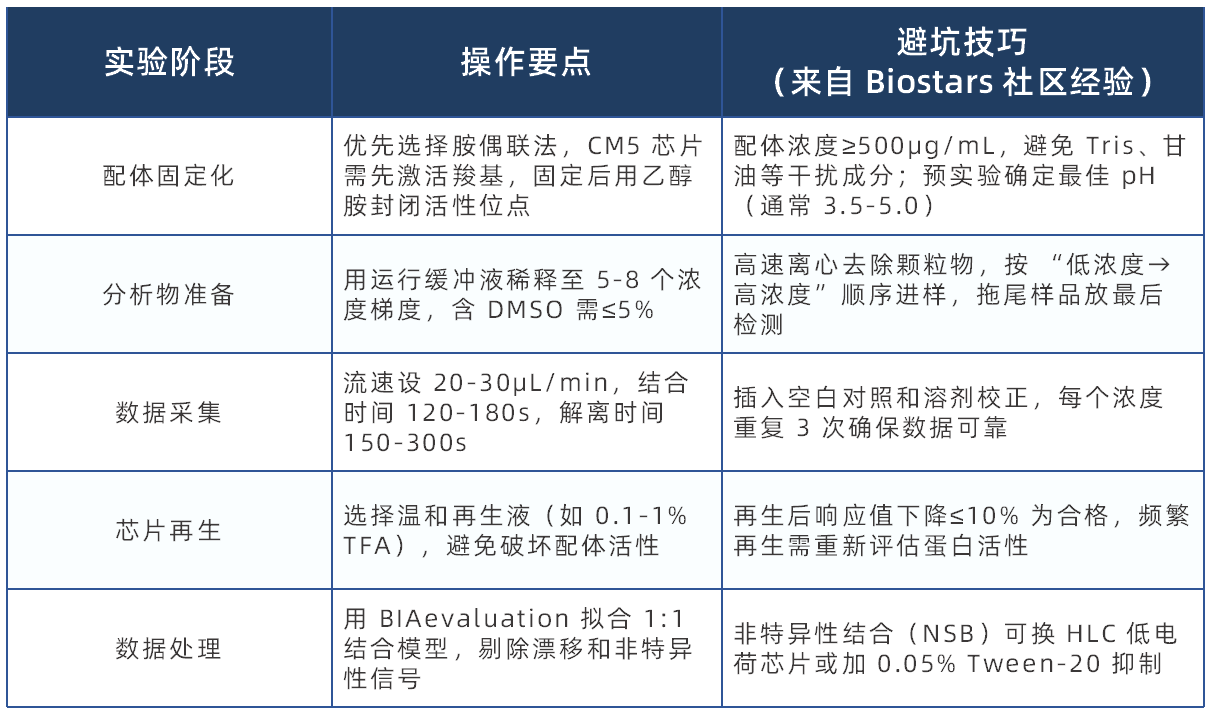
实操避坑指南:从芯片到数据的全流程攻略
SPR 实验想少走弯路?这份标准化流程 + 关键技巧请收好(结合 Springer Protocols 与 Thermo 技术手册整理):
【芯片选择速查表(参考 IBA、Sigma 技术资料)】
▶ 常规互作:CM5 羧基芯片(通用型,适合蛋白固定)
▶ 低 NSB 需求:HLC 低电荷芯片(疏水 / 静电吸附少)
▶ 膜蛋白研究:定制脂质纳米盘修饰芯片(维持天然构象)
三大应用方向:SPR 如何解决科研关键问题?
1. 天然产物筛选:从复杂提取物到活性单体的“精准捕捞”
传统筛选靠“大海捞针”,SPR 实现“靶向垂钓”,核心流程为:“靶蛋白固定 → 提取物初筛 → 活性单体验证 → 结合动力学表征”。
【经典案例:飞燕草素降尿酸活性成分的筛选与验证】
1. 实验设计:以尿酸生成关键酶黄嘌呤氧化酶(XO)为靶蛋白,通过胺偶联法固定于CM5芯片,红腰豆提取物梯度稀释为分析物,设别嘌醇(阳性)及无活性黄酮(阴性)对照;
2. 筛选过程:SPR监测发现提取物中某组分与XO结合响应值(RU)显著高于阴性对照且呈浓度依赖性,经“SPR结合-质谱联用”鉴定为飞燕草素-3-葡萄糖苷(Dp-3G);
3. 验证结果:Dp-3G与XO结合稳定(KD=0.32μM、kd=1.2×10-3s-1);突变XO的FAD活性位点后结合信号降92%,证实其靶向该位点抑制活性,与酶活实验一致。
【核心价值:SPR实现“活性筛选-成分鉴定-靶点验证”一体化,较传统ELISA省去小分子标记,可区分“结合活性”与“抑制活性”,减少假阳性。】
2. 药物靶点验证与关键氨基酸位点解析:锁定互作的“分子钥匙”
SPR 是靶点验证的“最终判官”,常与 Pull-down、定点突变联用,核心逻辑为:初筛候选靶点 → SPR 验证直接结合 → 突变体定位关键位点。
【经典案例:GENI靶向AMPK的靶点验证及结合位点解析】
1. 靶点验证:经DARTS、CETSA初筛预测AMPK为栀子衍生物GENI潜在靶点后,SPR验证显示:AMPKα/γ二聚体与GENI直接结合(KD=1.07μM),亲和力优于阳性对照AICAR(KD=2.31μM);
2. 关键位点定位:构建AMPK丙氨酸扫描突变体,SPR检测结合活性筛选关键结合位点;
3. 结论:AMPKα亚基Asp148、Asp157及γ亚基Lys148、Lys309为GENI结合关键位点,突变后结合活性丧失70%以上,为结构优化提供依据。
3. 膜蛋白-小分子互作:突破“固定即失活”的技术瓶颈
膜蛋白占人类蛋白的 1/3、药物靶点的 60%,但体外易失活、难纯化,互作研究受限。传统SPR固定(如物理吸附)易破坏构象,中科院团队开发的新技术完美解决这一问题。
【经典案例:膜蛋白SPR固定新策略及互作分析】
▶ 创新方案:将 SpyTag 融合到膜支架蛋白(MSP)上,与目标膜蛋白共组装成脂质纳米盘;芯片表面预先固定 SpyCatcher,通过两者共价结合实现膜蛋白的近生理环境固定。
▶ 应用效果:成功测定 3 类膜蛋白互作(蛋白 - 磷脂、跨膜蛋白 - 抗体、跨膜蛋白 - 小分子),获得高质量动力学数据,为 GPCR 等难研究膜蛋白的药物开发提供可能。
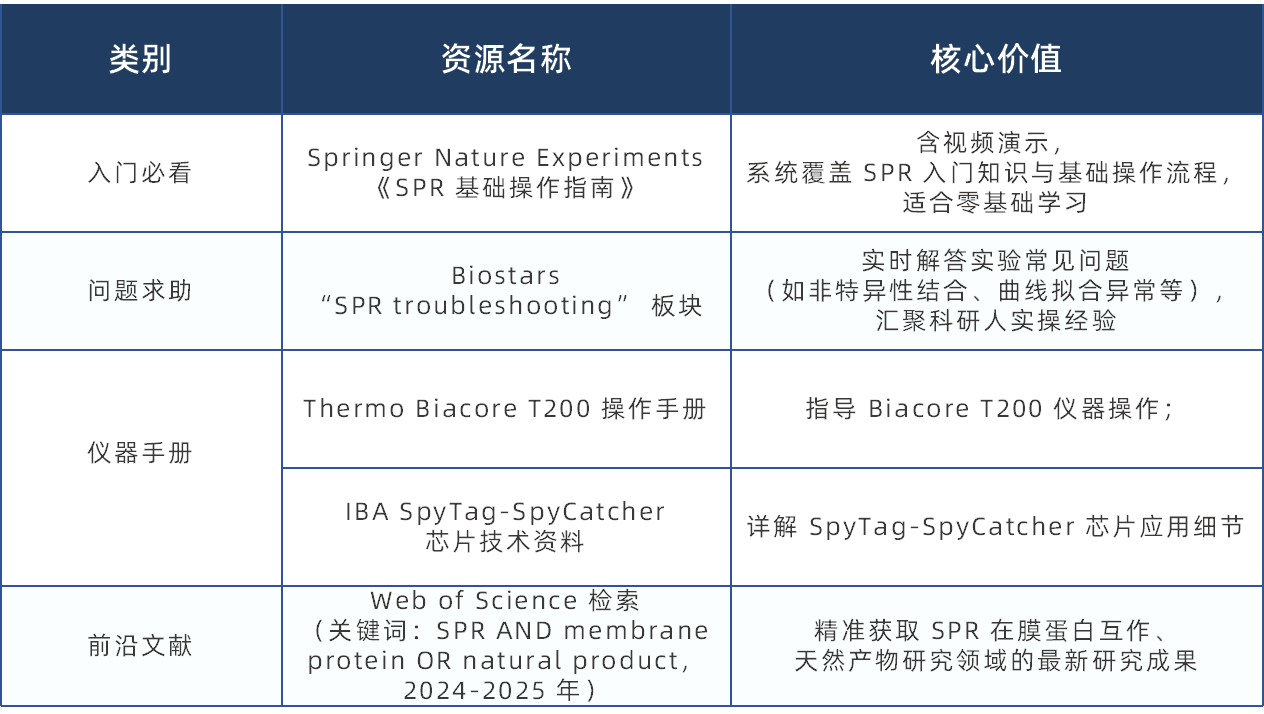
SPR 的进阶学习资源
结语
SPR技术绝非单纯的“检测工具”,而是贯穿药物研发全链条的“核心枢纽”——从天然产物中精准“钓取”活性单体(如Dp-3G),到锁定药物与靶点的关键互作位点(如GENI与AMPK的结合位点),再到打破膜蛋白研究的“固定即失活”瓶颈,它以“无标记干扰、实时动态追踪、定量精度可靠”的独特优势,让微观分子间的“隐秘互动”转化为清晰可辨的结合曲线。
对于科研人而言,掌握SPR不仅要吃透“共振原理”,更要深谙实操中的细节把控——从芯片选择的适配性到再生液的浓度调试,从数据拟合的模型选择到非特异性结合的抑制技巧,每一步都藏着提升实验效率的关键。希望小谱梳理的的这份应用案例与实操要点,能成为大家实验中的“避坑指南”。
若你在 SPR 实验中遇到过棘手的非特异性结合问题、膜蛋白固定难题,或是有独特的实验技巧想分享,欢迎在评论区留言交流!
主要参考资料
[1] Schasfoort, Richard B M, editor. Handbook of Surface Plasmon Resonance. Royal Society of Chemistry, 2017. https://doi.org/10.1039/9781788010283
[2] Chen Y, Jiang Y, Huang L, et al. Urate-lowering effect of delphinidin-3-glucoside in red kidney beans via binding to the FAD site of the XO enzyme. J Adv Res. Published online April 18, 2025. doi:10.1016/j.jare.2025.04.022
[3] Homola J. Surface plasmon resonance sensors for detection of chemical and biological species. Chem Rev. 2008;108(2):462-493. doi:10.1021/cr068107d
[4] Liu Y, Jiang JJ, Du SY, et al. Artemisinins ameliorate polycystic ovarian syndrome by mediating LONP1-CYP11A1 interaction. Science. 2024;384(6701):eadk5382. doi:10.1126/science.adk5382
[5] Wang Y, Li L, Chen D, et al. GENI as an AMPK Activator Binds α and γ Subunits and Improves the Memory Dysfunction of Alzheimer's Disease Mouse Models via Autophagy and Neuroprotection. Antioxidants (Basel). 2025;14(1):57. doi:10.3390/antiox14010057
[6] Yan L, Zhu C, Dong Y, Zhao H, Wu B, Wang J. A Robust Immobilization Method for Membrane Protein SPR Assays Using SpyCatcher-SpyTag. Anal Chem. 2025;97(36):19466-19471. doi:10.1021/acs.analchem.5c01671
