Nature Immunology | 人类皮肤成纤维细胞单细胞和空间转录组图谱揭示不同组织中与疾病相关的成纤维细胞亚型的共性
2025年9月《Nature Immunology》在线发表了一篇题目为A single-cell and spatial genomics atlas of human skin fibroblasts reveals shared disease-related fibroblast subtypes across tissues的研究,通过整合单细胞转录组和空间转录组(Visium, Xenium)技术,整合超过35万个高质量单细胞+空间转录组,构建了迄今为止最全面的人类皮肤成纤维细胞图谱,涵盖健康皮肤和23种皮肤疾病,并首次揭示了跨组织保守的疾病相关成纤维细胞亚型。

一、研究背景与意义
成纤维细胞(Fibroblast)是结缔组织中最核心的基质细胞类型,决定了组织结构、力学特性及免疫微环境的稳定性。长期以来,成纤维细胞异质性难以解析,主要受限于以下问题:
缺乏特异性表面标志物,难以在组织层面准确分辨不同亚群;
体外培养易诱导激活表型,无法反映真实组织状态;
现有单细胞研究多集中于健康皮肤,缺乏跨疾病与空间信息。
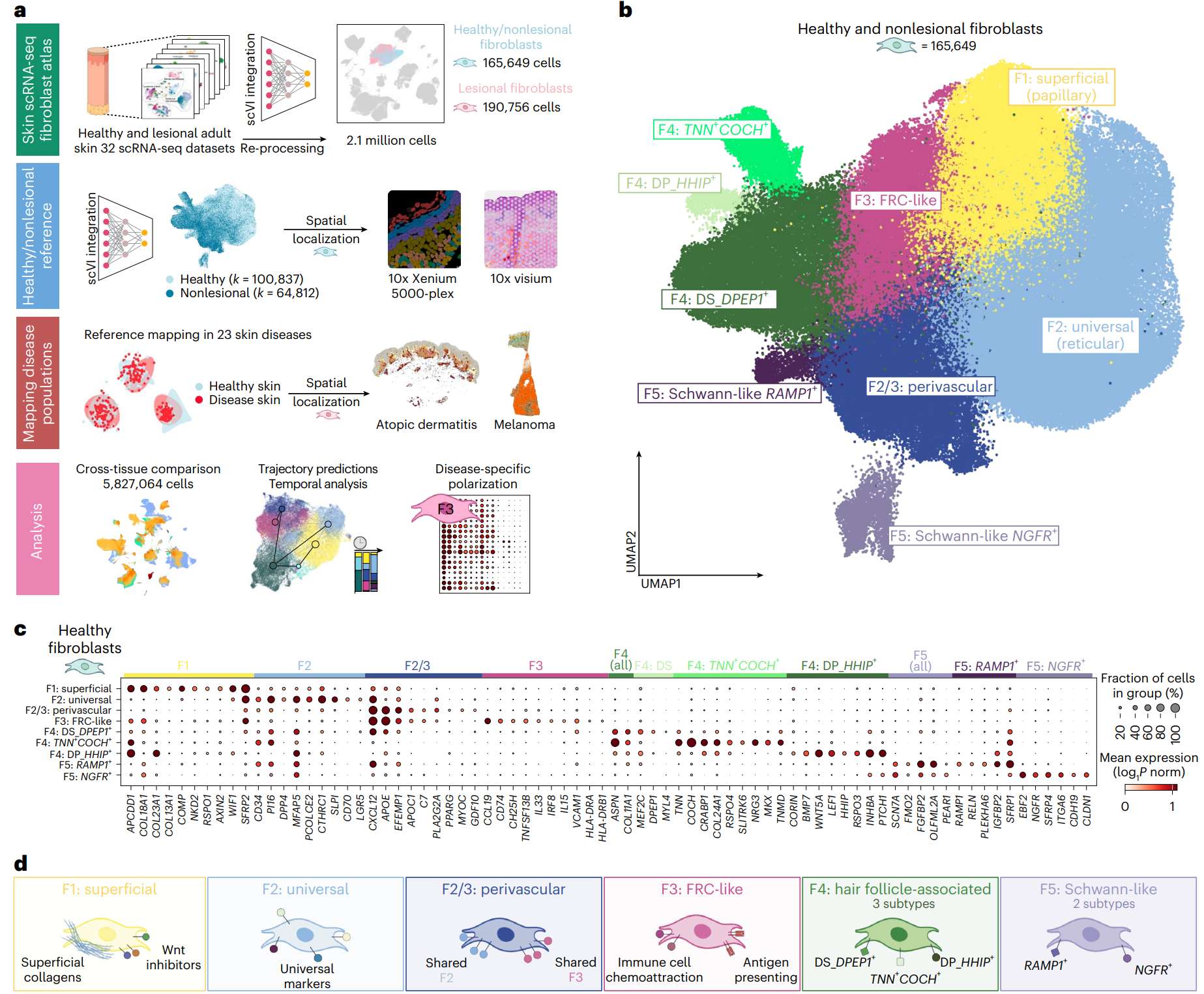
本研究由英国Sanger研究所团队主导,通过整合 32个scRNA-seq数据集 与 10x Visium及Xenium空间转录组数据,构建了一个高分辨率的皮肤成纤维细胞图谱。研究首次系统刻画:
健康皮肤中六大主要成纤维细胞亚型及其空间分布;
疾病状态下的亚型重塑与谱系转换规律;
跨组织保守的免疫相关成纤维细胞亚群。
该研究的最大创新在于:将单细胞表达谱与空间定位、疾病分层、跨组织对比有机结合,形成了皮肤及多组织成纤维细胞的统一命名体系。
二、研究设计与分析框架
研究通过“单细胞-空间转录组-跨组织整合”的多层分析路线完成。
单细胞层面:采用 scVI(single-cell Variational Inference)实现不同来源数据的批次校正与降维整合。
疾病映射:使用深度学习模型 scPoli,将疾病样本的细胞状态映射至健康参考图谱,以识别新亚型。
空间验证:Visium用于宏观组织结构定位,Xenium用于单细胞级空间精度验证。
跨组织整合:汇总皮肤、肺、肠、滑膜、子宫内膜、心脏等组织数据(共580万细胞)进行系统比较。
关键结果与功能解析
| 亚型 | 特征基因 | 组织定位 | 功能与意义 |
|---|---|---|---|
| F1: Superficial (表浅型) | COL13A1, APCDD1, WIF1 | 乳头层紧邻表皮 | 抑制Wnt信号,维持表皮稳态与再生潜能 |
| F2: Universal (网状型) | PI16, CD34, MFAP5 | 真皮深层、胶原间隙 | 前体样状态,广泛存在于多组织中 |
| F3: FRC-like (类网状细胞) | CCL19, CXCL12, HLA-DRA | 血管周围免疫区 | 支持免疫细胞定位,具抗原呈递能力 |
| F4: Hair follicle-associated | ASPN, COL11A1 | 毛囊周围 | 参与毛囊周期调控与真皮乳头形成 |
| F5: Schwann-like | NGFR, RAMP1 | 神经末梢附近 | 与施旺细胞互作,可能感应神经信号 |
| F2/3: Perivascular | PPARG, CD34 | 深层血管周围 | 兼具脂肪生成潜能与血管支持功能 |
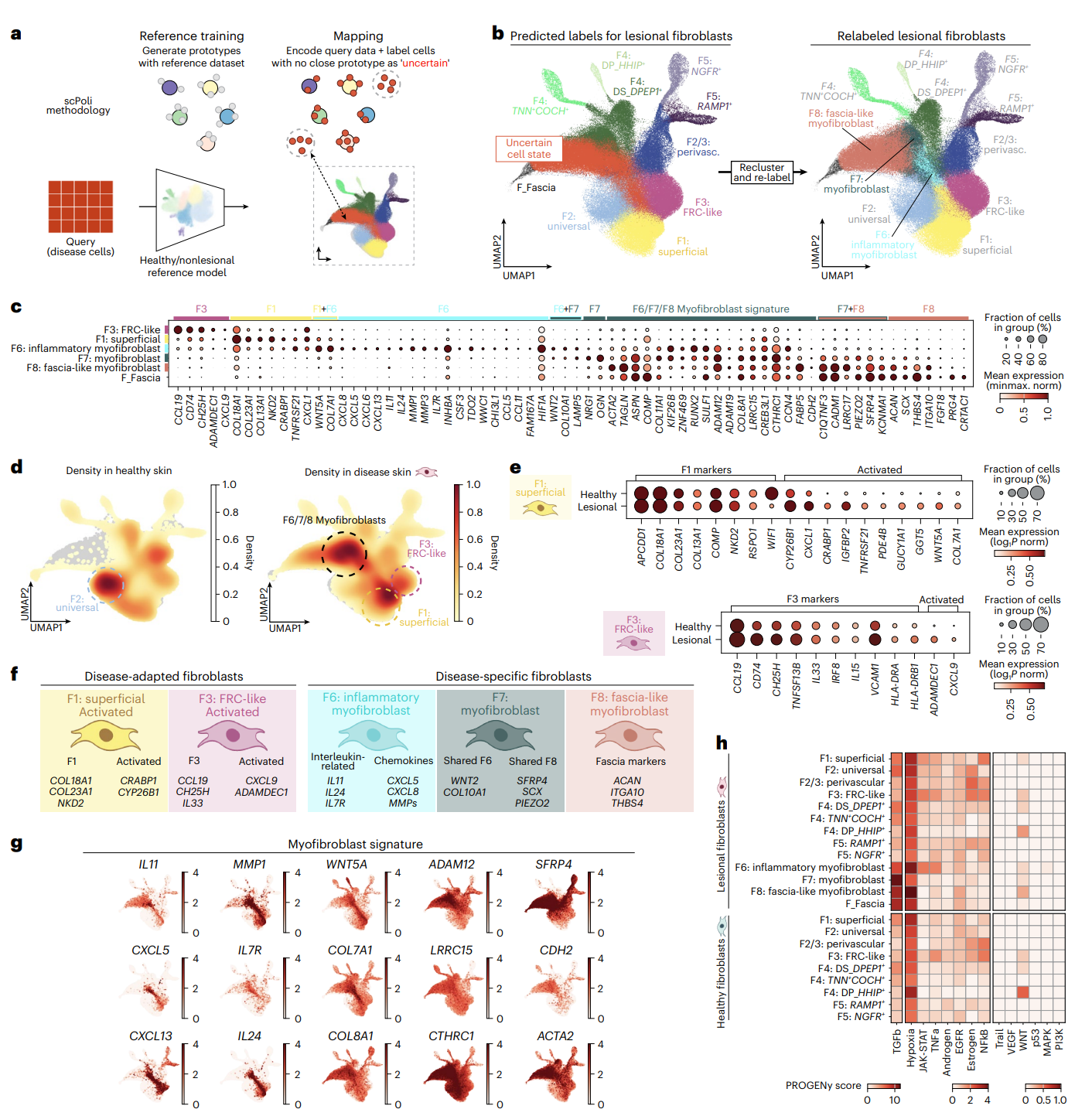
疾病状态下的成纤维细胞重塑
分析方法:scPoli深度映射
研究者使用 scPoli 模型将 23 种皮肤疾病样本的细胞状态映射至健康图谱,发现约三分之一细胞无法匹配已知亚型,提示疾病引起新的细胞谱系形成。
新亚型的识别(F6–F8)
| 亚型 | 特征基因 | 功能特征 | 相关疾病 |
|---|---|---|---|
| F6: Inflammatory myofibroblast | IL11, MMP1, CXCL8, IL7R | 免疫细胞募集、组织重塑 | 炎症性疾病、早期瘢痕、肿瘤 |
| F7: Myofibroblast | ACTA2, COL3A1, POSTN | ECM沉积、纤维化执行 | 硬皮病、癌症基质 |
| F8: Fascia-like myofibroblast | LRRC15, PIEZO2, CTHRC1 | 与筋膜相关,机械敏感 | Dupuytren挛缩等纤维化疾病 |
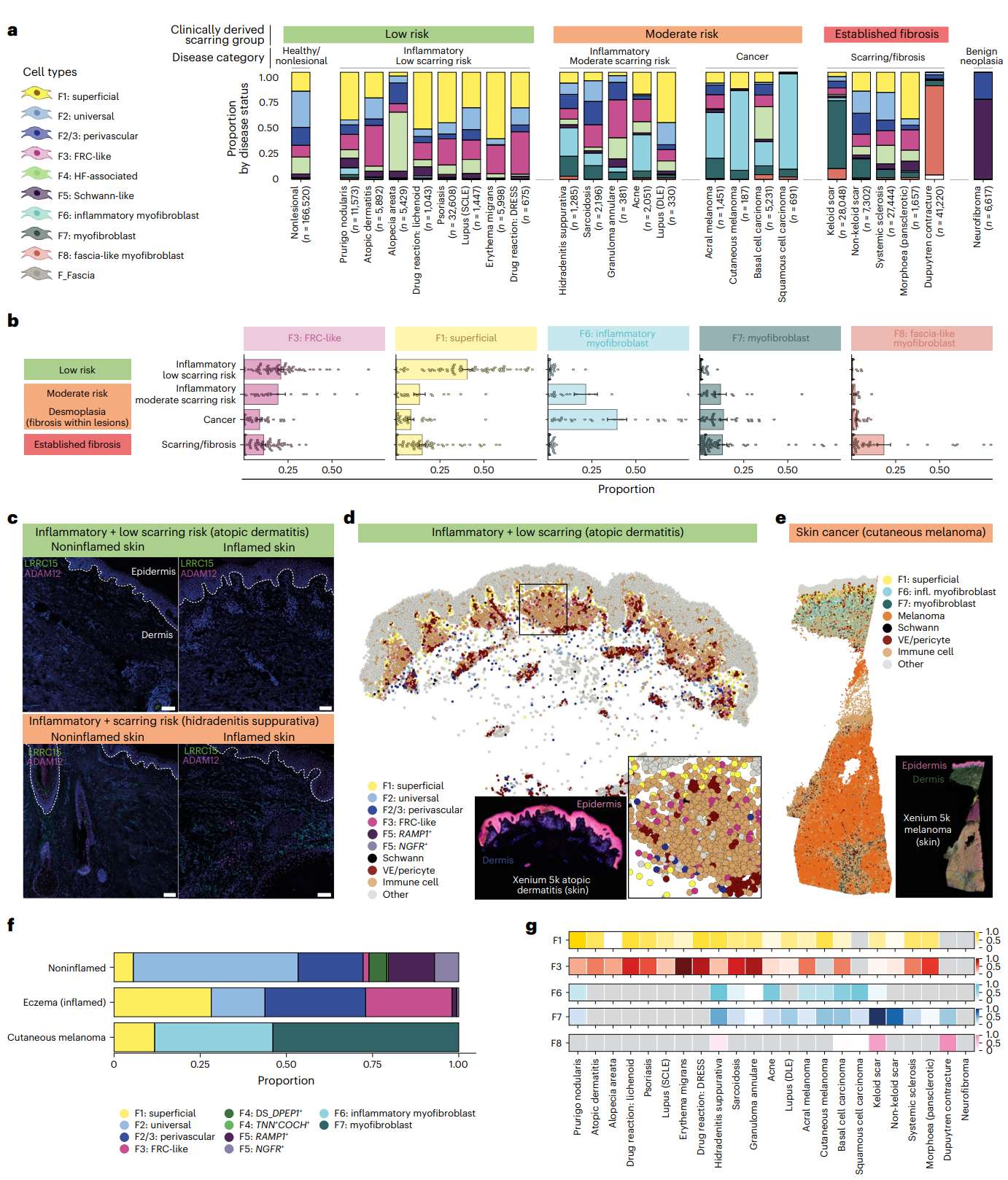
瘢痕风险分层与空间验证
研究将疾病分为三类:
低瘢痕风险:如特应性皮炎、银屑病;
中等风险:如黑色素瘤、肉芽肿病;
高风险(纤维化):如系统性硬皮病、Dupuytren挛缩。
不同类别中成纤维细胞比例明显不同:
F1/F3 占主导 → 组织可逆性高;
F6 激增 → 炎症向瘢痕转化;
F8 为终末纤维化细胞。
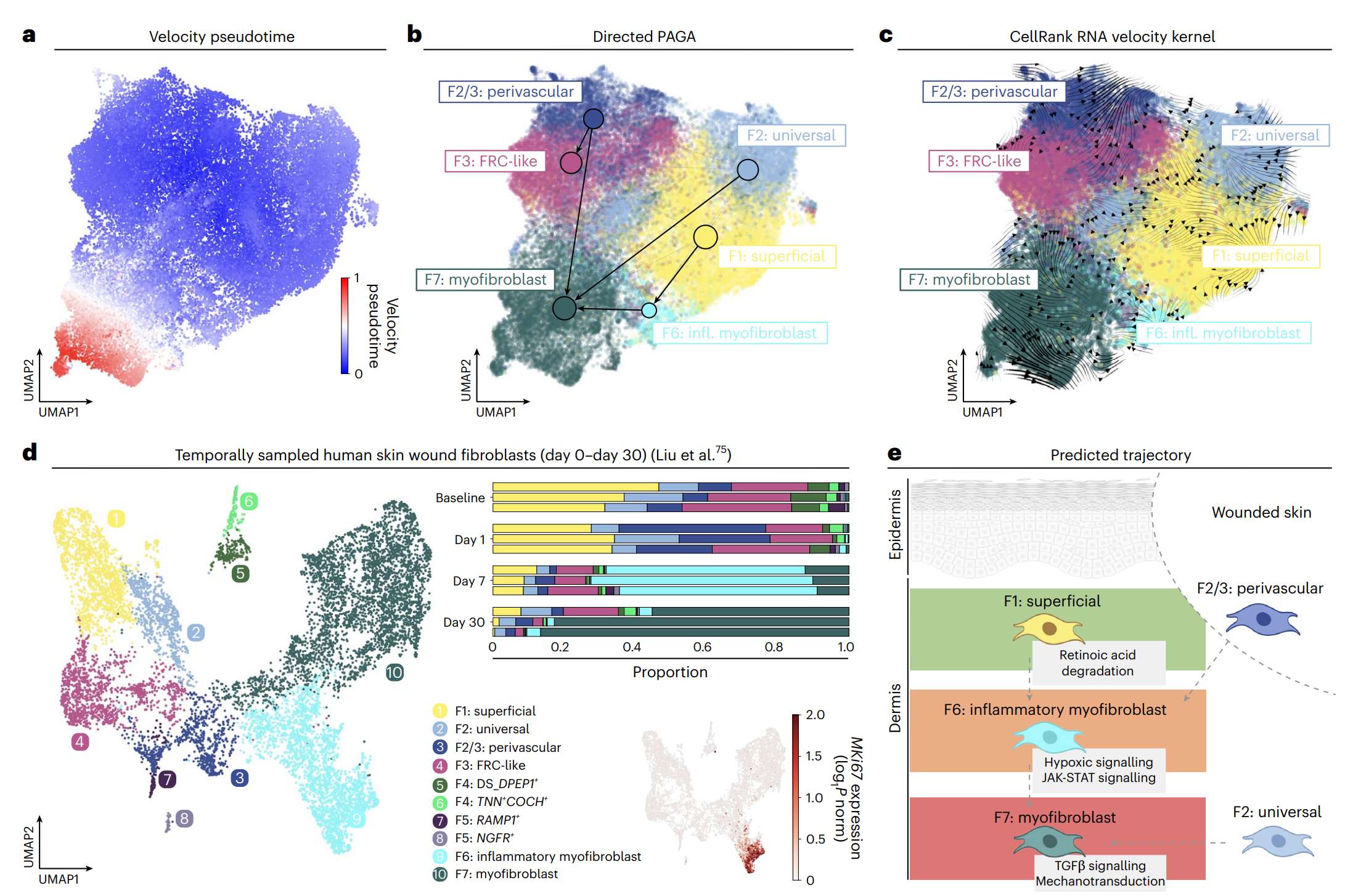
肌成纤维细胞的起源与分化轨迹
PAGA与RNA velocity揭示两条主要分化路线:
F2(universal)→ F7(myofibroblast)
F1(superficial)→ F6(inflammatory)→ F7
在人体创口愈合序列中:
Day 0:无肌成纤维细胞;
Day 1:少量F6炎症型出现;
Day 7:F6占主导;
Day 30:转化为F7成熟纤维化型。
跨组织保守性与系统炎症机制
整合皮肤、肺、肠、滑膜、子宫内膜、心脏等组织约580万细胞,重建跨组织成纤维细胞图谱。
结果显示:
F2、F3、F6、F7 为高度保守亚群;
F3(FRC-like)广泛存在于炎症组织(RA、IBD、COVID-19);
F6(Inflammatory myofibroblast)在癌症及早期纤维化中普遍富集;
跨组织共识表明:免疫相关成纤维细胞是多器官疾病的共性基质基础。

参考文献: Steele L, et al. (2025). Nature Immunology. DOI: 10.1038/s41590-025-02267-8
