【AI4S】AI设计小分子药物的三大底层逻辑
AI设计小分子药物的三大底层逻辑
- 一、类药性:AI如何破解“分子五规则”魔咒?
- 1. 传统困局:被规则束缚的创新
- 2. AI的破局之道:动态规则与数据驱动
- 二、ADMET预测:让药物少走90%的弯路
- 1. ADMET:临床失败的“隐形杀手”
- 2. AI的降维打击:从单维度到多模态
- 三、生成式模型:从“拼乐高”到“造生命”
- 1. 技术演进:从筛选到创造
- 2. 典型案例:速度与精准的突破
- 3. 创新突破:挑战不可能
- 结束语
传统药物研发像一场豪赌:耗资26亿美元、耗时10年,成功率却不足10%。但AI的加入,让这场赌博变成了“精算游戏”。2025年,全球AI辅助药物管线已占新药研发的35%,其中小分子药物占比超过60%。从辉瑞的AI优化新冠口服药,到英矽智能的全球首款AI抗纤维化药物获批临床,这场革命正以惊人速度重塑行业。今天,我们 从类药性、ADMET预测、生成式模型三大底层逻辑,揭开AI设计小分子药物的神秘面纱。
一、类药性:AI如何破解“分子五规则”魔咒?
1. 传统困局:被规则束缚的创新
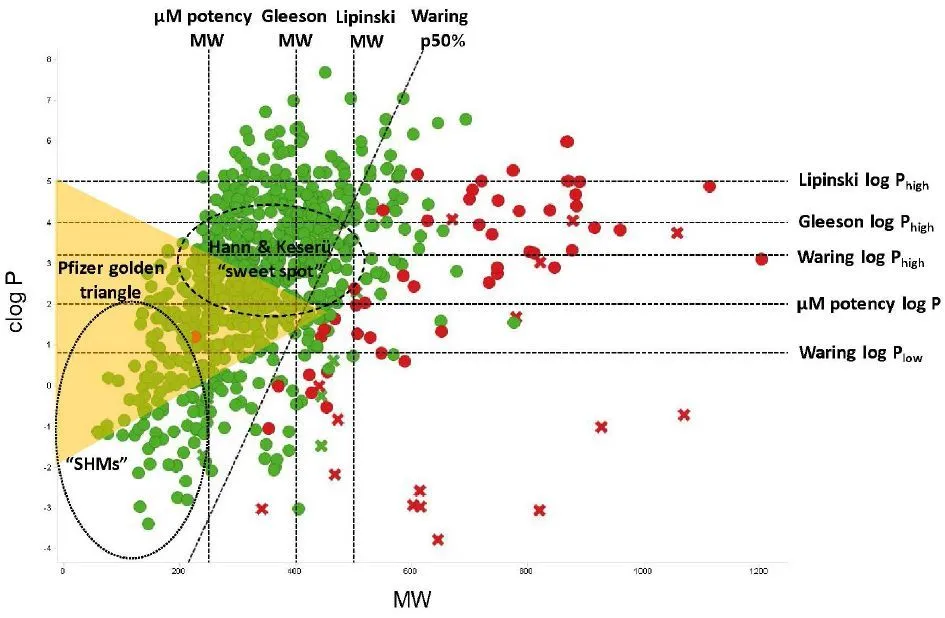
“类药五规则”(分子量<500、氢键供体<5等)曾是小分子设计的金科玉律,但现实却充满矛盾:
- 过度严苛:60%已上市药物违反至少一条规则。例如:
- 抗生素阿奇霉素(分子量749,超限50%)
- 抗癌药紫杉醇(氢键供体7个,超限40%)
- 创新受限:人类仅探索了0.001%的化学空间,99.9%的潜在分子从未被合成。
2. AI的破局之道:动态规则与数据驱动
AI通过分析10万+已上市药物数据,重新定义“类药性”:
- 动态权重:不同疾病领域适用不同规则。例如,抗感染药物允许更大分子量,而中枢神经药物需严格控制血脑屏障穿透性。
- 案例突破:英国Exscientia设计的A2A受体拮抗剂DSP-1181,违反3条规则(分子量530、氢键供体6个),但活性提升100倍,临床前研究仅耗时12个月。
“AI不是规则的奴隶,而是规则的优化者。它告诉我们:有效才是硬道理。”——Nature评论《AI制药的规则重构》
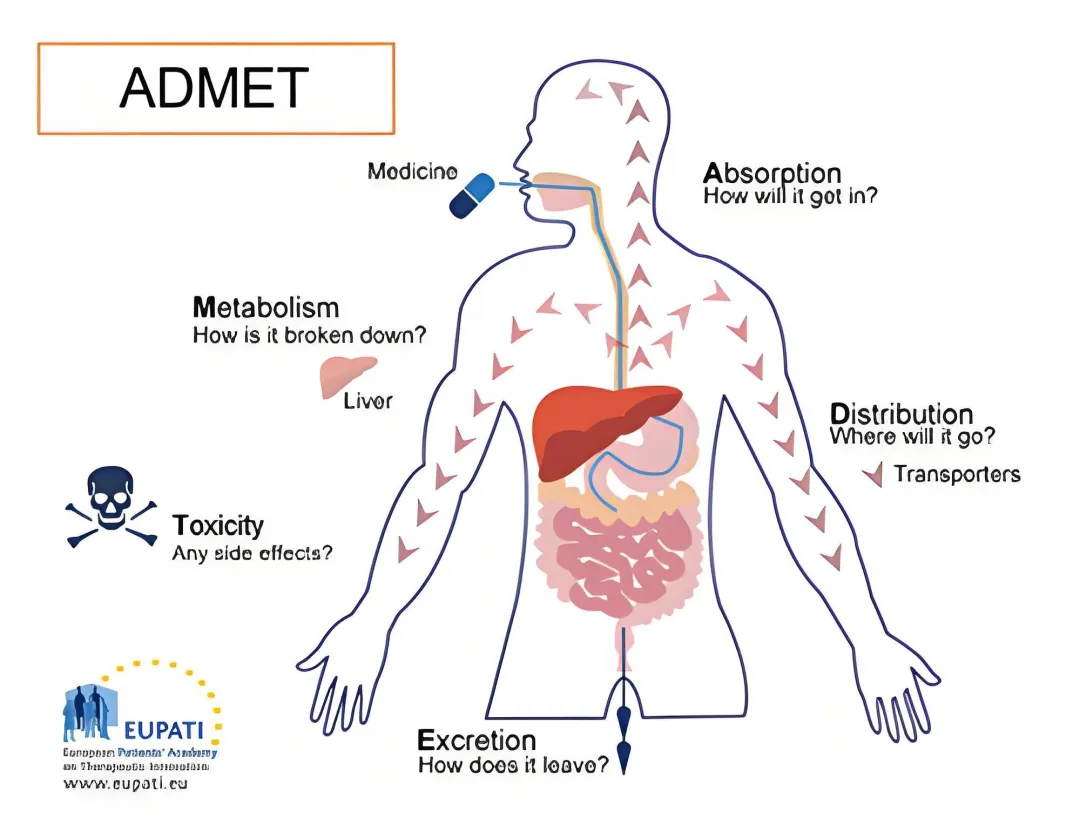
二、ADMET预测:让药物少走90%的弯路
1. ADMET:临床失败的“隐形杀手”
- III期淘汰率:40%药物因毒性(肝毒性、心脏毒性)或代谢问题失败。
- 传统试错成本:单次肝毒性实验耗资50万元,而AI预测成本仅需500元。
2. AI的降维打击:从单维度到多模态
AI通过整合多维数据,实现精准预测:
- 溶解度预测:晶泰科技开发的多模态模型,准确率高达92%(传统QSAR方法仅67%)。
- 心脏毒性预警:DeepMind的AlphaTox模型提前识别出3种上市药物的QT间期延长风险,避免潜在撤市危机。
- 跨物种代谢模拟:荷兰药物公司Merus利用AI预测分子在人体与动物模型的代谢差异,将临床前研究时间缩短40%。
“AI不是预言家,但它能告诉你哪些路大概率是死胡同。这是对资源的最大节约。”——FDA审评专家Peter Marks
三、生成式模型:从“拼乐高”到“造生命”
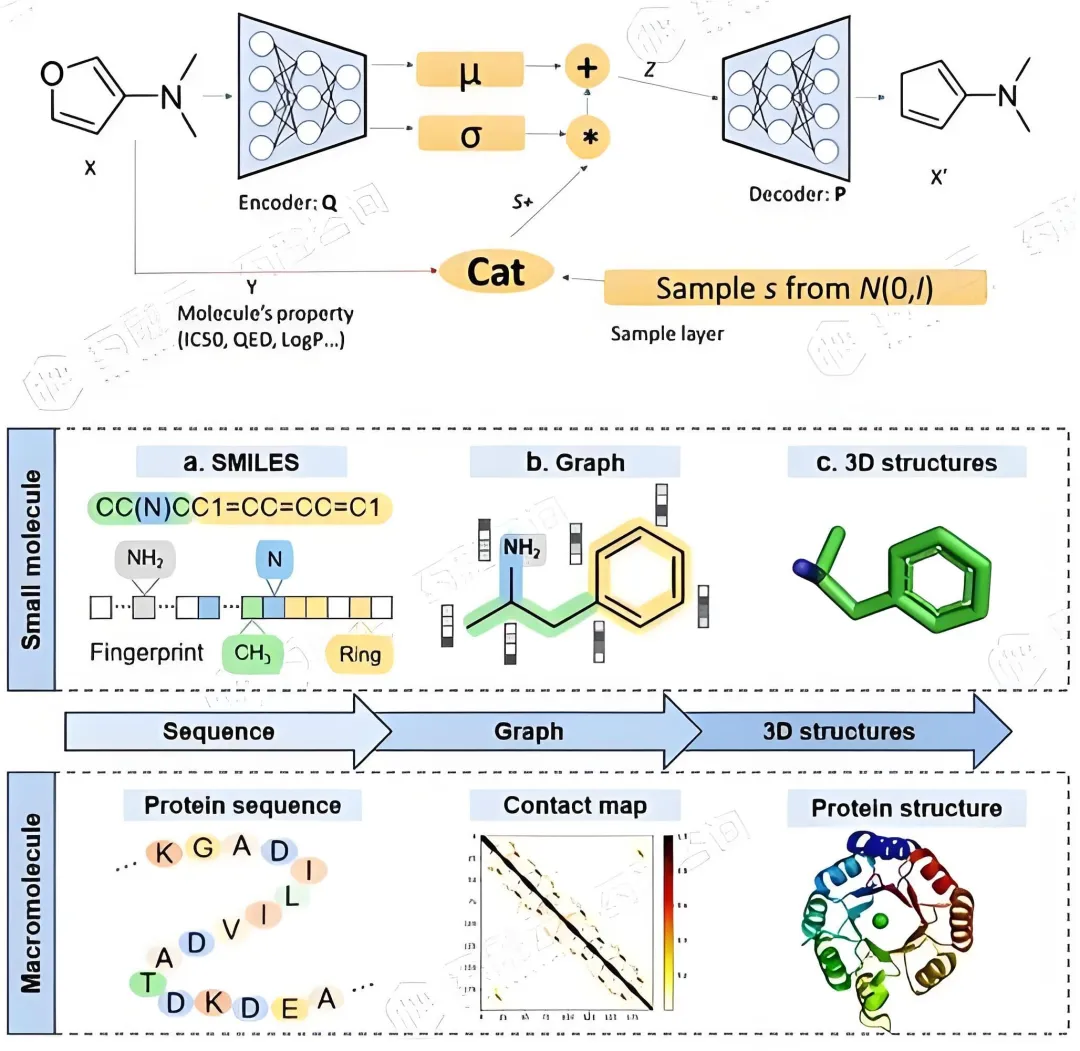
1. 技术演进:从筛选到创造
- 第一代虚拟筛选:在现有分子库中“大海捞针”,成功率不足0.01%。
- 第二代生成式设计:从零创造全新分子,成功率提升至5%-10%。
2. 典型案例:速度与精准的突破
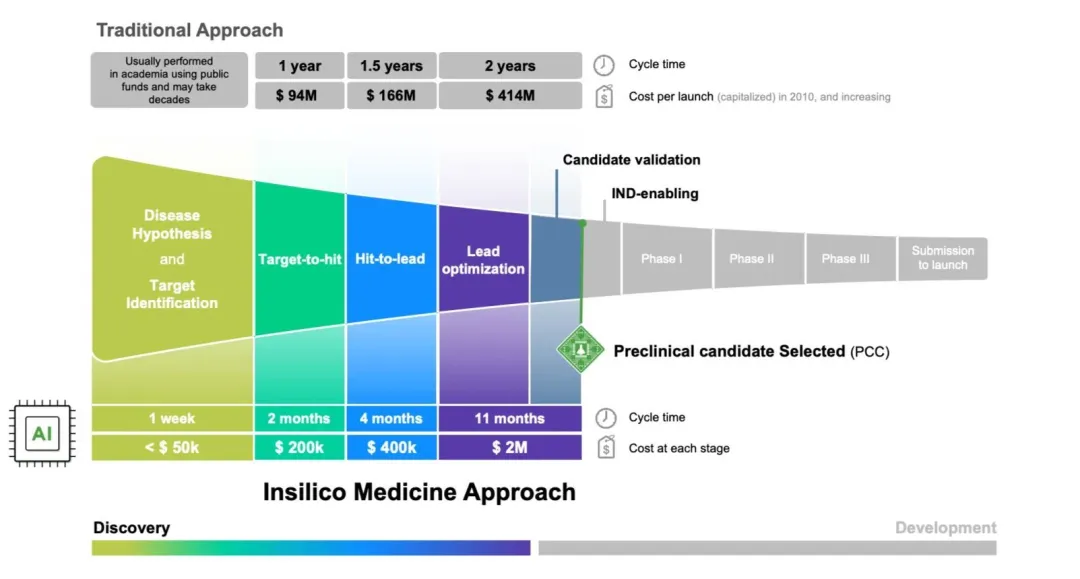
- 抗纤维化药物ISM001-055:英矽智能用GAN模型生成分子,从靶点发现到临床前候选化合物(PCC)仅用18个月,效率是传统方法的6倍。
- 新冠口服药Paxlovid优化:辉瑞通过生成模型改进分子溶解度,使生物利用度提升3倍,推动药物快速上市。
3. 创新突破:挑战不可能
- 靶点不可成药? 生成模型设计变构抑制剂,例如KRAS靶向药AMG 510,通过结合蛋白“隐秘口袋”实现精准打击。
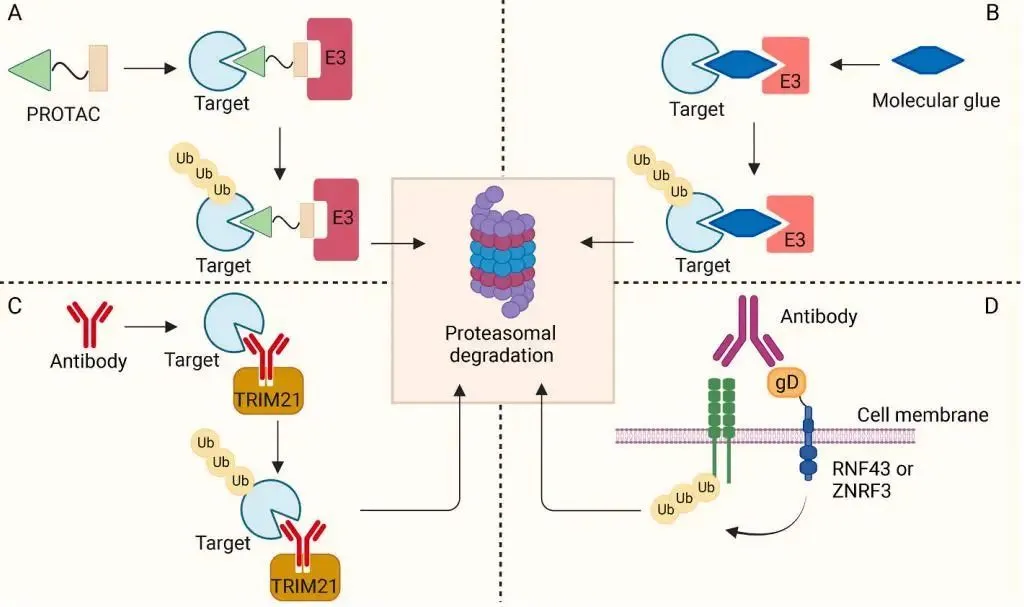
- 分子太大? 片段生长算法将PROTAC分子拆解为“靶向头+连接链+降解尾”,逐个模块优化后重组,解决传统合成难题。
当AI一年能设计1亿个分子,人类化学家的价值何在?答案或许是:从“操作工”变为“策略师”,专注提出更精妙的科学问题。
结束语
AI设计小分子药物的三大底层逻辑——类药性优化、ADMET预测、生成式模型——正在颠覆传统药物研发的每一个环节。无论是打破陈规的分子设计,还是精准的毒性预警,亦或是从零构建全新分子,AI不仅提升了效率,更拓展了人类探索化学空间的边界。这场革命或许没有终点,但它已为治愈更多疾病打开了希望之门。
