scRNA-seq还是snRNA-seq,如何选择
单细胞转录组测序技术如今已成为生命科学研究的重要工具,但面对scRNA-seq(单细胞转录组测序)和snRNA-seq(单核转录组测序)两种技术,许多科研工作者常常陷入选择困境。今天,我们就来深入解析这两种技术。
一、技术原理:
从“细胞”到“细胞核”的底层区别
1.scRNA-seq:直接捕获完整细胞的转录本
制备单细胞悬液,通过微流控芯片(如10xGenomics)或微孔板技术,将单个完整的活细胞(或悬浮的完整细胞)分离到独立反应体系中,裂解细胞膜后提取总RNA(主要是核内RNA+少量胞质RNA),反转录为cDNA并构建测序文库。
关键点:依赖细胞活性(需活细胞悬液),直接反映细胞整体的转录状态(包括胞质中的mRNA)。
2.snRNA-seq:聚焦细胞核内的转录本
制备单细胞核悬液,通过分离细胞核,裂解细胞核膜后提取核内RNA(主要是已转录但未输出到胞质的pre-mRNA及部分成熟mRNA),后续流程与scRNA-seq类似。
关键点:不依赖细胞活性(可用冻存样本),直接捕获细胞核内的转录本(更接近“基因表达的原始状态”)。
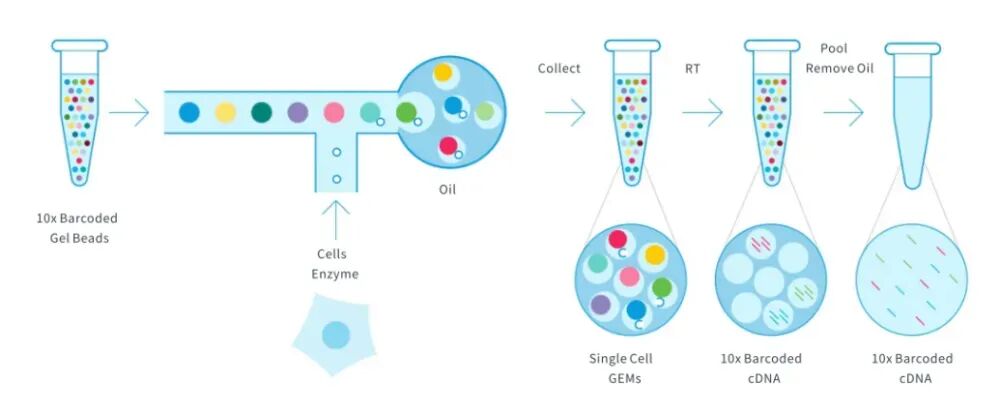
图1.10xGenomics scRNA-seq技术流程
二、核心差异对比:
从样本到数据的全面解析
scRNA-seq | snRNA-seq | |
样本要求 | 必须为新鲜/活性良好的单细胞悬液(细胞存活率>85%,有核率>85%,结团率<5%) | 新鲜/冻存组织(-80℃或液氮保存,避免反复冻融),核完整性>80% |
组织适应性 | 适合易解离的组织(如外周血、PBMC、部分肿瘤) | 更适合难解离的致密组织(如心脏、脑、肾脏、脂肪) |
细胞类型覆盖 | 易丢失脆弱细胞(如神经元、肌肉细胞、内皮细胞) | 可捕获传统方法难分离的细胞(如成熟神经元、心肌细胞) |
转录本代表性 | 反映核内RNA+胞质RNA(含成熟mRNA,更贴近“功能活跃”状态) | 主要反映核内RNA(含大量未剪接的pre-mRNA,可能包含更多“潜在表达信息”) |
数据质量 | 基因检出数通常更高,背景噪声较低 | 基因检出数略低,但细胞核分离可能引入碎片污染 |
技术挑战 | 细胞活性要求高,解离过程可能导致应激基因表达(如机械损伤诱导的炎症通路激活) | 细胞核分离可能混入线粒体DNA(需过滤),核内RNA剪接状态可能影响注释 |
成本与时效 | 样本需新鲜处理,实验周期较短 | 冻存样本可直接实验,但细胞核分离步骤可能增加耗时 |
三、如何选择?
按研究场景匹配技术方案
场景1:优先选scRNA-seq的情况
样本条件:有新鲜获取的活性良好的组织(如外周血、肿瘤活检样本、部分上皮组织),且细胞活性>85%,有核率>85%,结团率<5%;
研究目标:关注细胞的功能状态(如免疫细胞活化、肿瘤细胞代谢重编程)、需要高基因检出数以区分亚群(如PBMC中的稀有细胞类型);
组织特性:组织易解离(如血液、淋巴组织),且目标细胞对机械/酶解离耐受性好(如B细胞、T细胞);
典型应用:免疫微环境分析(如肿瘤浸润淋巴细胞)、循环肿瘤细胞(CTC)研究、快速响应的临床样本(如手术切除组织的即时检测)。
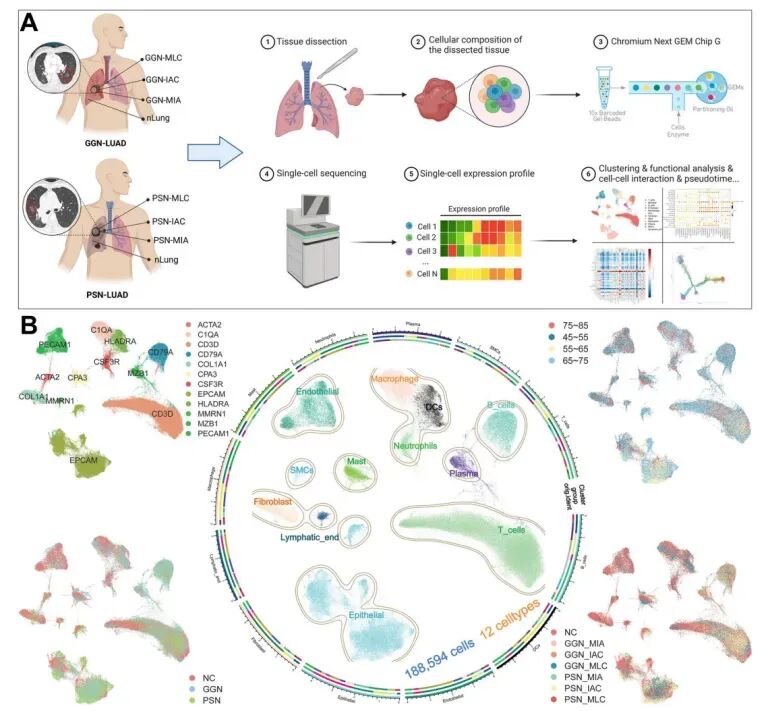
图2.scRNA-seq描绘肺腺癌患者肿瘤与邻近组织的细胞图谱
Ren Y F, Ma Q, Zeng X, et al. Molecular Cancer, 2024.
场景2:优先选snRNA-seq的情况
样本条件:只有冻存组织(如临床手术标本库的长期保存样本)、难解离的致密组织(如心脏、脑、肾脏)、或样本处理可能导致细胞死亡(如低温保存的样本);
研究目标:避免解离导致的细胞应激(如神经元在解离过程中易死亡),需捕获传统方法难分离的细胞(如成熟神经元、心肌细胞、脂肪细胞);
组织特性:组织结构复杂(如脑组织含大量胶质细胞和神经元)、或细胞体积大(如心肌细胞、骨骼肌细胞)导致物理解离困难。
典型应用:神经系统研究(如人脑单细胞图谱)、心血管疾病(心肌细胞特异性分析)、发育生物学(胚胎组织冻存样本回顾性研究)。
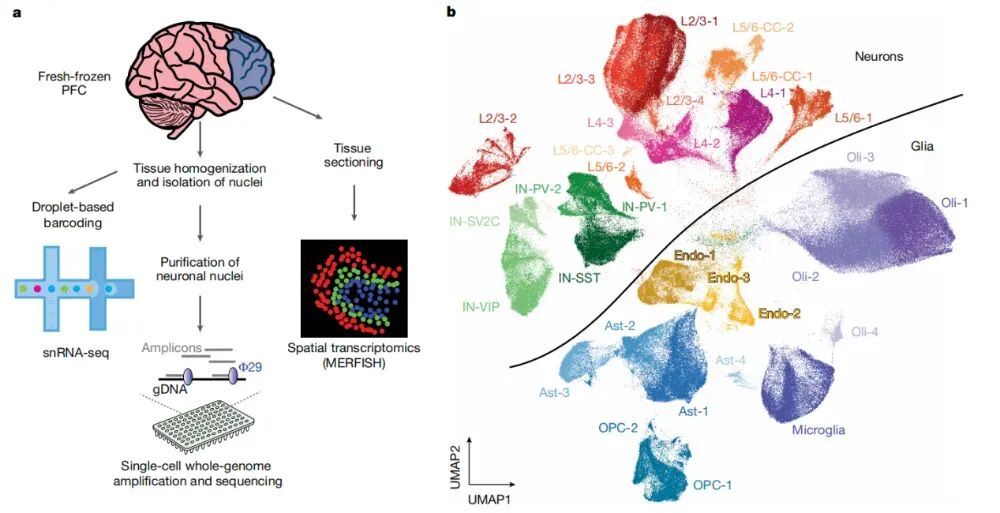
图3.snRNA-seq揭示人类前额叶皮层(PFC)细胞亚群的分子特征
来源于Jeffries, A.M., Yu, T., Ziegenfuss, J.S. et al. Nature (2025).
特殊情况的补充建议
混合使用:若研究涉及多种组织(如同时分析血液和脑组织),可对易解离部分用scRNA-seq,难解离部分用snRNA-seq;
技术验证:当目标细胞类型在两种技术中的比例差异显著时(如scRNA-seq中神经元检出极少,而snRNA-seq中丰富),建议通过荧光原位杂交(FISH)或免疫组化验证关键结论;
新兴技术:若实验室具备空间转录组(如Visium、Stereo-seq)条件,可结合scRNA-seq/snRNA-seq实现“单细胞转录组+空间定位”的深度解析。
四、实战建议
对于大多数研究,我们建议:
如有条件,可同时进行两种方法的预实验比较;
根据样本可用性和研究目标做出选择;
考虑与已有研究的数据可比性。
没有绝对优越的技术,只有更适合研究需求的选择。希望本文能为您的单细胞研究之路提供指引!
爱基百客拥有10+年表观遗传学研究服务的经验,我们的表观组学和单细胞测序平台技术已十分完善。我们的服务范围涵盖实验设计、样本处理、数据分析到验证的全流程,旨在为客户提供全面、专业的技术支持。如有需求,欢迎随时联系我们,我们期待为您的科研工作助力!
