光场显微镜及其在三维生物成像中的应用
欢迎关注GZH《奕目光场视觉》
摘要:光场显微是一种具有大视场、快速三维成像能力的计算光学显微技术,在生物动态观测中具有极大的应用前景。本文使用基本光学元件设计搭建了光场显微镜,可供光学工程、生物医学工程等专业的学生拆装练习,从而加深对光场显微原理和系统结构的认识。通过对荧光微球以及斑马鱼血管的三维成像,展示了光场显微系统的性能。
关键词 光场显微镜;三维成像;生物成像
自从 2014 年诺贝尔化学奖被授予荧光蛋白的发现之后,荧光显微成像技术已成为当前生物医学研究的必备手段。其中,三维快速显微成像技术在生物动态观测中有着迫切需求,近年来得到迅速发展。光场显微镜是一种仅需单次曝光再经后期计算处理即可实现三维重构的新型光学显微技术,具有结构简单、成本低廉等优点,是《生物光子学》等相关课程的重要教学内容。但是,目前光场显微镜尚未商业化,不利于开展实验教学。本文结合作者在清华大学《神经光子学》课程的教学实践[1],介绍了光场显微镜的原理、设计方法、系统结构及其生物医学应用。通过自行设计、搭建光场显微镜供光学工程、生物医学工程等专业的学生拆装练习,有利于同学们加深对光场显微镜原理及系统结构的认识。此外,本文将所搭建的光场显微镜应用于荧光微球以及斑马鱼血管成像,展示了其系统性能。
1 光场显微镜的原理与演变
光场成像最先应用于宏观成像领域。它通过在成像光路的中间像面处放置针孔阵列或微透镜阵列来同时记录成像光的强度与角度信息,进而还原出物空间的三维结构[2]。
2006 年,LEVOY 等人[3]首次将光场成像技术应用于显微成像,通过在传统的宽场显微镜的中间像面处放置微透镜阵列,并将相机放置于微透镜阵列的后焦面上,改装出了第一台光场显微镜。相较于其他先进显微镜,光场显微镜由于无需扫描成像即可计算重建出三维图像,在生物动态观测领域有着极大的应用前景。但是,当前光场显微镜仍存在空间分辨率差、对比度低、背景强等问题。为了提高空间分辨率,2013 年 Broxton 等人[4]提出基于波动光学模型的去卷积算法,相较于传统的数字重聚焦算法,实现了高空间分辨率的三维重构,但采用该方法在焦面附近存在较强的重构伪影。近期,人们又发展了傅里叶光场显微镜[5],可有效地避免该伪影。此外,由于光场显微镜继承了宽场激发的特点,景深外区域的激发信号会影响景深区域内重构结果的对比度与准确性。为了消除背景、提高对比度与准确性,人们发展出与各种选择性激发技术结合而成的光片光场显微镜[6]、共聚焦光场显微镜[7]等,有效地消除了景深外信号的干扰,进一步提高了光场显微镜的性能。近年来,光场显微镜在以三维神经网络活动观测为代表的生物医学研究中发挥了重要作用。
2 光场显微镜的结构与设计
2.1 光场显微镜的结构
如图 1 所示,光场显微镜的工作光路如下:激发光经过激发端滤光片后通过二向色镜反射,再经过物镜(20×, 0.5NA, Plan Fluor 20×,Nikon)聚焦在生物样本上。激发光路调节为柯勒照明,均匀激发样本中的荧光蛋白,产生荧光信号。所发射的荧光信号经物镜收集,再经二向色镜与发射端滤光片后,到达三目镜(U-TR30-2, OLYMPUS)中的管透镜(f = 180mm),再经中继系统(f1 = 30mm, AC254-030-A, Thorlabs;f2 = 50mm,AC254-050-A, Thorlabs,用于匹配微透镜与物镜的 F 数)、微透镜阵列(MLA150-5C, dm = 150μm, fm = 5.2mm, Thorlabs)成像在处于微透镜后焦面的 CMOS 相机(DCC1240M,1024×1280 像素,像素尺寸:4.65μm,Thorlabs)上。
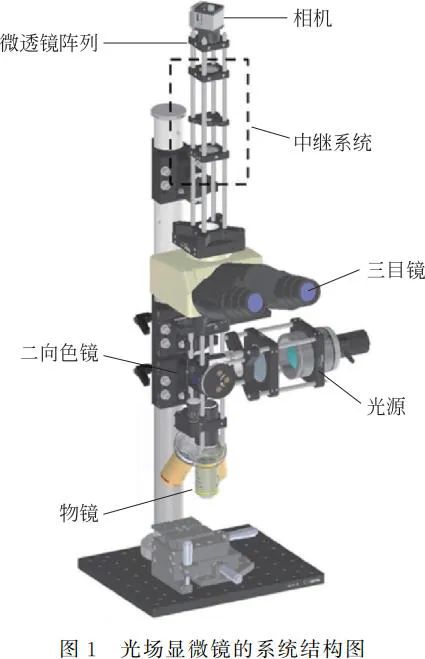
考虑到当前生物医学研究中广泛使用黄色荧光蛋白(YFP)与绿色荧光蛋白(GFP)标记的生物样本,本文选择了可激发上述两种荧光蛋白的蓝色 LED 光源(M470L3-C1, Thorlabs)作为照明光源(发射中心波长为 470nm),并选择相应的滤光片套装(MDF-YFP,Thorlabs)。
2.2 光场显微镜的设计
光场显微镜的视场、景深、分辨率与物镜、管透镜、微透镜阵列、探测器等核心器件密切相关[8]。下面依据采用数字重聚焦方法进行三维重建时可获得的理论性能进行说明。
光场显微镜的视场 FOV 由物镜的放大倍率 M 以及系统中最小孔径光阑的直径 d 决定。通常取相机靶面尺寸为 d1、d2。其数学形式为
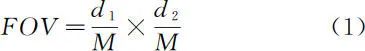
光场显微镜的横向分辨率 ε 等于微透镜阵列子孔径 dm 与物镜放大倍率 M 的比值

角度采样数 N 即为 ε 与物镜衍射极限的比值。通过扩展几何景深,光场显微镜的景深 DOF 变为
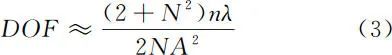
其中,NA 为物镜的数值孔径,n 为介质折射率,λ 为发射荧光波长,N 为微透镜阵列子孔径在每个方向上的角度采样数。
在光场显微镜成像景深范围内,通过数字重聚焦方法可区分不同深度下的信息,其轴向分辨率 Δ 为
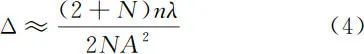
此外,物镜与微透镜的F数需匹配,即
N f-numbers-MLA = N f-numbers-OBJ (5)
如果微透镜的 F 数过大,则会造成串扰;如果微透镜的 F 数过小,则浪费了相机的靶面面积。
若采用去卷积算法进行三维重建,在相同的条件下,通常会获得 2~4 倍更高的横向分辨率[2]。
在实际使用时,用户应结合待观测目标的实际需求来设计、选择合适的光学器件。例如,本文的设计目标为观测幼年斑马鱼的三维血管网络,由文中所列器件参数计算可得设计视场约 192μm×152μm,景深约 98μm,横向分辨率约 5μm,轴向分辨率约 12μm,可满足实验观测需求。
3 光场显微镜的三维重构方法
如前所述,光场显微镜中三维图像的获得是通过将所记录的强度与角度信息进行计算重建。目前,光场显微成像的三维重构算法主要有数字重聚焦[3]和去卷积[4]两种算法。
3.1 数字重聚焦算法
在光场显微成像中,每个微透镜后的每个像素,分别为该微透镜所对应物空间的某个特定视角的像。因此,将每个微透镜后对应的视角提取出来即可表示一幅特定视角下所成的子图像。不同子图像间的差异体现了物空间的三维信息。
如图 2 所示,在使用数字重聚焦算法进行三维重构时,需要首先对原始图像进行视角提取。离焦物点在子图像 L(u,v)(s,t) 中的位置 (s,t) 会随视角 (u,v) 变化而变化。将所有视角图像按照相应的离焦距离 z 进行平移求和运算即可获得对焦在离焦距离 z 处的图像,算法如(6)式
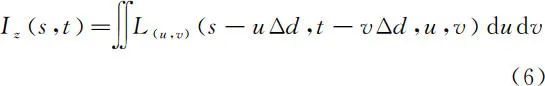
其中,Δd 为离焦距离 z 的物点在相邻两视角下的子图像中位置之间的偏差。
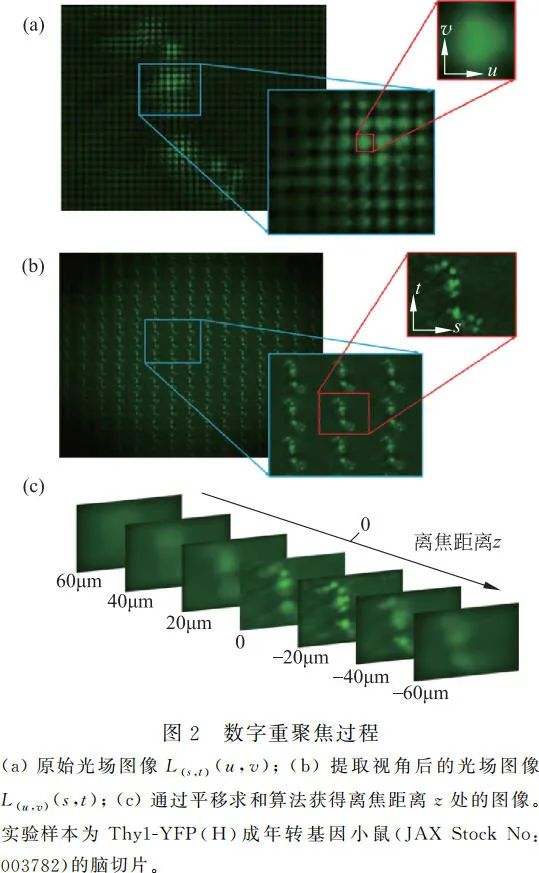
该算法的重建速度很快,但是由于子图像中单像素对应的空间采样尺寸较大(例如此实验中为 5μm),系统的空间分辨率较低。
3.2 去卷积算法
去卷积算法的核心是建立与实际系统相匹配的光学模型,从而计算出包含三维物空间中任意位置处经过光学系统的点扩散函数的测量矩阵 H。成像模型可描述为
f = Hg + b (7)
其中 f 为像面上的强度分布,g 为物空间分布,b 为背景信号。通过使用理查德森露西迭代算法对物空间分布 g 进行最大似然估计,可得三维重建图像。具体迭代算法为
g (k+1) = diag ( HT1 )-1.
diag ( HTdiag (Hg (k) +b)-1f )g (k) (8)
相较于数字重聚焦算法,由于需要进行复杂的迭代运算,去卷积算法会消耗更多的时间,但可获得更高的空间分辨率。故在实际应用中,通常选择去卷积算法进行三维重构。
4 光场显微成像实验
为了验证所搭建的光场显微镜性能,下面采用荧光微球进行三维成像,并通过去卷积算法标定该系统的空间分辨率。此外,还将选择幼年转基因斑马鱼进行活体生物样品观测。
4.1 荧光微球光场成像与分辨率标定
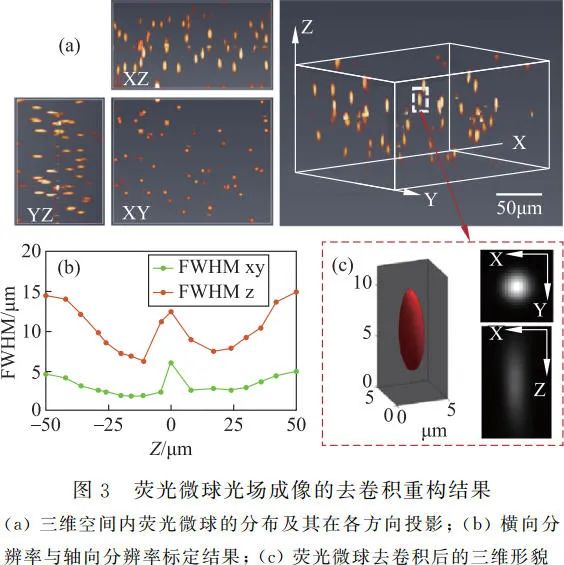
此处使用分布在三维空间内平均直径为 1.1μm 的绿色荧光微球(Fluoro-Max G0100, Thermo Scientific)进行光场显微成像,并使用去卷积算法对光场显微镜的空间分辨率进行标定。首先将荧光微球均匀分散到融化的琼脂糖溶液中,待琼脂糖溶液凝固后即可得三维分布的荧光微球样本,用于光场显微观测。
由图 3 可见,使用去卷积重构算法时,光场显微镜的视场为 192μm×152μm,景深为 100μm,横向分辨率为 2~6μm,轴向分辨率为 7~15μm。空间分辨率在焦面处较差[3],在焦面外随着离焦深度的增加而逐渐变差。
4.2 斑马鱼血管光场显微成像
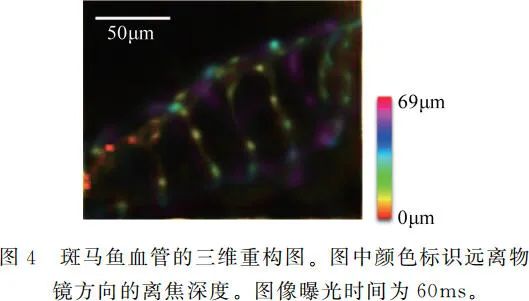
我们还使用所搭建的光场显微镜对 GFP 标记血管的幼年斑马鱼(基因型为 Tg(fli1a:GFP))进行三维成像,并使用去卷积算法进行计算重构。我们将孵化后 5 天的幼年斑马鱼固定在浓度为 1%的琼脂凝胶中,然后将其置于物镜下进行在体观测。相关实验步骤已获清华大学实验动物使用伦理委员会审批。
如图 4 所示,幼年斑马鱼的三维血管网络清晰可见。这说明所搭建的光场显微镜适用于生物样品的快速三维显微成像。
综上,本文所搭建的光场显微镜可在单次曝光中实现较高横向分辨率与轴向分辨率、较大景深的三维成像。通过采用高速图像记录器件,上述系统将可用于快速生物动态过程(如在体神经网络活动等)的观测。
5 结语
光场显微镜具有快速三维成像的优点,应用前景广阔。本文针对光场显微镜的实践教学,提出了光场显微镜的设计、制作方法,并采用基本光学元件进行组装。此外,本文还对所搭建系统的性能进行了标定,并对幼年斑马鱼的血管网络进行了三维成像。上述系统既可应用于辅助普通高校的实验教学,也可应用于推动生物医学研究。
参考文献
[1]孔令杰, 光学工程与脑科学的交叉融合教学——以“神经光子学”课程为例[J], 物理与工程, 2020, 30(4):12-16.
KONG L J. The interdisciplinary teaching of optical engineering and brain science—A case study of “Neurophotonics”[J]. Physics and Engineering, 2020, 30(4): 12-16. (in Chinese)
[2]LIPPMANN G. Reversible prints integral photographs[J]. Academy of Sciences, 1908, 7: 821-825.
[3]LEVOY M, NG R, ADAMS A, et al. Light field microscopy[J]. ACM Transactions on Graphics (TOG), 2006, 25(3): 924-934.
[4]BROXTON M, GROSENICK L, YANG S, et al. Wave optics theory and 3-D deconvolution for the light field microscope[J]. Optics Express, 2013, 21(21): 25418-25439.
[5]LLAVADOR A, SOLA-PIKABEA J, SAAVEDRA G, et al. Resolution improvements in integral microscopy with Fourier plane recording[J]. Optics Express, 2016, 24(18): 20792-20798.
[6]WANG D, XU S, PANT P, et al. Hybrid light-sheet and light-field microscope for high resolution and large volume neuroimaging[J]. Biomedical Optics Express, 2019, 10(12): 6595-6610.
[7]ZHANG Z, BAI L, CONG L, et al. Imaging volumetric dynamics at high speed in mouse and zebrafish brain with confocal light field microscopy[J]. Nat Biotechnol. 2021 Jan; 39(1): 74-83.
[8]LEVOY M, ZHANG Z, MCDOWALL I. Recording and controlling the 4D light field in a microscope using microlens arrays[J]. Journal of Microscopy, 2009, 235(2): 144-162.
基金项目:2019 年清华大学研究生教育教学改革项目(201905J003)。
通讯作者:孔令杰,男,清华大学副教授,主要研究方向为生物光子学,
引文格式: 翟家振, 施汝恒, 孔令杰. 光场显微镜及其在三维生物成像中的应用[J]. 物理与工程, 2022, 32(2): 147-150.
Cite this article: ZHAI J Z, SHI R H, KONG L J. Light field microscope and its applications in 3D biomedical imaging[J]. Physics and Engineering, 2022, 32(2): 147-150. (in Chinese)
文章来源:《物理与工程》
文章作者:翟家振 施汝恒
免责声明:转载此文目的在于传递更多信息,仅供读者学习、交流之目的。如有侵权,请联系删除。
