生物化学Note Track(I)——氨基酸
1. 氨基酸根据蛋白质合成的时候是否可以直接参入到肽链当中分类
分为直接参入的蛋白质氨基酸(proteinogenic amino acid)(也称为标准氨基酸)以及不可以直接参入到肽链当中的非蛋白质氨基酸(non-proteinogenic amino acid)。这里要注意,“直接”是什么意思?这里说的直接意思是有基因编码对应的,由tRNA转运的氨基酸,也就是最初从核糖体合成的蛋白质(或肽)的组成氨基酸,那么合成出的蛋白质可能会受到一些基团的修饰,使得氨基酸变化为另外一种氨基酸,比如说精氨酸氧化脱胍基转变为瓜氨酸,但是瓜氨酸并不是直接参入到合成的蛋白质中的,即使最后的成熟蛋白质内部是瓜氨酸。
那么为什么我们首先就要进行这样一个分类呢,因为自然界当中的氨基酸的种类繁多,但是真正是直接参入到蛋白质合成过程的氨基酸数量却是有限的,其他天然蛋白质可以认为是在这些蛋白质氨基酸经过修饰得到的,同时这些蛋白质氨基酸与DNA和tRNA也有很好的对应关系,所以以蛋白质氨基酸为叙述主体,非蛋白质氨基酸作为旁支是一个逻辑清晰的链条。
那么目前我们发现的蛋白质氨基酸主要有22种,其中两种是最近才发现的:硒代半胱氨酸和吡咯赖氨酸,其中硒代半胱氨酸的分布其实是很广泛的,其分布在大多数生物体内的少数蛋白质分子之中,但是植物一般缺乏,由于其结构并不是很稳定,而且编码方式特殊(由终止密码子编码),所以发现很晚。而吡咯赖氨酸更是因为其分布仅仅(目前)局限于几种古菌当中,在催化合成甲烷的几种酶当中才发现它,而且编码方式也很特殊(由终止密码子编码),所以发现也较晚。
那么这22种氨基酸我们最好还是记忆其的结构(主要是R),名称,简写,特别需要注意的是由于其的结构影响的它的性质(尤其重要的是疏水亲水和活化基团等)
2. 根据R基团的化学性质,我们对氨基酸进行分类(联想结构式)
a. 非极性的氨基酸(9个):甘氨酸(Gly),丙氨酸(Ala),缬氨酸(Val),亮氨酸(Leu),异亮氨酸(Ile),苯丙氨酸(Phe),色氨酸(Trp),脯氨酸(Pro),甲硫氨酸(Met),这里可以根据是否带有苯环进一步细分是否是芳香族化合物还是脂肪族化合物
b. 极性氨基酸(不带电)(6个):天冬酰胺(Asn),谷氨酰胺(Gln),丝氨酸(Ser),半胱氨酸(Cys),酪氨酸(Tyr),苏氨酸(Thr)
c. 极性带正电氨基酸(碱性)(4个):组氨酸(His),精氨酸(Arg),赖氨酸(Lys),吡咯赖氨酸(Pyl)
d. 极性带负电氨基酸(酸性)(3个):天冬氨酸(Asp),谷氨酸(Glu),硒代半胱氨酸(Sec)
这里强调一下b、c、d的区分,cd的极性要高于b所以电离常数较大,在正常生理环境(PH接近7)下带有电荷(一定要强调是什么环境,即使是精氨酸在强碱性条件下也会带有负电),或者说我们可以利用等电点来判断
等电点:
我们知道一个氨基酸是有两性的,那么对于任何一个氨基酸,在强酸性条件下,氨基会结合氢离子而羧基电离程度非常小,那么这个氨基酸此时带上正电荷;在强碱性条件下,羧基的H会在氢氧根的作用下解离,而氨基的电离程度也非常小,那么此时氨基酸带上负电荷。问题来了,什么时候氨基酸不带任何电荷呢?那么我们把氨基酸不带任何电荷的pH记作pI,即等电点。
那么首先阐明一点,氨基酸不带任何电荷这个是对于绝大部分的氨基酸而言的,那么此时绝大部分的氨基酸氨基和羧基都是没有电离的,但是仍然存在极少数的氨基酸存在着电离,但是酸性电离和碱性电离的两部分应当相等。换句话说,仅仅看氨基酸这一个分子群体,是呈现电中性的。(看溶液始终是呈现电中性的,注意厘清)
那么我们如何求得等电点呢,我们一般是利用滴定曲线来测得某氨基酸的等电点的。我们首先以最简单的氨基酸甘氨酸为例。
首先我们假设我们有一份放置在酸性环境下的甘氨酸溶液(目的是直接得知此时氨基酸是处于正电状态),我们开始滴加碱,当碱与甘基酸恰好完全反应的时候我们会得到一个突变点,那么这个突变点的即是等电点,但是此时我们会继续滴加碱直至过量。
那么我们为什么要选择在从酸性溶液开始滴加,然后即使出现反应突变也继续滴加呢?因为为了求出pI,我们需要知道由正电状态转变为两性离子和两性离子转变为负电状态的Ka,然后我们对这Ka乘积开根就可以得到等电点。那这Ka是如何求得的呢,我们在滴定过程会得到一条滴定曲线,那么在滴定曲线我们会观察到存在某个点处的pH变化斜率最小(随滴加碱量),那么此时根据缓冲溶液在共轭酸碱之比相等时缓冲能力最强我们可以知道,此时的Ka就恰好等于pH,所以我们直接在滴定曲线上读取两个斜率最小的点,然后就可以知道Ka啦。
(但是这里注意一点,可能在最开始碱会与溶液中残留的H+发生反应,那么这时候有可能出现一个突变,这是要和后面的突变分辨开)
那么如果对于R侧链基团当中也存在酸碱性基团,这时候我们如何测定等电点呢?
其实是一个道理,那么我们以赖氨酸(Lys)为例,赖氨酸的侧链基团存在一个游离的氨基,那我们首先仍然是在酸性溶液当中开始滴定碱,然后首先碱会与羧基反应,出现一个滴定终点(2正电到单正电),这个滴定终点不是我们要的等电点,然后继续滴加碱,会出现一个滴定终点(单正电到两性离子),那么这时候就是我们需要的等电点,同上,我们需要继续滴加得到随后的一个斜率最小的点,此时我们乘积开方的就是在等电点两边的电离常数。
所以我们根据以上步骤,我们可以求出所有氨基酸的等电点。通过等电点和正常生理状态下的pH对比,我们就可以确定这个氨基酸是碱中酸性。那么如果等电点显著低于该pH,那么也就说明在正常生理状态下,该氨基酸是以负电形式出现的,所以该氨基酸是酸性氨基酸,反之,我们可以定义碱性氨基酸。当然,氨基酸的酸碱性存在一个评判的标准,一般我们认为等电点在2.7-3.2左右的为酸性氨基酸,在7.6-10.8的为碱性氨基酸,在5.0-6.5的为中性氨基酸。
既然咱们提到了等电点,我们顺带把等电点的性质一并说明,我们知道氨基酸是两性的,也就是说在非等电点,氨基酸是带电的,那么此时氨基酸的溶解度就会较大(本质上溶解就是溶剂与溶质的作用大于溶质之间的作用,那么此时溶质分子带相同电荷相互排斥,但是溶剂水本身是两性的所以可以吸引带电氨基酸溶解),那么当氨基酸恰好处于等电点的时候,那么此时氨基酸所带的净电荷就为0,此时氨基酸分子之间的作用力会大于水对于氨基酸的吸引,所以氨基酸在此时的溶解度是最小的,那么在适宜温度和浓度下可以沉降(对于非极性氨基酸更容易沉降),在等电点处氨基酸也不会因为电场作用而迁移。
如果想要对带有不同电性的氨基酸进行分离,可以采用电泳的方法。
3.对氨基酸进行疏水亲水的分类
我们回到氨基酸的分类,我们还可以把氨基酸分为亲水氨基酸(hydrophilic aa)和疏水氨基酸(hydrophobic aa),那么如果粗暴处理的话,我们可以认为非极性的氨基酸属于疏水氨基酸,极性氨基酸属于亲水氨基酸。但是我们需要强调的是,我们判断极性还是非极性我们是根据R来判定的,但是亲水和疏水这是整个分子的性质,所以我们也需要考虑到氨基酸的结构通式。所以我们特别考虑甘氨酸和甲硫氨酸,甘氨酸的R基团仅仅是H,而甲硫氨酸既有亲水的S,但是S同时连有烃基,所以我们可以把甘氨酸和甲硫氨酸列为中性氨基酸。
那么疏水和亲水性在蛋白质的折叠上起着非常重要的作用,疏水氨基酸一般是分布在球状蛋白质的内部,而亲水氨基酸一般分布在球状蛋白质的表层
在对蛋白质进行基团修饰的时候,也是一般修饰的是极性氨基酸,一方面是因为极性氨基酸处于蛋白质表面,另一方面是因为极性氨基酸代表的是蛋白质主要的功能,所以修饰极性氨基酸可以调节蛋白质的活性。同时蛋白质对DNA进行识别的时候,也是利用极性氨基酸的极性基团作为氢键的受体或者是供体。
4.对动物(尤其人体)氨基酸的来源进行分类
除此之外,我们根据动物(尤其是人体)氨基酸的来源可以再把氨基酸分为三类,必需氨基酸(essential aa),非必需氨基酸(nonessential aa),半必需氨基酸(semi-essential aa)。那么必需氨基酸我们是无法自己合成的,必须从食物中补充,非必需氨基酸相反。而半必需氨基酸可以理解为我们合成半必需氨基酸的能力受限,所以在需求量大的时候我们需要从外界获取,需求量小的时候我们可以自己合成。
必需氨基酸有以下:异亮氨酸(Ile),组氨酸(His),苯丙氨酸(Phe),甲硫氨酸(Met),赖氨酸(Lys),苏氨酸(Thr),色氨酸(Trp),亮氨酸(Leu),缬氨酸(Val)
我们再来看看为什么会出现这样的分类,为什么我们不直接合成所有的氨基酸呢?其实这应该考虑的是一个能量效益和风险的问题,我们可以看到大部分的必需氨基酸都是结构相对复杂的氨基酸,这主要是因为我们自己从头合成所需要花费的能量大于从食物中获取的能量,所以即使具有合成这些氨基酸能力的生物也逐渐在演化史上由于效率低而被排除。那么为什么对于更加复杂的氨基酸,比如酪氨酸,我们没有选择从食物中获取呢,这是考虑到风险,每一个氨基酸(20种)对于我们的生命活动来说都是必不可少的,但是可能也是存在一个优先级,如果一个氨基酸会直接影响到细胞生命,那么此时如果依赖于食物来获取这些氨基酸显然是需要承担较大的风险的,即使可以回收获一定的能量效益。
所以我们可以看出这样一个逻辑,生命系统的稳健性和高效性可能是存在冲突的,所以这时候生命会进化出一种平衡,其实半必需氨基酸也可以体现这种平衡的动态调节。
5. 简单介绍氨基酸的性质
因为不同氨基酸对于生命活动都有其不同的特性,所以这里只能笼统对氨基酸的整体性质做一个概括,既然是整体性质,那么我们从氨基酸的结构通式入手。
首先氨基酸是具有两性的,这也就使得氨基酸的水溶性是较好的,我们前面所说的疏水亲水只是从R基团的角度出发。
其次氨基酸(除Gly之外)是具有手性的,手性这一点在生物化学当中是非常重要的。我们的蛋白质氨基酸都是L型(糖类化合物通常D型),那么由此我们的酶也是具有高度的立体专一性的,不同手性的物质可能发挥着截然不同的作用。但是在肽链当中也出现D型氨基酸,这是因为这种特殊的肽链的形成不需要经过tRNA的结合,所以D型氨基酸可以参入。(这里可以思考为什么要调整手性,调整手性对于此蛋白质的结构产生了什么影响吗?特别是当细菌进化出这种另一手性的蛋白,会产生什么影响)
(但是这里有一个很大的问题,这种高度的立体专一性是如何产生的,为什么进化偏好于这种手性,如果人工合成对映体会产生什么后果?)
6. 氨基酸的测序和定量检测
(反应式图片来自于杨荣武老师主编第四版生物化学)
(1)和2,4-二硝基氟苯(DNFB)的反应(反应机理和条件不提)
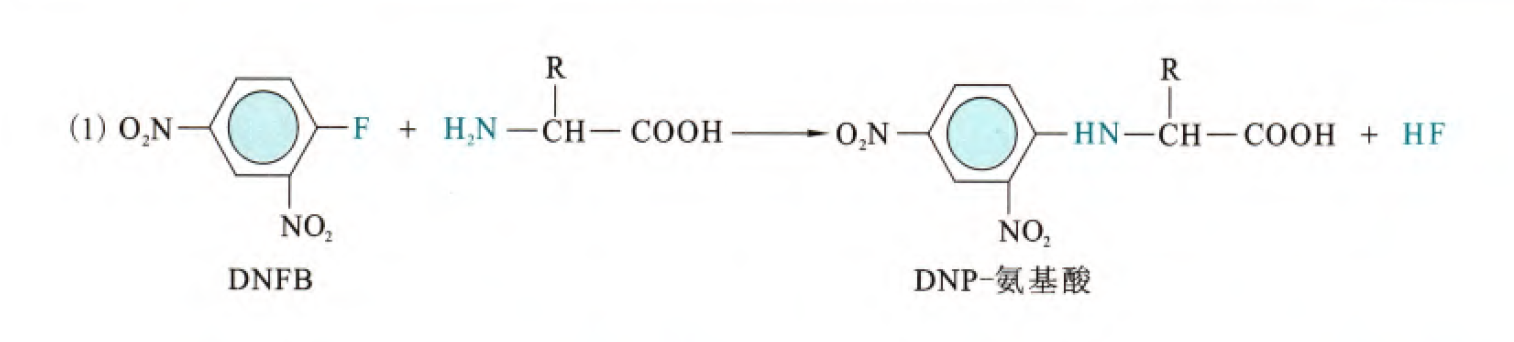
这是单个氨基酸和DNFB的反应,实际上这个反应可以推广到与多肽N端α-氨基反应。那么DNFB与多肽反应之后,会生成DNP-肽结构,那么在酸的水解作用下就可以实现DNP-氨基酸的脱离,并且保持余下的肽链的完整性。然后由于DNP-氨基酸溶于乙酸乙酯或乙醚等有机溶剂,所以可以利用此进行分离并且进行层析分析,通过与标准的DNP-氨基酸进行对比,我们就可以知道该氨基酸是的种类。然后重复以上步骤,我们可以对该肽链的所有氨基酸进行测序。
但是其中有几个点需要注意: 1. 选择性水解是为何?为什么不水解其余肽链的肽键?这个主要是因为DNP基团降低了N端第一个肽键的稳定性,另外H离子攻击肽链内部的碱基自身需要受到较大的空间位阻,所以如果控制酸的浓度和处理时间是可以做到仅仅水解DNP-氨基酸的肽键的
2. 如果侧链基团上也存在游离的氨基怎么办?DNP虽然会和游离的氨基进行反应,但是一方面此氨基与其余基团的键一般不会在水解时断裂,另一方面即使断裂,也不会影响到该氨基酸的测定,因为是存在标准DNP氨基酸匹配的。那么唯一可能需要担心的是,当检测到具备那个R基团的氨基酸的时候,可能需要调整标准DNP氨基酸
(2)与异硫氰酸苯酯的反应
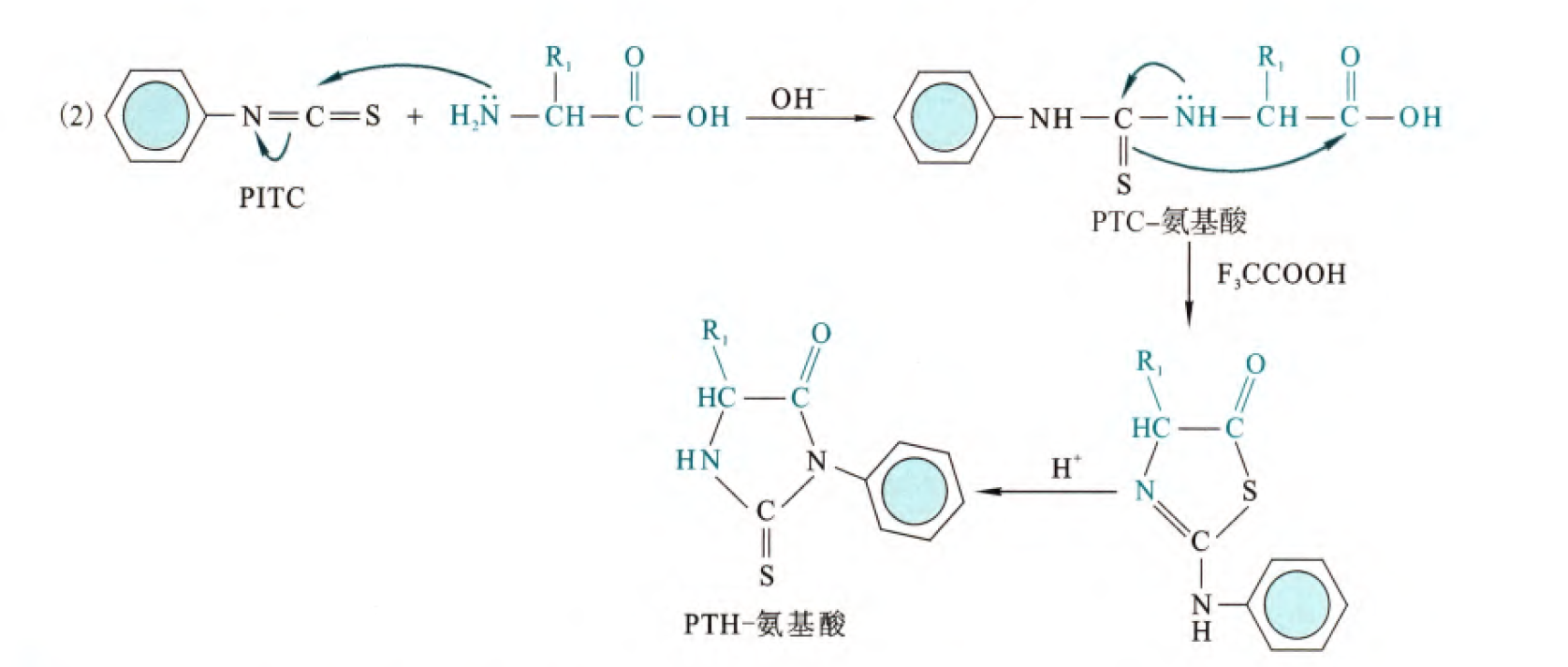
虽然涉及到的反应是不同的,但是测序的原理是一样的,而且此反应具备更高的稳定性,所以目前氨基酸自动顺序分析仪也是根据此反应原理设计的。
(3)与茚三酮的反应
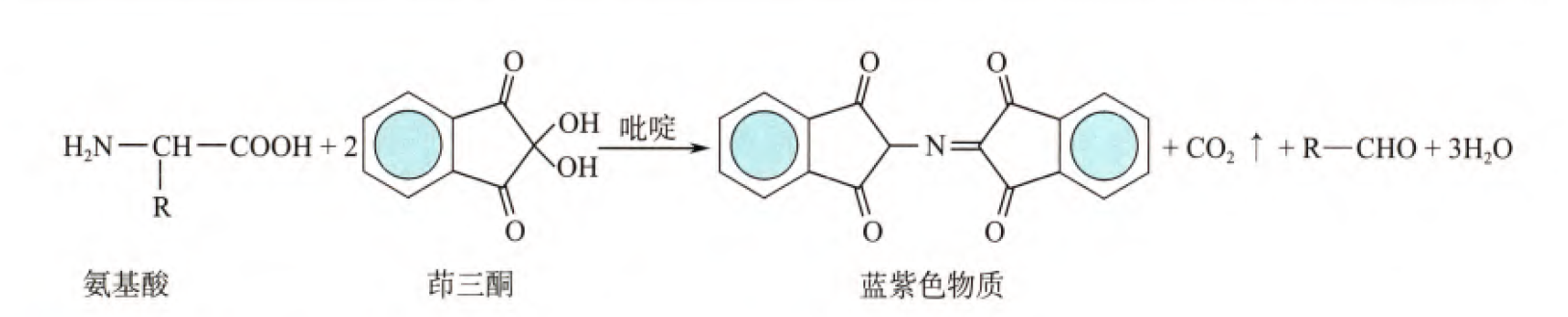
除脯氨酸的氨基酸都可以和茚三酮发生反应,生成蓝紫色物质,然后我们可以对生成的蓝紫色物质在570nm波长下进行比色法测定,我们就可以知道样品当中氨基酸的含量(根据光吸收度与物质含量成线性关系可得)
当然脯氨酸也可以和茚三酮发生反应,只不过会生成黄色物质。
那么此反应可以用于氨基酸的定量测定(不区分种类),也可以用于定性测定(如法医学上采集指纹(汗液会留下多种氨基酸))。除此之外,我们可以用氨基酸和亚硝酸的反应通过检测生成氮气的物质的量来得到氨基酸的含量(但是脯氨酸不与亚硝酸反应)
7. 对于某些氨基酸的特别关照
a. 由于苯丙氨酸(Phe),色氨酸(Trp)和赖氨酸(Tyr)的侧链基团都含有苯环,所以这使得它们在近紫外范围对光有强吸收,而且吸收峰各不同,所以可以根据吸收光谱的测定来实现对这三种氨基酸的定性和定量测定
b. 我们知道一般非极性氨基酸是疏水氨基酸,这些氨基酸一般是起到驱动蛋白质折叠的功能的,但是也正是因为这些基团缺少极性基团,所以仍然需要一些极性基团来发挥蛋白质的作用的,一般蛋白质的作用也是通过氨基酸的极性基团来实现的。
c. 含有羟基的侧链可以作为亲核基团参与多种酶的催化,含有巯基(Cys)也可以作为亲核基团参与酶的催化,同时两个Cys可以被氧化为二硫键,对于蛋白质的三维结构有着非常重要的作用。含咪唑基的pKa接近于7,所以这使得其在正常生理条件下基本接近于两性离子,所以既可以接受质子,同时又可以给出质子,所以许多酶的活性中心就含有His。
本笔记是根据杨荣武教授主编的《生物化学》第四版学习整理而成,小编水平有限,如有错误请友善交流指教~~
