药用植物甾体皂苷生物合成途径研究进展--文献精读158
药用植物甾体皂苷生物合成途径研究进展
摘要
甾体皂苷是药用植物中普遍存在的一类功效物质,由糖基和甾体皂苷元缩合而成,甾体皂苷的生物合成途径主要包括细胞质甲羟戊酸(MVA)途径和质体2-C-甲基-D-赤藓醇-4-磷酸(MEP)两条途径,并以MVA途径为主。在生物合成途径中涉及一系列关键酶,包括3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR),1-脱氧-木酮糖-5-磷酸合酶(DXS),1-脱氧-木酮糖-5-磷酸还原异构酶(DXR),法尼基焦磷酸合酶(FPS),鲨烯合酶(SS),鲨烯环氧酶(SE),环阿屯醇合酶(CAS),细胞色素P450酶(CYP450),糖基转移酶(SGTase)等。在综合前人研究的基础上,该文对甾体皂苷生物合成途径路线图进行了补充和细化,而对近5年来有关药用植物甾体皂苷生物合成关键酶(基因)生物学信息研究报道整理发现,药用植物中HMGR,SS,CYP450,UGT基因研究相对较多,而对FPS,SE,CAS的报道则较少。整体来看,目前对甾体皂苷生物合成途径研究尚处于初级阶段,对于关键酶功能研究缺乏强有力的直接证据。可为甾体皂苷的后续研究提供参考和理论支撑。
关键词
药用植物; 甾体皂苷; 生物合成; 关键酶; 关键基因; 细胞质甲羟戊酸(MVA)途径
甾体皂苷(steroidal saponins)在植物中分布广泛,主要存在于百合科、石蒜科、薯蓣科、菝葜科、玄参科、龙舌兰科、葱科、天门冬科等植物中,且在十字花科、豆科、茄科中也有发现[1]。甾体皂苷主要来自于植物的地下部分,包括根及根茎,而叶、茎、果实、种子中甾体皂苷则相对较少,目前已经从近200种植物中发现甾体皂苷[2]。甾体皂苷是由糖基和甾体皂苷元缩合而成的糖基皂苷。甾体皂苷的糖基种类众多,主要有葡萄糖、鼠李糖、半乳糖、木糖、呋糖和阿拉伯糖等,糖链通常连接在螺甾烷型皂苷的C-3位,呋甾烷型皂苷的C-3和C-6位,亦有连接在甾体皂苷的C-1,C-6,C-12和C-24等位置[3]。甾体皂苷元的骨架由27个碳原子构成,母核为环戊烷多氢菲。根据螺甾烷结构中C-25位的构型和环的环合状态,可将其分为螺甾烷醇类(spirostanols),异螺甾烷醇类(isospirostanols),变形螺烷醇类(pseudospirostanols)和呋甾烷醇类(furostanols)皂苷[4],其中以螺甾烷型的皂苷最为常见,其结构的多样性也造就了其广泛的药理活性,甾体皂苷具有抗肿瘤、抗炎、抗真菌、抗病毒、抗氧化、抗抑郁、保肝、降血糖、镇静催眠等多种药理活性[5]。
目前对甾体皂苷的研究主要集中在药理活性、化学组成、含量测定等方面,尤其在药理活性方面其抗肿瘤活性受到了国内外学者的广泛关注与研究。研究表明虎眼万年青(Ornithogalum saundersiae)中的皂苷具有靶向抗癌作用,对多种肿瘤细胞增殖抑制作用极强,但对正常细胞毒性极小[6]。然而对于甾体皂苷生物合成的相关研究相对较少,且主要集中在关键酶基因的克隆和功能鉴定,对涉及具体催化过程、结构修饰和转录水平调控机制的研究尚处于初级阶段。本文主要对甾体皂苷合成途径及其合成关键酶(基因)生物学信息进行了综述,进一步明确甾体皂苷生物合成分子机制,解析其生物合成途径,可为甾体皂苷的后续研究提供参考和理论支撑。
1 甾体皂苷生物合成途径
甾体皂苷的生物合成途径包括细胞质甲羟戊酸(mevalonate,MVA)途径和质体2-C-甲基-D-赤藓醇-4-磷酸(2-C-methl-D-erythritol-4-phospate,MEP)两条途径,二者均会生成中间产物异戊烯焦磷酸(isopentenyl pyrophosphate,IPP),二者中MVA途径在甾体皂苷生物合成中起到主导作用[7]。
1.1 MVA途径
MVA途径是指以2分子的乙酰辅酶A为底物,在乙酰乙酰辅酶A硫解酶(acetoacetyl-CoA thiolase,AACT),羟甲基戊二酰辅酶A合酶(hydroxy methylglutaryl-CoA synthase,HMGS)作用下催化生成3-羟基-3-甲基乙酰辅酶A(3-hydroxy-3-methylglutaryl coenzyme A,HMG-CoA),之后经(3-hydroxy-3-methylglutaryl-CoA reductase,HMGR)生成MVA。最后经过焦磷酸化、脱羧化和脱水作用生成异戊烯焦磷酸(isopentenyl pyrophosphate,IPP)[8]。
1.2 MEP途径
MEP途径是由1-脱氧-木酮糖-5-磷酸合酶(1-deoxy-D-xylulose-5-phosphate synthase,DXS)催化丙酮酸(pyruvate)后,再与3-磷酸甘油醛(glyceraldehyde-3-phosphate,G3P)缩合生成1-脱氧-D-木酮糖-5-磷酸酯(1-deoxy-D-xylulose-5-phosphate,DXP);之后DXP在限速酶1-脱氧-木酮糖-5-磷酸还原异构酶(1-deoxy-D-xylulose-5-phosphate reductoisomerase,DXR)的催化下还原生成中间体MEP,MEP经过磷酸化、环化等反应后,最终生成IPP[9]。
1.3 甾体皂苷生物合成途径
IPP通过法尼基焦磷酸合酶(farnesyl pyrophaophate synthase,FPS)的催化生成法尼基焦磷酸(FPP),之后通过鲨烯合酶(squalene synthase,SS或SQS)和鲨烯环氧酶(squalene epoxidase,SE或SQE)的催化形成2,3-氧化角鲨烯(2,3-oxidosqualene,OS),2,3-氧化角鲨烯在环阿屯醇合酶(cycloartenol synthase,CAS)的催化下形成甾体类化合物的前体环阿屯醇(cycloartenol),该步骤是甾体与萜类代谢的重要分支,是甾体类化合物下游代谢总开关[10,11]。环阿屯醇经过一系列的氧化、还原等修饰,形成胆甾醇,胆甾醇侧链经过羟基化、羰基化等反应,环化为半缩酮,半缩酮C-26位羟基被葡萄糖基转移酶催化形成糖苷键,生成呋甾烷型甾体皂苷[12]。而呋甾烷型甾体皂苷经26-β-糖苷酶(F26G)催化C-26糖苷键水解,形成螺甾烷型甾体皂苷[13]。合成途径见图1。
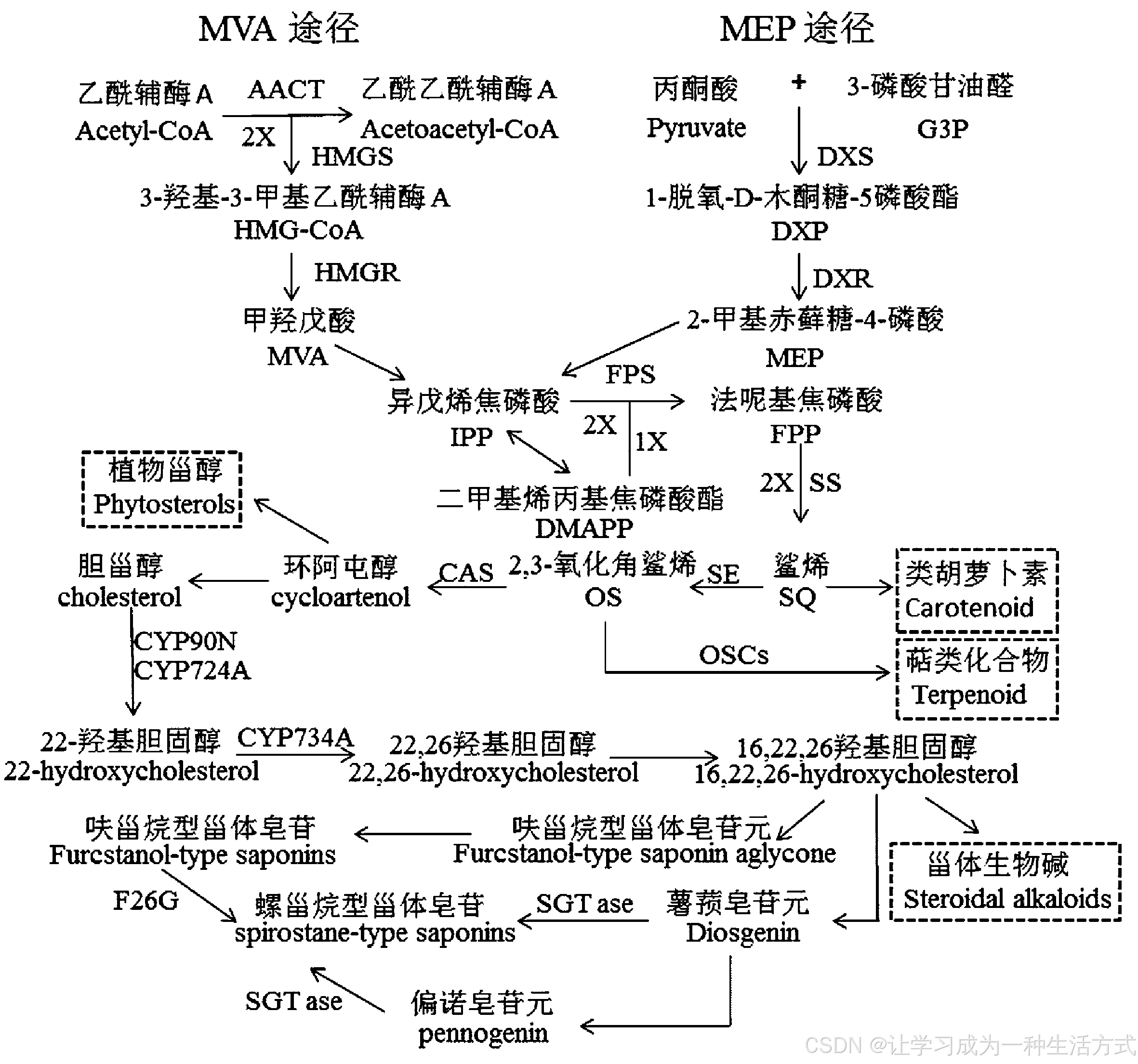
图 1 植物甾体皂苷生物合成途径
2 甾体皂苷生物合成中的关键酶及作用
甾体皂苷的合成关键酶根据其合成途径可以分成3个部分[14],第一部分是IPP和二甲基烯丙基焦磷酸(dimethyl allyl pyrophosphate,DMAPP)合成酶,为甾体皂苷与萜类生物合成共同途径的酶,包括了MVA途径中的限速酶HMGR,以及MEP途径中的酶DXS,DXR;第二部分是催化IPP和DMAPP形成2,3-氧化鲨烯的各种环化酶,如FPS,SS,SE;第三部分是催化2,3-氧化鲨烯经过环化、氧化、还原、羟基化、糖基化等一系列修饰反应最终形成甾体类皂苷的合成酶,包括CAS,细胞色素P450酶(CYP450),糖基转移酶(SGTase)。关键酶的具体信息见表1。
表 1 甾体皂苷生物合成关键酶及其作用
Table 1 Key enzymes in biosynthesis pathway of steroidal saponins and their functions
| 关键酶缩写 | 酶类型 | 主要的功能和作用 |
|---|---|---|
| HMGR | 还原酶 | 催化HMG-CoA还原形成MVA |
| DXS | 催化酶 | 催化Pyruvate与G3P缩合生成DXP |
| DXR | 还原酶 | 催化DXP生成MEP |
| FPS | 异戊烯基转移酶 | 催化IPP和DMPP以1~4头尾连续缩合,形成FPP |
| SS | 位于内质网膜上的一种微粒体酶 | 催化2分子的FPP缩合生成1分子鲨烯 |
| SE | 单加氧酶 | 催化鲨烯合成2,3氧化鲨烯 |
| CAS | 氧化鲨烯环化酶中的一种 | 催化2,3氧化鲨烯环化生成环阿屯醇 |
| CYP450 | 氧化还原酶 | 催化胆甾醇侧链羟基化、氧化等生成甾体皂苷元 |
| SGTase | 糖基转移酶 | 催化多种甾体皂苷元和甾体生物碱的糖基化 |
2.1 HMGR在甾体皂苷合成中的表达调控
MVA途径是合成IPP的主要途径之一,而HMGR是该途径中的第一个关键酶,与NADPH催化HMG-CoA生成MVA,该反应是不可逆的反应,也是萜类合成的一个重要的调控位点[15]。目前已经从16种药用植物中克隆出了该基因,由该基因编码的氨基酸序列长度在523~602 aa,长度在500 aa左右的药用植物居多,且相对分子质量约为60 kDa。从杜仲(Eucommia ulmoides)中克隆出了EuHMGR基因,组织表达分析发现该基因在叶和茎中强烈表达,而在根中表达较弱,同时对该基因进行酵母互补实验验证,发现EuHMGR能够介导酵母中甲羟戊酸的生物合成[16]。GU等[15]从泽泻(Alisma plantago)中克隆出了AoHMGR基因,并在大肠埃希菌细胞中进行异源表达,经体外酶促反应实验和GC-MS分析显示该产物能够催化HMG-CoA和NADPH形成MVA,并发现AoHMGR在块茎中的表达量最高。部分生物学信息见表2。
表2 部分药用植物甾体皂苷生物合成关键酶基因生物学信息(2015—2019年)
Table 2 Bioinformation of key enzyme genes for biosynthesis pathway of steroidal saponins in herbs from 2015 to 2019
| 关键酶 | 物种名 | 基因名 | 全长/bp | ORF/bp | 相对分子质量 /kDa | 等电点(IP) | 氨基酸/个 | GenBank 编号 | 参考文献 |
|---|---|---|---|---|---|---|---|---|---|
| HMGR | 球药隔重楼(Paris fargesii) | Pf-HMGR | 1 973 | 1 728 | 62.13 | 8.47 | 575 | JX508638 | [16] |
| 假马齿(Bacopa monnieri) | 1 770 | 1 770 | 62.61 | 8.32 | 589 | HM222607 | |||
| 小木通(Clematis armandii) | 1 874 | 1 737 | 62.13 | 8.47 | 578 | JN830626 | |||
| 甘草(Glycyrrhiza uralensis) | GuHMGR | 1 819 | 1 722 | 60.57 | 7.06 | 573 | GQ845405 | ||
| 杜仲(E. ulmoides) | EuHMGR | 2 281 | 1 733 | 63.31 | 6.83 | 590 | AY796343 | ||
| 雷公藤(T. wilfordii) | 1 867 | 1 740 | 61.68 | 6.98 | 579 | KU246037 | |||
| 盾叶薯蓣(Dioscorea zingiberensis) | 2 077 | 1 758 | 62.31 | 7.47 | 585 | KC960674 | |||
| 秦艽(Gentiana macrophylla) | GmHMGR2 | 1 871 | 1 743 | 62.78 | 6.35 | 580 | JQ995755 | ||
| 人参(Panax ginseng) | 1 785 | 1 785 | 63.62 | 8.40 | 594 | KM386695 | |||
| 龙胆草(Gentiana lutea) | 1 972 | 1 650 | 58.92 | 5.85 | 549 | AB027189 | |||
| 铁皮石斛(Dendrobium catenatum) | 2 036 | 1 689 | 59.76 | 6.18 | 562 | JX909333 | |||
| 刺五加(E. senticosus) | 2 217 | 1 713 | 61.06 | 7.83 | 570 | JQ905593 | |||
| 三七(Panax notoginseng) | HMGR | 3 947 | 1 770 | 63.04 | 6.49 | 589 | KJ804166 | [17] | |
| 三七(P. notoginseng) | PnHMGR | 1 893 | 1 725 | 61.76 | 6.60 | 574 | KJ578757 | [18] | |
| 泽泻(A. plantago) | AoHMGR | 2 252 | 1 809 | 64.60 | 7.87 | 602 | KP342318 | [15] | |
| 滇龙胆(Gentiana rigescens) | GRHMGR-1 | 1 747 | 1 697 | 60.65 | 5.69 | 565 | [19] | ||
| GRHMGR-2 | 1 731 | 1 572 | 55.82 | 5.48 | 523 | ||||
| 金铁锁(Psammosilene tunicoides) | HMGR | 1 716 | 1 641 | 58.0 | 546 | [20,21] | |||
| FPS | 虎眼万年青(O. saundersiae) | OsaFPPS | 1 327 | 1 044 | 40.09 | 5.01 | 347 | KF509889 | [22,23] |
| 川贝母(Fritillaria cirrhosa) | FPS | 1 059 | 1 059 | 40.10 | 5.10 | 352 | MG674920 | [24] | |
| 雷公藤(T. wilfordii) | TwFPS1 | 1 345 | 1 029 | 39.54 | 5.54 | 342 | KM058711 | [25] | |
| TwFPS2 | 1 312 | 1 029 | 39.54 | 5.28 | 342 | KM058712 | |||
| 杜仲(E. ulmoide) | EuFPPs1 | 1 047 | 1 047 | 40.04 | 348 | KC468535 | [26] | ||
| EuFPPs2 | 1 029 | 1 029 | 39.55 | 342 | KC468536 | ||||
| 泽泻(A. orientale) | FPPS | 1 541 | 1 032 | 343 | [27,28] | ||||
| 金铁锁(P. tunicoides) | FPS | 1 135 | 1 029 | 39 | 342 | [20] | |||
| SQS | 虎眼万年青(O. saundersiae) | OcSQS1 | 1 230 | 409 | [29] | ||||
| 浙贝母(Fritillaria thunbergii) | FtSQS | 1 230 | 1 122 | 374 | KF551097 | [30] | |||
| 人参(P. ginseng) | SS | 1 390 | 1 248 | 47.02 | 6.36 | 415 | EU502717 | [31] | |
| 1 329 | 1 248 | 47.12 | 415 | GU183406 | |||||
| 1 335 | 1 248 | 47.13 | 415 | GQ468527 | |||||
| 1 476 | 1 248 | 47.06 | 415 | AB115496 | |||||
| 1 434 | 1 248 | 47.06 | 415 | AB010148 | |||||
| 三七(P. notoginseng) | 1 270 | 1 248 | 47.17 | 415 | DQ186630 | ||||
| 丹参(S. miltiorrhiza) | SmSQS2 | 1 597 | 1 245 | 414 | KM244731 | [32] | |||
| SmSQS2 | 1 597 | 1 245 | 47.16 | 7.16 | 414 | KM408605 | [33] | ||
| SmSQS1 | 6 279 | 1 242 | 47.35 | 6.60 | 413 | JQ763409 | [34] | ||
| SmSQS2 | 7 200 | 1 245 | 47.16 | 7.16 | 414 | JQ763410 | |||
| 雷公藤(T. wilfordii) | TwSQS | 1 800 | 1 242 | 47.20 | 7.94 | 413 | KR401220 | [35] | |
| TwSQS | 1 242 | 49.41 | 413 | [36] | |||||
| 厚朴(M. officinali) | MoSQS | 1 240 | 46.68 | 7.93 | 409 | KT223496 | [37] | ||
| 盾叶薯蓣(D. zingiberensis) | DzSQS | 1 453 | 1 230 | 46.0 | 6.20 | 409 | KC960673 | [38] | |
| 泽泻(A. orientale) | AoSS | 1 577 | 1 230 | 46.0 | 409 | JX866770 | [39] | ||
| 红花栝楼(Trichosanthes rubriflos) | SS | 1 466 | 1 254 | 47.59 | 7.90 | 417 | [40] | ||
| 黄芪(Astragalus membranaceus) | 1 899 | 1 242 | 413 | KP890854 | [41,42] | ||||
| SE | 绞股蓝(G. pentaphyllum) | GpSE1 | 1 578 | 1 578 | 525 | KX427578 | [43] | ||
| 1 818 | 1 578 | 525 | FJ906798 | ||||||
| 雷公藤(T. wilfordii) | TwSE1 | 1 578 | 1 578 | 57.42 | 8.65 | 525 | MF989106 | [44] | |
| TwSE2 | 1 584 | 1 584 | 57.59 | 8.84 | 527 | MH593246 | |||
| TwSE3 | 1 581 | 1 581 | 57.10 | 8.88 | 526 | MH593247 | |||
| TwSE4 | 1 584 | 1 584 | 57.35 | 8.98 | 527 | MH593248 | |||
| TwSE5 | 1 101 | 1 101 | 40.91 | 9.48 | 366 | MH593249 | |||
| 三七(P. notoginseng) | 2 054 | 1 623 | 540 | KJ804171 | [45] | ||||
| 1 635 | 1 635 | 544 | KJ946468 | ||||||
| 远志(Polygala tenuifolia) | SE | 1 652 | 1 587 | 57.88 | 8.77 | 528 | MG917041 | ||
| 太子参(Pseudostellaria heterophylla) | SQE1 | 2 038 | 1 554 | 56.70 | 8.80 | 517 | [46] | ||
| 雷公藤(T. wilfordii) | TwSE1 | 1 578 | 1 578 | 57.34 | 8.74 | 525 | MG717395 | [47] | |
| TwSE2 | 1 584 | 1 584 | 57.54 | 8.97 | 527 | MG717396 | |||
| 滇重楼(P. polyphylla var. yunnanensis) | ppSE1 | 1 932 | 1 578 | 56.88 | 9.19 | 525 | [48] | ||
| ppSE1 | 1 828 | 1 548 | 55.35 | 8.74 | 515 | ||||
| 金龙胆草(Conyza blinii H.Lév) | 1 575 | 57.00 | 7.55 | 525 | [49] | ||||
| 金铁锁(P. tunicoides) | SE-1 | 1 642 | 1 578 | 525 | [50] | ||||
| SE-2 | 1 552 | 1 446 | 481 | ||||||
| 桑黄(Sanghuangporus lonicericola) | IbSE1 | 1 856 | 1 452 | 55.12 | 8.41 | 483 | [51,52] | ||
| CAS | 葫芦巴(T. foenum-graecum) | TfCAS | 2 271 | 2 271 | 756 | KX148475 | [53,54] | ||
| 吊兰(C. borivilianum) | 2 277 | 2 277 | 86.19 | 5.89 | 758 | KM245581 | [55,56] | ||
| CYP450 | 重楼(P. polyphylla) | PpCYP90B27 | 1 455 | 1 455 | 54.89 | 8.36 | 484 | KX904822 | [57,58] |
| 吊兰(C. borivilianum) | CYP450 | 1 695 | 1 458 | 55.44 | 8.70 | 485 | KM245583 | [55] | |
| 川贝母(Fritillaria cirrhosa) | CYP90B1 | 1 476 | 1 476 | 491 | KX168703 | [59] | |||
| CYP71D55 | 1 644 | 1 644 | 547 | KX168698 | |||||
| CYP94A1 | 1 356 | 1 356 | 451 | KX168699 | |||||
| CYP71A1 | 1 536 | 1 536 | 511 | KX168706 | |||||
| CYP51 | 1 467 | 1 467 | 488 | KX168705 | |||||
| CYP734A6 | 1 548 | 1 548 | 515 | KX168707 | |||||
| CYP74B2 | 1 446 | 1 446 | 481 | KX168708 | |||||
| 滇重楼(P. polyphylla var. yunnanensis) | 870 | 870 | 31.53 | 5.63 | 289 | [60] | |||
| 金铁锁(P. tunicoides) | PtCYP450 | 1 612 | 1 560 | 60.00 | 6.58 | 519 | [61] | ||
| 刺五加(E. senticosus) | CYP716A244 | 1 721 | 1 446 | 54.01 | 481 | [62,63] | |||
| SGTase | 吊兰(C. borivilianum) | CbS3GT | 1 695 | 62.02 | 6.14 | 564 | [55] | ||
| 霍山石斛(Dendrobium huoshanense) | IRX9 | 1 553 | 1 047 | 39.35 | 7.26 | 348 | MH507317 | [64] | |
| 丹参(S. miltiorrhiza) | SmUF3GT | 1 390 | 1 353 | 49.25 | 6.50 | 450 | [65] | ||
| 金银花(Lonicera japonica) | LjUGT71E1 | 1 503 | 55.58 | 5.09 | 501 | [66] | |||
| 小叶女贞(Ligustrum quihoui) | xynzUGT | 1 598 | 1 440 | 54.83 | 5.82 | 480 | MF669124 | [67] | |
| 金铁锁(P. tunicoides) | PtT1 | 1 529 | 1 377 | 51.25 | 5.80 | 458 | [68] | ||
| UGT71G1 | 1 402 | 1 107 | 41.05 | 6.03 | 368 | [69] | |||
| UGT | 1 581 | 1 335 | 49.76 | 6.25 | 444 | [70] | |||
| 鱼腥草(Houttuynia cordata) | UGT75C1 | 1 787 | 1 461 | 53.18 | 5.22 | 486 | [71] | ||
| 益母草(Leonurus heterophyllus) | LhsUGT | 1 562 | 1 368 | 50.47 | 5.52 | 455 | [72] | ||
| 高山红景天(Rhodiola sachalinensis) | UGT72B14-2 | 1 422 | 1 422 | 51.49 | 6.30 | 473 | KX262844 | [73] |
2.2 FPS在甾体皂苷合成中的表达调控
FPS是一种异戊烯基转移酶,是类异戊二烯途径的一个关键酶。其催化5碳原子的IPP和DMAPP以1~4头尾连续缩合反应后形成15碳的FPP[21]。典型的FPS有2个富含天冬氨酸的模序,每个亚基均有底物丙烯基焦磷酸(APP)及IPP结合位点[22]。目前已经从6种药用植物中获得了FPS氨基酸序列,其长度在342~352 aa,相对分子质量约为40 kDa,相对保守,部分内容见表2。目前对药用植物FPS酶的研究,多集中在百合科。GUO等[23]从虎眼万年青中分离到OsaFPPS基因,并以IPP和DMAPP作为底物对纯化后的OsaFPPS蛋白进行功能分析,且通过GC-MS确定了其产物为FPP。ZHAO等[25]从雷公藤(Tripterygium wilfordii)中克隆出了2条FPS酶基因TwFPS1和TwFPS2,发现其在根中高度表达,在茉莉酸甲酯(MeJA)处理时上调,并获得了该基因的重组蛋白,通过体外酶促实验对其功能进行了验证。
2.3 SS在甾体皂苷合成中的表达调控
SS又称为角鲨烯合酶,可以催化两分子FPP首尾聚合生成鲨烯,是三萜皂苷、甾醇、胆固醇等萜烯类重要物质的共同前体[28]。目前已经从10种药用植物中克隆出该基因,含有374~417 aa,相对分子质量约为47 kDa。LIU等[29]从虎眼万年青中克隆出了SS基因OcSQS1,并通过大肠埃希菌异源表达获得了可溶性截短的OcSQS1突变体,研究发现该突变体能够折叠并催化FPP转化为角鲨烯。RONG等[33],ZHANG等[36],ZHA等[37]分别从丹参(Salvia miltiorrhiza),雷公藤,厚朴(Magnolia officinali)中克隆出了相应SS基因SmSQS2,TwSQS,MoSQS,并将这些基因进行了重组表达和初步酶活性鉴定,经与FPP和NADPH一起温育,通过GC-MS检测发现在体外反应混合物中都检测到角鲨烯;此外,雷公藤TwSQS基因在根中高度表达,其次是茎和叶,并且该基因在MeJA处理后出现显著上调表达。见表2。
2.4 SE在甾体皂苷合成中的表达调控
SE存在于内质网的微粒体中,是催化鲨烯(角鲨烯)转变为环氧化鲨烯反应的生物催化剂。环氧化鲨烯是从鲨烯生成羊毛甾醇、环阿屯醇、香树素等过程中的重要中间产物,因此鲨烯环氧酶被认为是甾体皂苷生物合成途径中的一个非常重要的调控酶[42]。目前已经从9种药用植物中克隆出该基因,由366~544 aa编码而成,其中在500 aa左右的药用植物居多,相对分子质量约为40~60 kDa,见表2。GUO等[43]从绞股蓝(Gynostemma pentaphyllum)中获得了一条GpSE1基因,通过免疫荧光发现,幼叶中GpSE1的荧光信号明显强于成熟叶和根茎,这与该基因的组织特异性表达相一致,且发现幼叶和成熟叶中的GpSE1基因在MeJA处理后都出现显著上调表达,尤以幼叶更为显著,但随着MeJA浓度的升高,GpSE1的表达不会持续增强,表明MeJA对GpSE1表达发挥着浓度依赖性作用。ZHOU等[44]从雷公藤中克隆出了5条SE基因TwSEs1~5,TwSEs1~4采用MeJA诱导后与其组织特异性表达相一致,而TwSE5用MeJA诱导后,显示出不同的组织表达模式,认为该基因不响应MeJA的诱导;同时使用CRISPR-Cas9工具通过基因敲除来构建ERG1突变酵母鉴定TwSE的功能,发现只有TwSEs1~4可以在功能上互补ERG1突变酵母。
2.5 CAS在甾体皂苷合成中的表达调控
CAS能够催化2,3-氧化角鲨烯向合成甾体先导化合物环阿屯醇转化,是合成环阿屯醇的关键调控酶,也是很多植物甾醇及甾体类物质生物合成途径中的重要环化酶[52]。与达玛烷合酶(DS)竞争2,3-氧化鲨烯这一共同前体物质流向甾醇及甾体类物质合成途径,而非三萜支流,因此CAS会间接影响三萜皂苷的生物合成[53]。目前已经从药用植物葫芦巴(Trigonella foenum-graecum)和吊兰(Chlorophytum borivilianum)中克隆了该基因,且该基因氨基酸序列长度分别为756 aa和758 aa,其相对分子质量约80 kD,见表2。刘梦迪等[54]利用酵母表达系统对TfCAS蛋白进行了功能验证,结果表明该蛋白能够催化环阿屯醇的合成,并利用葫芦巴发根遗传转化体系在葫芦巴中过量表达TfCAS基因,发现该基因的表达大幅提高,且促进了葫芦巴中β-谷甾醇和薯蓣皂素的生物合成。
2.6 CYP450在甾体皂苷合成中的表达调控
CYP450是广泛存在于动物、植物、细菌及真菌等细胞内的血红素-铁硫蛋白[56],由血红素蛋白、黄素蛋白及磷脂组成,相对分子质量约50 kDa,含有1个保守的血红素结构域,其标签序列为“F×G×R×C×G”,该序列标签是鉴定CYP450的主要特征。CYP450是一种末端加氧酶,从NAD(P)H获得电子后,催化单加氧反应[57]。目前已从6种药用植物中克隆出了该基因,由289~547 aa编码而成,相对分子质量约为30~60 kDa,见表2。YIN等[58]从重楼(Paris polyphylla)中获得了CYP450基因PpCYP90B27,并通过酿酒酵母的异源表达证明该基因编码催化胆固醇形成22(R)-羟基胆固醇的酶。董栩[60]从滇重楼(P. polyphylla var. yunnanensis)中克隆得到了1条CYP450基因,并构建了该基因的原核表达系统,通过SDS-PAGE电泳验证蛋白表达结果,同时通过实时荧光定量篇聚合酶链式反应(Reat-time PCR)发现该基因在根茎中的表达量最高,超过在茎和叶中的表达量的2倍,但茎和叶中的表达量相差不大。JO等[62]从刺五加(Eleutherococcus senticosus)中克隆获得了CYP716A244基因,并在酵母和烟草共表达体系中证实该蛋白参与齐墩果酸的合成。
2.7 SGTase在甾体皂苷合成中的表达调控
SGTase是生物体内一个种类众多、具有高度专一性的超基因家族,具有相似的结构域,但没有明显的同源性。糖基转移酶能催化分子的糖基化修饰反应,可将活性糖基从尿嘧啶核苷二磷酸-葡萄糖转移至植物小分子化合物受体中,如次级代谢物及植物内外源毒性物质等[63]。目前已经从9种药用植物中克隆出该基因,由348~564 aa编码而成,相对分子质量约为30~60 kDa,见表2。李红艳等[65]对丹参中的SmUF3GT基因研究发现,其在紫花丹参中表达量为花萼>花瓣>茎>叶>雌蕊>雄蕊>根,在白花丹参中表达量为雄蕊>叶>花萼>茎>雌蕊>花瓣>根,且推断该基因可能定位于细胞质膜、细胞核以及细胞基质中的过氧化物酶体、高尔基体上。
3 结语与展望
甾体皂苷作为植物中的一类重要次生代谢产物,在部分药用植物中含量丰富,本文针对近5年药用植物甾体皂苷生物合成途径及其关键酶基因的相关研究进行了整理分析,发现相关研究主要集中在关键酶基因的克隆和功能鉴定,涉及具体催化过程、结构修饰和转录水平的调控机制研究较少,缺乏一个系统性和完整性的认知。而甾体皂苷由于其结构多样性,造就了其广泛药用活性和生物学性质,因此具有极大的药用开发潜力和广阔的应用前景,但由于产生甾体皂苷代谢物的植物生命周期通常较长,含量较低,无法满足商业需求,因此找出甾体皂苷的新植物来源并鉴定已知药用植物中新甾体皂苷的存在,研究其生物合成途径,采用合成生物技术以及体外培养等方法来生产皂苷已成为现代研究的热点。
随着现代分子生物学、合成生物学、蛋白组学和生物信息学在各个领域的广泛应用与渗透,在后续研究中,可利用CRISPR-Cas9合成生物技术工具,采用基因组编辑技术,建立用于基因功能分析的突变体并与发根农杆菌介导的转化相结合,深入了解生物合成途径的关键步骤,明确甾体皂苷生物合成的调控机制和对外界因子刺激的响应机制。此外,还可利用次生代谢工程技术,联合转录组测序,全面了解不同药用植物甾体皂苷代谢途径的差异,并筛选出其中的关键酶基因,完成克隆、定位和功能验证;并可通过沉默竞争途径关键酶基因的表达,来增强甾体皂苷的生物合成。同时,亦可通过体外培养技术,采用植物细胞培养、组织培养、根培养、体细胞胚胎发生、添加激素或生物和非生物生长调节剂等方法对甾体皂苷的生物合成进行调控,从而实现药用植物活性物质的大量生产,有效解决药用植物资源匮乏的问题。
