AbMole小课堂 | Angiotensin II(血管紧张素Ⅱ)在心血管研究中的多元应用
Angiotensin II(血管紧张素Ⅱ,AbMole,M6240)是一种血管收缩剂,也是肾素-血管紧张素系统 (RAS) 的主要效应肽。Angiotensin II参与动物的血压调节、水电解质平衡等经典生理过程在科研中Angiotensin II被广泛用于动物心血管疾病模型的构建。AbMole为全球科研客户提供高纯度、高生物活性的抑制剂、细胞因子、人源单抗、天然产物、荧光染料、多肽、靶点蛋白、化合物库、抗生素等科研试剂,全球大量文献专利引用。
一、Angiotensin II(血管紧张素Ⅱ)的机理
Angiotensin II(Ang II,AbMole,M6240)是一种八个氨基酸构成的短肽,主要通过激活其受体AT1R和AT2R发挥生物学效应。AT1R属于G蛋白偶联受体家族,广泛分布于心血管系统、肾脏、肾上腺皮质等多种组织器官中。在心血管系统中,Ang II通过结合AT1R介导血管收缩、促进细胞增殖和纤维化等过程。AT2R 则在胚胎发育时期表达较高,成年后表达量较低,但在一些病理状态下,如组织损伤、炎症等,其表达可上调。
二、Angiotensin II(血管紧张素Ⅱ)的科研应用
1. Angiotensin II(Ang II)用于构建动物高血压模型
Angiotensin II(Hypertensin II,AbMole,M6240)是一种构建动物高血压模型的重要工具。有研究证实可通过皮下输注Angiotensin II来诱导高血压模型[1]。也有文献是将含有Angiotensin II的渗透泵植入小鼠体内,以持续释放Angiotensin II(血管紧张素Ⅱ)。例如,12周龄的C57Bl/6J雄性小鼠在植入可释放1.1 mg/kg/24h的Angiotensin II渗透泵2周后,其收缩压在显著升高至165.5±3.9 mmHg,并且这种高血压状态可以持续4周[2]。用上述这种方法可以模拟慢性高血压的病理过程,适用于研究长期高血压对机体的影响。Angiotensin II也可以用于构建大鼠高血压模型。例如,有研究使用渗透泵以 1.1mg/kg/24h的剂量持续释放Angiotensin II,成功诱导了大鼠高血压模型[3]。Angiotensin II(Ang II)构建动物高血压模型的主要机理是:在Angiotensin II输注模型中,外源性Angiotensin II(Ang II,AbMole,M6240)直接作用于肾素-血管紧张素系统 (RAS) ,增加循环系统和组织中的Angiotensin II水平,从而激活AT1受体,引起血管收缩和钠潴留,导致血压升高[4];此外,作为一种血管收缩剂,Angiotensin II可通过作用于血管平滑肌细胞上的AT1受体,增加细胞内钙离子浓度,导致血管平滑肌收缩,增加外周血管阻力,从而升高血压[5];并且Angiotensin II能够通过激活NADPH氧化酶,增加活性氧(ROS)的生成,导致氧化应激,氧化应激可以损伤血管内皮细胞,减少一氧化氮(NO)的生成,从而进一步促进血管收缩和血压升高[6];此外,氧化应激还可能通过激活多种信号通路,如ERK1/2-STAT3信号通路等,参与高血压的发展[7]。2014年,AbMole的两款抑制剂分别被西班牙国家心血管研究中心和美国哥伦比亚大学用于动物体内实验,相关科研成果发表于顶刊 Nature 和 Nature Medicine。
2. Angiotensin II(Ang II)用于构建动物主动脉夹层模型
Angiotensin II(Hypertensin II,AbMole,M6240)也可用构建模式动物(大鼠、小鼠、兔子等)主动脉夹层模型,一般需要将Angiotensin II与β-氨基丙腈(BAPN,AbMole,M10552)或者高脂饮食联合处理实验动物。其中BAPN可通过饮水给药,Angiotensin II 则一般为皮下输注[8]。Angiotensin II 诱导主动脉夹层的机制主要包括以下几点:Angiotensin II 可诱导氧化应激并进一步激活炎症信号通路,如NF-κB,促进炎症因子的释放,导致血管平滑肌细胞(VSMC)的表型转化和功能紊乱。BAPN则可抑制赖氨酸氧化酶,破坏胶原蛋白和弹性蛋白的交联,导致细胞外基质的降解,从而增加主动脉壁的脆弱性。最后Angiotensin II 诱导的高血压可增加主动脉壁的剪切力,促进主动脉夹层的形成。
3. Angiotensin II(Ang II)用于其它心血管疾病的研究
Angiotensin II (血管紧张素Ⅱ,AbMole,M6240)还可用于其它心血管疾病的研究。Angiotensin II 可促进心肌细胞肥大、细胞外基质重塑以及炎症反应。例如,有研究表明Angiotensin II 可以通过激活AT1受体,促进心肌细胞的增殖和迁移,导致心肌肥大和纤维化[9]。此外,Angiotensin II 还与动脉粥样硬化和血管老化等心血管疾病的发生发展密切相关[10]。
4. 其它
Angiotensin II(血管紧张素Ⅱ,Ang II,AbMole,M6240)也是研究感染性休克动物模型的经典生物活性分子。Angiotensin II 的作用机制包括对血管收缩和炎症反应的调节。尽管内源性Angiotensin II水平在感染性休克中通常会升高,但其受体(如AT1受体)的表达可能会因炎症因子(如TNF-α)的作用而下调,导致对Angiotensin II(血管紧张素Ⅱ)的反应性降低。外源性输注Angiotensin II可以克服这一问题[11]。此外,Angiotensin II 可以通过增强髓系细胞的信号传导,提高细菌清除能力。Angiotensin II 还可以调节T细胞的活化和分化,影响自身免疫疾病(如类风湿关节炎)的发生和发展。
三、范例详解
1.Acta Pharmacol Sin. 2024 May;45(5):975-987.
香港中文大学的实验人员在上述论文中研究了内皮细胞中的Orai1通道在正常血压和高血压小鼠颈总动脉的内皮依赖性收缩(Endothelium-Dependent Contraction, EDC)中的作用。研究通过多种实验方法,揭示了Orai1在调节EDC中的重要性,并探讨了其在高血压状态下的变化。实验人员首先通过渗透泵输注Angiotensin II(1.5 mg·kg⁻¹·d⁻¹)来建立高血压小鼠模型。通过在颈总动脉和主动脉段上施用乙酰胆碱(ACh)来诱导EDC,并使用特定的Orai1抑制剂(如AnCoA4和YM58483)来评估Orai1在EDC中的作用。最后通过张力测量、Ca²⁺浓度测量、免疫印迹(Western blotting)、免疫荧光染色和酶联免疫分析等实验,成功证明了Orai1在正常血压和高血压小鼠的EDC中都起着重要作用。Orai1抑制剂显著减少了ACh诱导的EDC,表明Orai1参与了EDC反应。由AbMole提供的Angiotensin II(Ang II,血管紧张素Ⅱ,AbMole,M6240)在本文中用于建立高血压小鼠模型[12]。
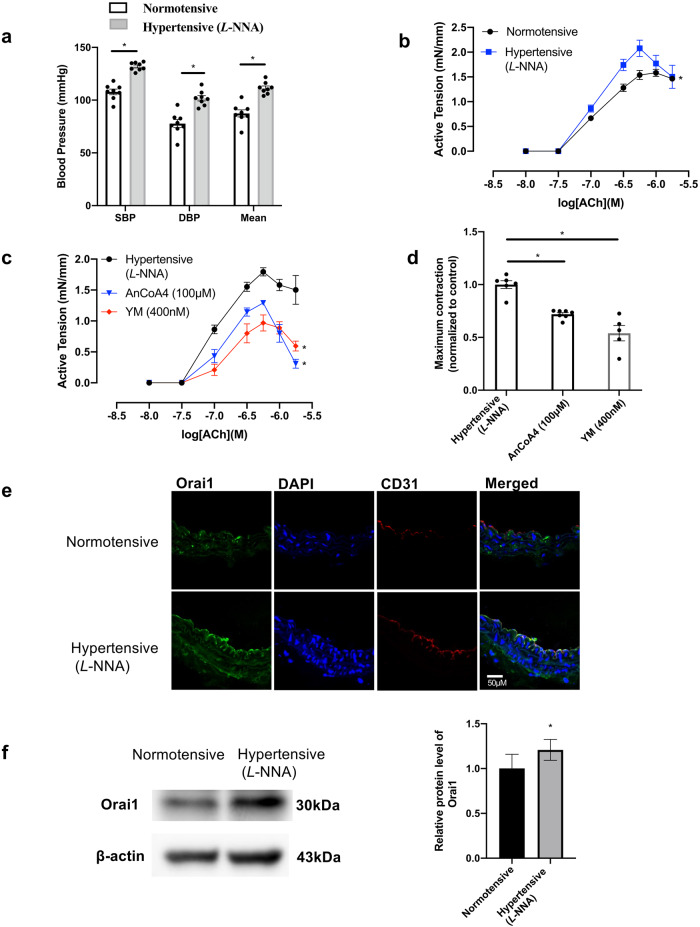
图 1. Orai1 participates in ACh-induced EDC in carotid arteries of L-NNA-induced hypertensive mice[12].
2.BMC Cardiovasc Disord. 2024 Feb 14;24(1):106.
青岛大学附属医院的科研人员在该文章中研究了Sacubitril对血管平滑肌细胞(VSMCs)增殖和迁移的抑制作用及其机制;并探讨了Notch信号通路和ERK1/2通路在Sacubitril 抑制VSMCs增殖中的作用。在实验中科研人员发现Ang II显著增加了VSMCs的增殖和迁移,以及PCNA、MMP-9、Notch1、Jagged-1和p-ERK1/2的表达;而Sacubitril显著减少了Ang II诱导的VSMCs增殖和迁移,并降低了上述基因和蛋白的表达;在上述文章中,来自AbMole的Angiotensin II(Ang II,血管紧张素Ⅱ,AbMole,M6240)被用作刺激VSMCs增殖和迁移的诱导剂[13]。
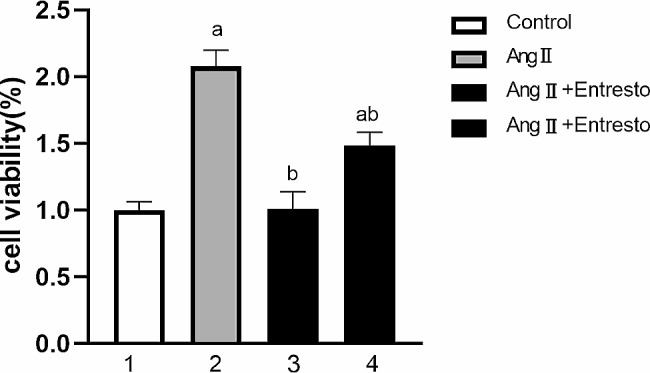
图 2. The effect of Entresto on VSMCs proliferation stimulated by AngII[13]
AbMole是ChemBridge中国区官方指定合作伙伴。

参考文献及鸣谢
[1] N. Kawada, E. Imai, A. Karber, et al., A mouse model of angiotensin II slow pressor response: role of oxidative stress, Journal of the American Society of Nephrology : JASN 13(12) (2002) 2860-8.
[2] N. Gletsu, T. N. Doan, J. Cole, et al., Angiotensin II-induced hypertension in mice caused an increase in insulin secretion, Vascular pharmacology 42(3) (2005) 83-92.
[3] I. Vaněčková, Z. Dobešová, J. Kuneš, et al., The effects of repeated delivery of angiotensin II AT(1) receptor antisense on distinct vasoactive systems in Ren-2 transgenic rats: young vs. adult animals, Hypertension research : official journal of the Japanese Society of Hypertension 35(7) (2012) 761-8.
[4] H. E. Yim, K. H. Yoo, Renin-Angiotensin system - considerations for hypertension and kidney, Electrolyte & blood pressure : E & BP 6(1) (2008) 42-50.
[5] M. Yasujima, K. Abe, H. Aoyagi, et al., Effects of 1-sarcosine-8-isoleucine-angiotensin II on blood pressure and plasma renin activity in various types of hypertension, The Tohoku journal of experimental medicine 116(3) (1975) 277-83.
[6] Y. Wang, I. S. Panicker, J. Anesi, et al., Animal Models, Pathogenesis, and Potential Treatment of Thoracic Aortic Aneurysm, International journal of molecular sciences 25(2) (2024).
[9] N. He, Q. H. Gong, F. Zhang, et al., Evodiamine Inhibits Angiotensin II-Induced Rat Cardiomyocyte Hypertrophy, Chinese journal of integrative medicine 24(5) (2018) 359-365.
[10] S. Crunkhorn, Atherosclerosis: Haematopoietic mutation promotes atherogenesis, Nature reviews. Drug discovery 16(3) (2017) 166.
[11] Fortunato Senatore, Pitchai Balakumar, Gowraganahalli Jagadeesh, Dysregulation of the renin-angiotensin system in septic shock: Mechanistic insights and application of angiotensin II in clinical management, Pharmacological research 174 (2021) 105916.
[12] X. Li, Z. C. Lei, C. Y. Lo, et al., Endothelial cell Orai1 is essential for endothelium-dependent contraction of mouse carotid arteries in normotensive and hypertensive mice, Acta pharmacologica Sinica 45(5) (2024) 975-987.
[13] C. Xu, N. Zhang, H. Yuan, et al., Sacubitril/valsartan inhibits the proliferation of vascular smooth muscle cells through notch signaling and ERK1/2 pathway, BMC cardiovascular disorders 24(1) (2024) 106.
