Cancer Discov (IF:30.6)|中山一院于君/匡铭合作解析瘤内微生物的异质性和促肿瘤机制

很多肝细胞癌(HCC)患者初诊时为多灶性肿瘤,可能源于肝内转移(IM)或多中心发生(MO)。其中IM-HCC预后较差,但其分子机制尚不明确。近年来研究发现,肿瘤内微生物可通过诱导突变、激活致癌通路等方式影响肿瘤进展,但多灶性HCC的微生物异质性及其与宿主基因的关联尚未被研究。近期,中山大学第一附属医院/香港中文大学的于君联合匡铭团队在《Cancer Discovery》(IF:30.6)上发表题为“Intra-hepatic microbial heterogeneity in multifocal hepatocellular carcinoma and its association with host genomic and transcriptomic alterations”的研究论文,通过整合多组学分析和功能实验,揭示了肝内微生物在多灶性HCC中的异质性及其在肿瘤进展中的作用。

研究方法与设计
纳入58例多灶性HCC患者,采集242个肿瘤结节和58个配对非肿瘤组织,进行多组学分析:16S rRNA测序(分析微生物组成),全外显子测序(检测基因突变和肿瘤异质性),RNA测序(研究宿主基因表达差异),PCF空间单细胞蛋蛋白组(CODEX)结合16S荧光原位杂交(空间解析不同免疫细胞、基质细胞和细菌微环境在肿瘤组织中的精确分布)。
关键实验验证:革兰氏染色、LPS/LTA免疫组化、透射电镜确认肿瘤内细菌存在。通过共培养实验和小鼠模型分析特定细菌(如粪肠球菌、咽峡炎链球菌)对肿瘤转移和免疫微环境的影响。

主要发现
1.多灶性HCC的微生物异质性及和宿主基因的关联分析
研究发现了同一患者的不同肿瘤结节中微生物组成差异显著。高变异微生物如链球菌属、乳杆菌属在不同结节中丰度波动大。IM结节富集粪肠球菌(Enterococcus faecalis)、咽峡炎链球菌(Streptococcus anginosus)和梭杆菌属(Fusobacterium)。MO结节富集寡养单胞菌属(Stenotrophomonas)和棒状杆菌属(Corynebacterium)。基于9个差异菌属的随机森林模型可区分IM与MO结节(AUC=0.795)。
根据基因组突变谱将患者分为IM-HCC(高克隆突变)、MO-HCC(无共享突变)和混合型三类,其中 IM-HCC的微生物多样性与宿主基因异质性显著相关。
转录组分析发现了IM结节中EMT通路(如SNAI2、CEACAMs)显著上调。微生物-宿主相关性分析揭示了IM富集菌(如粪肠球菌)与EMT相关基因(如SLC2A1、VEGFA)呈现显著正相关。说明了IM富集菌或许通过调控EMT过程影响IM-HCC的进展。

2.PCF空间单细胞蛋白组联合16s原位杂交解析微生物-免疫微环境互作机制
为了解析微生物对免疫微环境的影响,研究者对6例IM-HCC样本和4例MO-HCC样本开展了PCF空间单细胞蛋白组检测,同时邻片进行16s荧光原位杂交。16种抗体检测诠释了不同的免疫和基质细胞类型,包括B cells、CD4+ T cells、CD8+ T cells、dendritic cells、myeloid-derived suppressor cells (MDSCs)、Treg、tumor-associated macrophages(TAMs)、fibroblasts、endothelial cells。

PCF空间单细胞蛋白组结合16S FISH(荧光原位杂交),同时标记细菌和免疫细胞标记物,直接验证细菌与免疫抑制微环境的共定位关系。结果发现了MDSCs在IM-HCC中显著富集,空间定位上MDSCs显著聚集在细菌定植区域周围,提示细菌通过局部招募免疫抑制细胞促进肿瘤免疫逃逸,同时抑制CD8+ T细胞的浸润和功能。另外空间高分辨率分析发现了细菌主要分布于血管附近,支持了细菌可能通过血行播散从肠道迁移至肝脏的假设。

3.功能验证细菌促进肿瘤转移的机制
体外实验表明了粪肠球菌和咽峡炎链球菌共培养显著增强了HCC细胞迁移和侵袭能力。小鼠模型发现了细菌处理组肿瘤体积和Ki-67表达显著增加。细菌诱导EMT表型,包括E-钙黏蛋白下调,N-钙黏蛋白和Snail上调。细菌诱导免疫抑制微环境,包括MDSCs增多,CD8+ T细胞活性和IFN-γ分泌降低。
最后研究者证实了微生物的肠道-肝脏迁移。无菌小鼠口服特定细菌(如粪肠球菌)后,肝脏和肿瘤中都检测到活菌,并加速肿瘤生长。

总结与讨论
该研究首次揭示了多灶性HCC的微生物异质性,为理解肿瘤内微生物的空间分布提供了新视角。提示了基于微生物的分子分型可能指导临床治疗决策。阐明了特定细菌通过EMT和免疫抑制促进转移的机制,为靶向微生物治疗HCC提供了依据。特别是PCF空间单细胞蛋白组主导的空间多组学分析,将微生物异质性、宿主免疫响应和肿瘤转移机制在空间维度上整合,揭示了细菌通过局部重塑免疫抑制微环境促进HCC进展的具体路径。PCF空间单细胞单细胞蛋白组为未来探索“肿瘤-微生物-免疫”三方互作提供了方法论范例,凸显了空间生物学在癌症研究中的核心价值。
华盈生物空间多模态研究体系
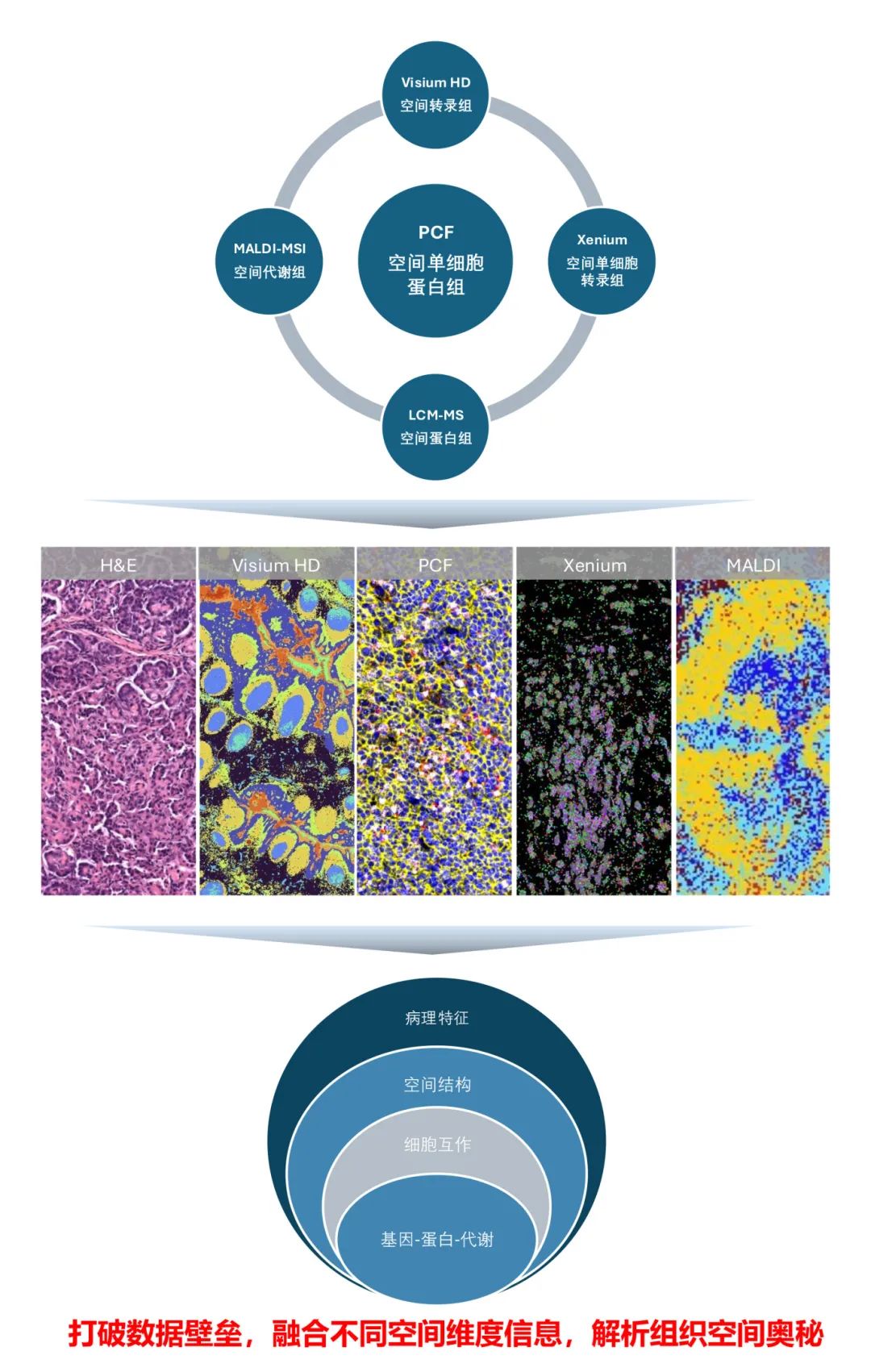
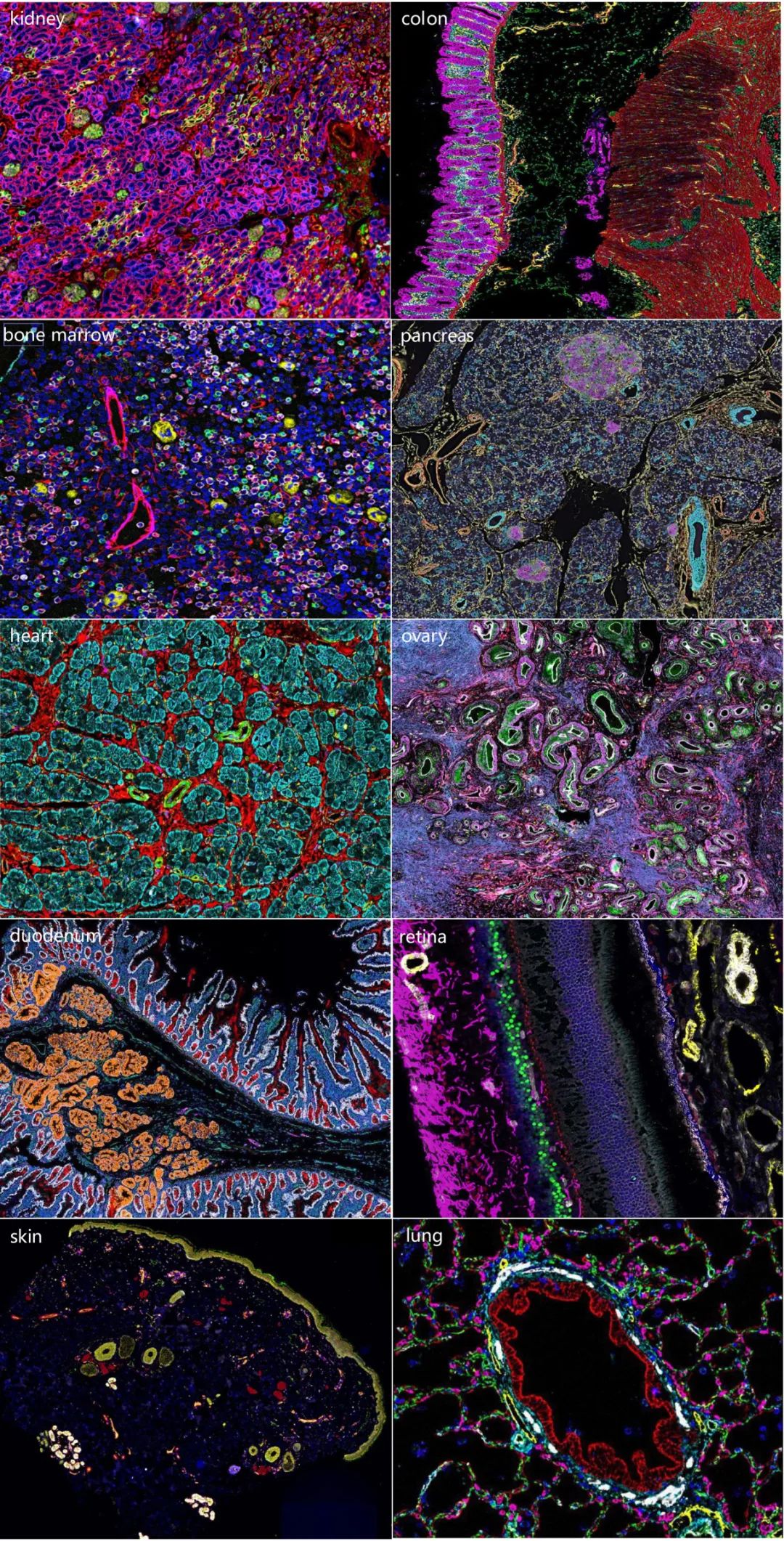
PCF空间单细胞蛋白组成像示例
相关文献
Lu Y, Xu L, Chen W, Liu W, Zhang Y, Zhou Q, Wang N, Zhang Y, Bai H, Xu S, Huang P, Fu K, Xie W, Liu X, Wang X, Wong CC, Kuang M, Yu J. Intra-hepatic microbial heterogeneity in multifocal hepatocellular carcinoma and its association with host genomic and transcriptomic alterations.Cancer Discov. 2025. Online ahead of print.
