AI 空间细胞表型分析赋能肺癌诊疗:从 “看大小” 到 “看邻里”,精准分层风险
小罗碎碎念
肺癌风险分层的“包裹困境”:为何传统分期总漏判高风险患者?
作为全球癌症死亡的“头号杀手”,2020年肺癌夺走了约180万人的生命,其中非小细胞肺癌(NSCLC)占比超80%。
医生判断NSCLC患者风险的“金标准”,是国际癌症控制联盟(UICC)的TNM分期系统:看肿瘤大小(T)、区域淋巴结是否转移(N)、是否有远处扩散(M)。
这套系统就像快递的“外观检查”,靠可测量的“物理指标”给患者分组,比如I期患者被定义为“低风险”,优先手术切除,部分人可能接受辅助化疗。
但问题来了:约一半的I-III期患者在术后会复发,21%-71%的患者在确诊5年内离世。
更棘手的是,即便用了下一代基因测序,医生也找不到靠谱的“生物标志物”来区分:
- 哪些早期患者其实是“隐藏高风险”,需要更积极的辅助治疗;
- 哪些患者其实风险很低,没必要承受化疗的副作用。
真正的破局点,藏在肿瘤微环境(TME)这个“小社区”里——肿瘤不是孤立的“肿块”,而是由癌细胞、免疫细胞、基质细胞等构成的复杂生态系统——就像一个社区里有居民、保安、维修人员,他们的数量、位置和互动方式,才真正决定社区的“稳定程度”。
过去研究虽发现免疫细胞的重要性,但要么只盯着一两种细胞(比如CD8+T细胞),要么忽略它们的空间关系;
而现在,一项发表在《Nature Communications》的研究,用AI驱动的空间细胞表型分析技术,首次完整“绘制”了这个社区的“邻里地图”,让肺癌风险分层从“看大小”升级为“看互动”。

该研究聚焦非小细胞肺癌(NSCLC)风险分层的临床痛点,提出了一套AI驱动的空间细胞表型分析方案,核心是整合组织病理学、12重免疫荧光(mIF)成像与多模态机器学习技术,系统性解析肿瘤微环境(TME)中43种细胞表型的复杂空间关系。
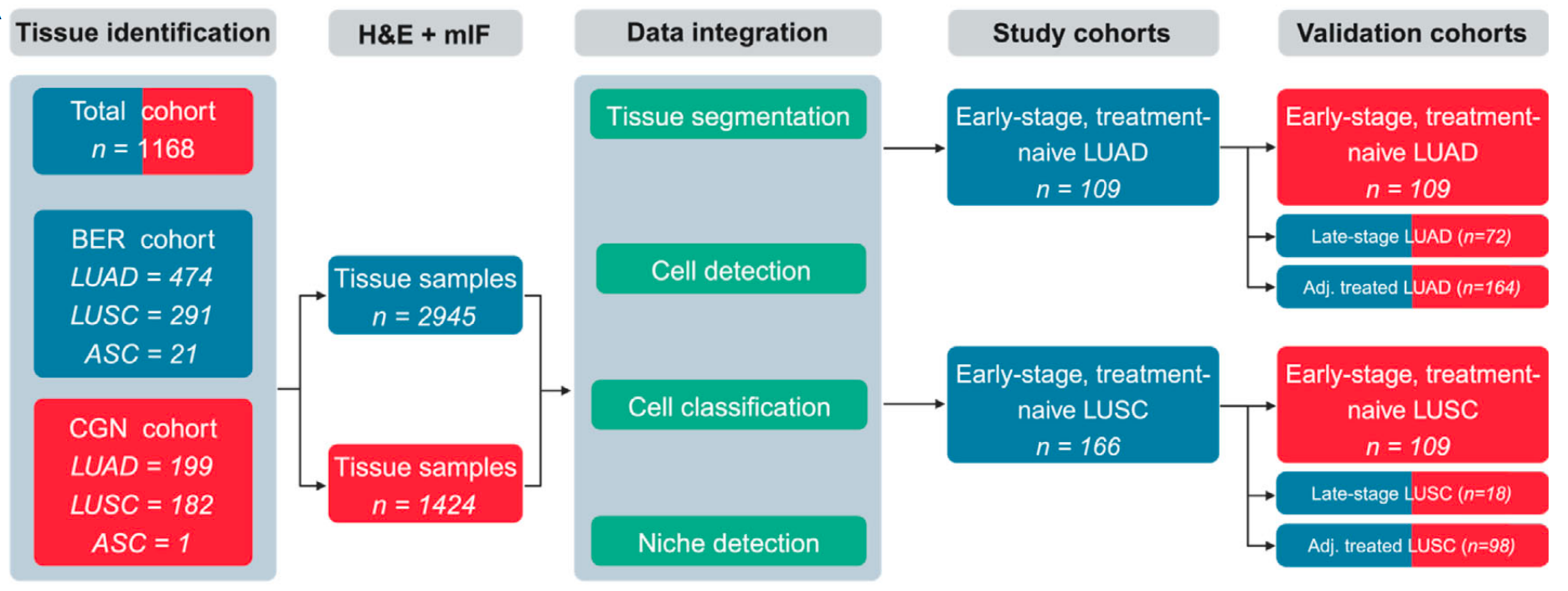
研究基于1168例来自德国两家癌症中心的NSCLC回顾性队列,构建了涵盖组织分割、细胞检测与分类的14个AI模型 pipeline,其中UNet用于组织区域划分(宏观F1=0.92)、优化StarDist实现细胞定位(F1=0.91)、12个独立ConvNext模型完成细胞分型(平均F1=0.91),最终通过34微米半径邻域分析识别出10种具有预后意义的“细胞生态位”(cell niche),为NSCLC风险分层提供了超越传统UICC TNM分期的空间生物学视角。
从医学AI研究视角看,该工作的创新点在于:
- 一是突破传统TME分析“重数量轻空间”的局限,通过生态位建模捕捉细胞间的局部互动模式,为AI解析复杂微环境生态提供了可复用的方法论;
- 二是采用“多模型分工+避免Clever Hans效应”的设计(如12个独立分型模型),提升了AI结果的可靠性与可解释性;
- 三是基于大样本真实世界队列(5300万细胞级分析)验证,为后续泛癌种空间表型AI研究提供了样本设计、模型训练与临床验证的完整范式,尤其对免疫治疗响应预测、生物标志物发现等方向具有重要参考价值。
医学AI交流群
目前小罗全平台关注量120,000+,交流群总成员3000+,大部分来自国内外顶尖院校/医院,期待您的加入!!
由于近期入群推销人员较多,已开启入群验证,扫码添加我的联系方式,备注姓名-单位-科室/专业,即可邀您入群。
病理AI一站式分析软件
我们团队针对刚入门病理AI领域的同学/老师,开发了一个一站式软件,可以让大家避免复杂的命令行操作;
为了更好的让大家掌握软件的使用,我们还配备了详细的使用教程和配套的课程。如果想要了解细节,可以查看下列推送。
如果有需要,可以扫码咨询!
一、AI破解肿瘤微环境密码:三步读懂细胞“邻里关系”
这项技术的核心突破,在于把“显微镜观察”“荧光染色”和“AI大脑”三者无缝结合,不再孤立看待细胞,而是分析它们的“空间社交网络”。
简单说,它的工作逻辑是:先给细胞“贴标签”显形,再用AI精准“认人”“分区”,最后找到影响患者生存的“危险邻里组合”(细胞生态位,cell niche)。
第一步:给肿瘤“社区”拍张“彩色高清照”
要分析细胞的互动,首先得让不同细胞“显形”。
研究团队从1168名NSCLC患者(来自柏林和科隆两家癌症中心)的肿瘤组织中,取出4个直径1.5毫米的“组织芯”,拼成“组织微阵列”(TMA)——相当于从社区不同区域取“样本街区”来研究。
接着,他们用两种方式给这些“样本街区”染色:
HE染色
传统病理染色,能看清组织的大致结构,比如哪里是癌细胞、哪里是坏死区,就像社区的“黑白底图”;
12重免疫荧光(mIF)染色
给12种关键“细胞身份标志物”贴不同颜色的荧光标签,比如用红色标T细胞(CD3)、绿色标癌细胞(CK)、蓝色标免疫检查点分子(PD-L1)。
这样一来,43种不同类型的细胞(比如杀伤性T细胞、 immunosuppressive癌细胞、M2型巨噬细胞)就像穿了不同颜色衣服的居民,清晰可见。
第二步:AI当“社区管理员”,精准“认人”“分区”
面对57000张显微图像、5300万个细胞,人工分析根本不可能——这时候AI的“超算能力”就派上用场了。
研究团队开发了14个AI模型,分工完成三项核心任务:
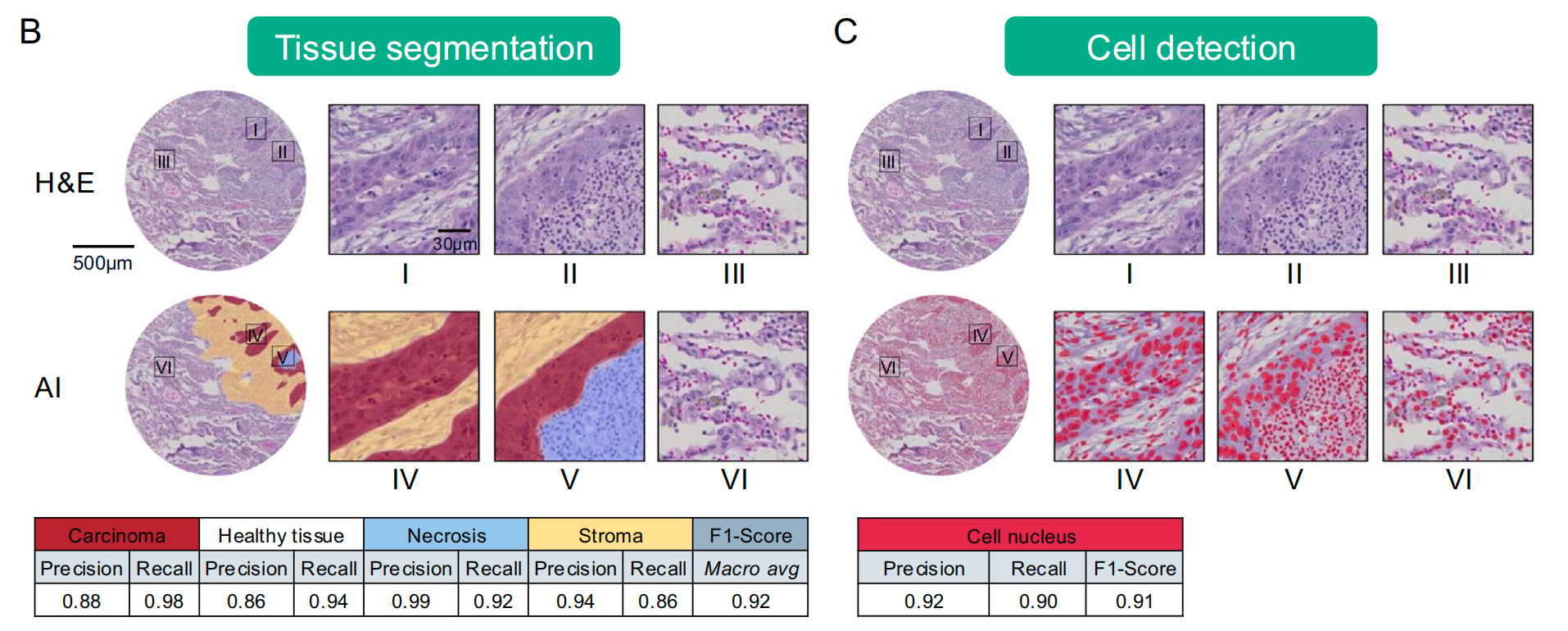
组织分割:给社区画分区
用UNet深度学习模型,把组织分成“癌细胞区”“健康组织区”“坏死区”“基质区”。
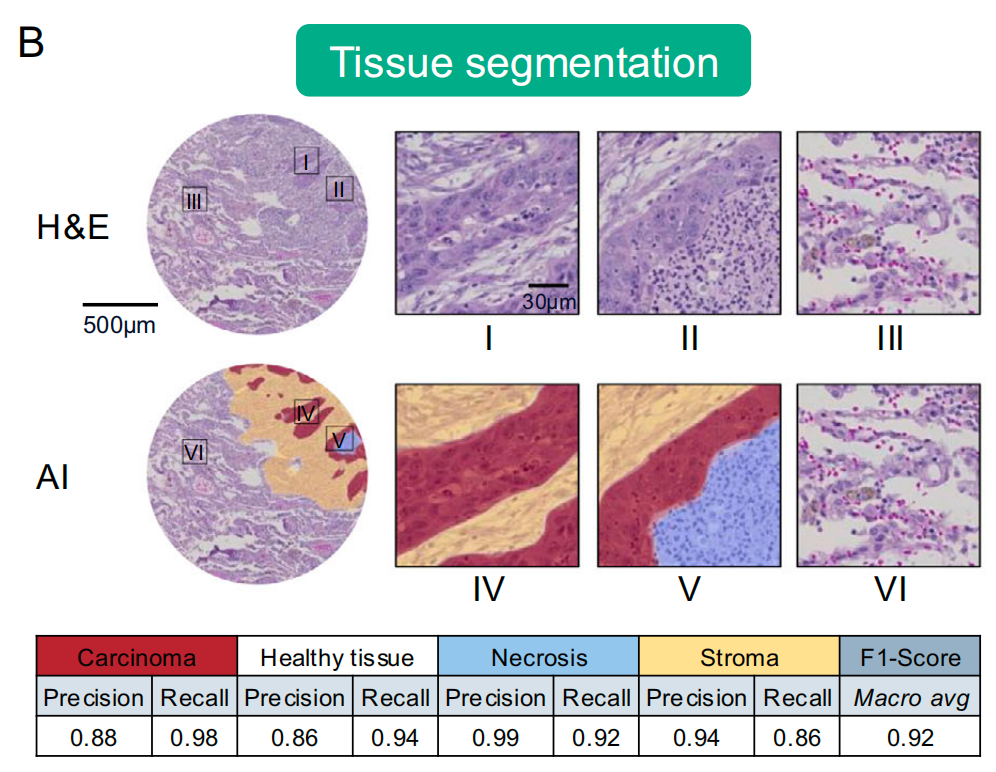
这就像管理员根据建筑类型,把社区划分为“住宅区”“商业区”“废弃区”,确保后续分析只聚焦在有意义的区域。
最终模型的准确率(宏观F1分数)达到0.92,几乎和病理医生的判断一致。
细胞检测:找出社区里的每个人
优化后的StarDist模型(专门用于细胞检测的AI),能精准定位每个细胞的细胞核——就像用“人脸识别”在人群中找出每一个人,哪怕细胞密密麻麻挤在一起也不会漏判。
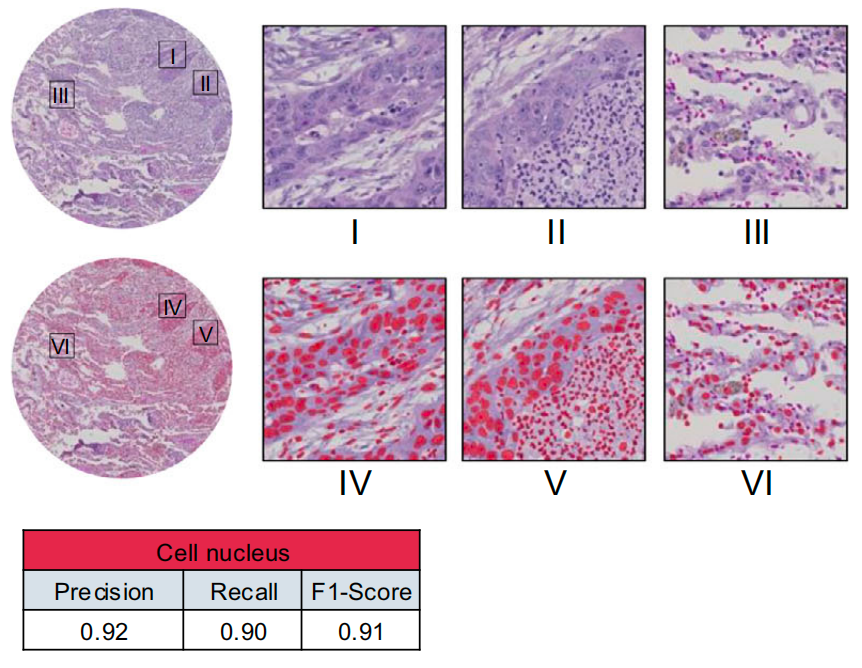
测试显示,它的准确率(F1分数)是0.91,比传统人工计数快了成千上万倍。
细胞分类:给每个人贴身份标签
用12个独立的ConvNext模型,分别识别每种荧光标签对应的细胞类型。
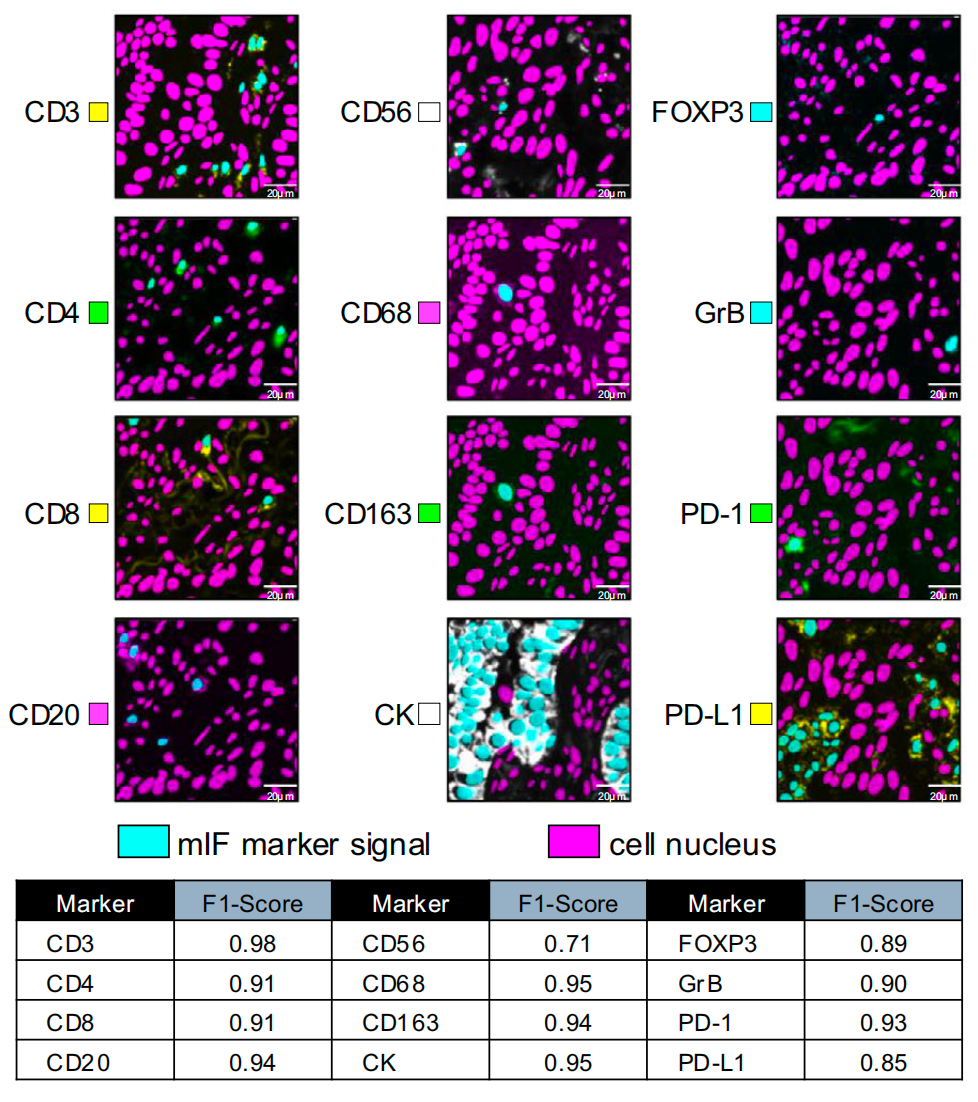
这里有个特别巧妙的设计:每个模型只负责一种标签,避免“聪明汉斯效应”(比如模型偷偷用其他标签的信息作弊,导致结果不可靠)。
就像每个管理员只检查一种证件(比如身份证、工作证),确保身份判断的准确性。最终,43种细胞的分类准确率平均达到0.91。
第三步:寻找“危险邻里组合”——细胞生态位
这是最关键的一步。
研究团队定义了一个“34微米半径”的范围(约等于2-3个免疫细胞并排的长度),把每个细胞周围的“邻居”类型和数量统计出来,再通过聚类算法,找出10种最常见的“细胞邻里组合”,也就是“细胞生态位”(cell niche)。
比如有的生态位是“癌细胞主导型”:周围几乎全是癌细胞,很少有免疫细胞(类似“无人管理的混乱社区”);
有的是“免疫活跃型”:癌细胞周围围着大量T细胞、B细胞,还有PD-L1阳性细胞(类似“安保严密、居民活跃的社区”);
还有的是“巨噬细胞富集型”:周围全是M2型巨噬细胞(这种细胞常帮癌细胞“逃避免疫攻击”,类似“社区里混进了坏人”)。
这些生态位的组合,才是决定患者风险的关键——就像社区的“邻里氛围”,比社区大小更能反映安全程度。
二、1168例患者验证:AI生态位模型如何超越传统分期?
研究团队用“柏林队列”(786名患者)训练AI模型,用“科隆队列”(382名患者)做验证,重点对比了“AI生态位模型+UICC8分期”和传统“UICC8分期”的风险分层能力。
基准测试:风险预测准确率大幅提升
衡量风险预测能力的核心指标是“ concordance指数(c指数)”:数值越接近1,预测越准确;0.5相当于随机猜测。
传统UICC8分期对LUAD(肺腺癌,NSCLC的主要亚型之一)的c指数是0.633,对LUSC(肺鳞癌,另一主要亚型)是0.630。
而加入AI生态位分析后:
- LUAD的风险分层准确率提升了14%,c指数达到0.665;
- LUSC的提升更显著,达到47%,c指数达到0.692。
这意味着什么?
举个例子:以前医生判断100个LUAD患者的生存风险,能准确排序63个;现在加入生态位分析后,能准确排序66-67个——别小看这3-4个的提升,对患者来说,这可能就是“是否需要辅助治疗”的关键区别。
真实场景验证:揪出I期患者中的“隐藏高风险”
最让临床医生兴奋的,是AI模型对I期患者的“再分层能力”。
根据现行指南,I期NSCLC患者术后通常不推荐辅助化疗,但研究发现,约一半的I期患者被AI模型重新归类为“高风险”,他们的预后和传统II期患者(需要辅助化疗)几乎一样差。
比如在LUAD患者中,148名传统I期患者里,61人被归为“低风险”(5年生存率显著更高),163人被归为“高风险”(5年生存率和II期患者接近)。
这意味着,这些“高风险I期患者”可能需要像II期患者一样接受辅助治疗,而“低风险I期患者”则可以避免不必要的化疗副作用——这正是精准医疗的核心目标:让该治的患者不漏治,让不该治的患者不受罪。
细节验证:生态位的“冷热”决定预后
研究还发现了一个有趣的规律:
- “热生态位”(免疫细胞丰富,比如T细胞、B细胞多)多的患者,预后更好;
- “冷生态位”(癌细胞主导、巨噬细胞多、免疫细胞少)多的患者,预后更差。
比如LUSC患者中,“冷肿瘤”(几乎没有免疫细胞的生态位)的比例是14.8%,远高于LUAD的5.6%——这也解释了为什么LUSC患者对免疫治疗的响应率通常比LUAD低。
而AI模型能精准识别这些“冷热生态位”的组合,让风险分层不再“一刀切”。
三、从肺癌到泛癌种:空间细胞表型分析的未来想象
这项技术的价值,远不止提升肺癌风险分层的准确率——它正在改变我们对肿瘤的认知,甚至推动整个癌症研究的范式转变。
对肿瘤研究的改变:从“单打独斗”到“生态系统分析”
过去,研究肿瘤要么只看癌细胞的基因突变,要么只看某一种免疫细胞的数量;
现在,AI空间细胞表型分析能让我们看到“细胞间的互动”——比如PD-L1阳性的癌细胞周围是否有PD-1阳性的T细胞(这决定了免疫治疗是否有效)、B细胞是否形成“三级淋巴结构”(一种能增强免疫应答的组织)。
这些信息,是传统技术完全无法获取的。
比如研究发现,B细胞丰富的生态位在LUAD中更常见,而LUSC中很少——这可能是两种亚型对治疗响应不同的关键原因,为后续针对性治疗提供了新方向。
四、未来展望:从“风险分层”到“治疗指导”
下一步,研究团队计划将这项技术与多组学数据(比如基因测序、蛋白质组学)结合,不仅能判断患者的风险,还能预测患者对哪种治疗(比如免疫治疗、靶向治疗)最敏感。
比如识别出“巨噬细胞富集型”生态位的患者,可能需要联合抗巨噬细胞的药物;“T细胞耗尽型”生态位的患者,可能需要联合免疫检查点抑制剂。
长远来看,这项技术还能扩展到乳腺癌、结直肠癌等其他癌症——毕竟所有实体瘤都有肿瘤微环境,都需要精准的风险分层和治疗指导。
五、写在最后:科技的温度,藏在“看见细节”里
从“看肿瘤大小”到“看细胞邻里关系”,AI空间细胞表型分析的突破,本质上是让我们更“细致”地看待癌症——不再把肿瘤当作一个孤立的“肿块”,而是一个有生命的“生态系统”。
这项研究来自《Nature Communications》2025年的论文(标题:AI-powered spatial cell phenomics enhances risk stratification in non-small cell lung cancer,DOI:10.1038/s41467-025-65783-z),由柏林和慕尼黑的研究团队共同完成。
它不仅展示了AI在医学领域的“超算能力”,更体现了科技的温度——通过读懂细胞的“社交网络”,让医生对患者的判断更精准,让治疗更个体化,最终让更多癌症患者避免“漏治”或“过度治疗”的困境。
或许未来某一天,癌症风险分层会像“社区管理”一样精细:不仅知道社区的大小,更清楚里面的“邻里关系”,从而制定最适合的“管理方案”——这正是精准医疗的终极目标,也是科技进步带给人类的希望。
