Adv. Sci.:在精神分裂症中绘制大脑协同功能障碍图谱:理解个体差异和潜在的分子机制
目录
1引言
2 结果:多维度解析精神分裂症患者大脑协同功能障碍
2.1 全脑协同功能障碍
2.2 三个协同因素
2.3 个体水平的因素表达与精神分裂症参与者特征之间的关联
2.4 转录组关联对三个因素进行分析
2.5认知、分子和神经动力学相关性
3. 讨论
4. 结论
5. 实验部分
概况与总结
本文通过信息解析方法和层次贝叶斯模型,研究了精神分裂症(SCZ)患者大脑信息交互功能障碍的个体差异及其分子机制。研究发现,SCZ患者表现出全脑协同交互的显著降低,并通过三个潜在因素揭示了其症状异质性:因素1与阳性症状相关,因素3与阴性症状和一般症状相关。此外,研究结合基因表达和分子影像数据,揭示了这些因素对应的独特神经生物学机制,为理解SCZ的病理生理机制提供了新的视角。
摘要
本文研究旨在阐明精神分裂症(Schizophrenia, SCZ,后文将统一使用缩写)患者大脑信息交互的个体差异及其背后的分子机制。为此,本文采用信息解析方法,基于区域间血氧水平依赖(BOLD)时间序列构建了个体化的协同和冗余信息交互矩阵,并分析了538名SCZ患者和540名正常对照(NC)的数据。研究揭示了SCZ患者中一种稳定的区域性协同功能障碍模式,并进一步通过层次贝叶斯模型将全脑协同功能障碍分解为三个潜在因素,这些因素解释了SCZ症状的异质性。其中,因素1与阳性症状评分显著正相关,而因素3与阴性症状和一般症状评分显著负相关。通过整合神经影像学数据与标准化的基因表达信息,研究发现这三个因素分别对应SCZ风险基因的一个子集。此外,结合NeuroSynth数据库和开放分子影像数据源,以及空间异质性平均场模型(pMFM),研究进一步描绘了与不同症状特征相关的三个SCZ协同因素,并揭示了其独特的认知、神经动力学和神经生物学机制。
1引言
精神分裂症(SCZ)是一种常见且严重的心理障碍,在全球疾病负担中位居前列。准确诊断和治疗精神分裂症正面临挑战,主要原因是SCZ复杂的病理机制尚不明确。众多fMRI研究已报告了与SCZ相关的大脑功能异常,包括脑活动和连接性的中断。这些研究进一步揭示了与异常大脑功能或神经回路相关的潜在神经影像学生物标志物。然而,由于SCZ背景下大脑的复杂性,以及个体间观察到的广泛异质性,带来了重大障碍。
因此,阐明SCZ中大脑复杂的功能组织,并解开患者的异质性,对于深入理解SCZ的病理生理学,并为未来开发精准的诊断和治疗策略提供证据至关重要。精神分裂症常被描述为一种“断开连接综合征”(disconnection syndrome),其特征是大脑区域间信息交互的紊乱。以往研究主要依赖于功能连接(FC)等传统指标来量化大脑区域间的相似性,但这些方法无法全面描述大脑的信息处理架构。本研究引入了“信息分解”(Information Decomposition)方法,通过分析协同(synergy)和冗余(redundancy)信息交互,揭示SCZ患者大脑功能组织的异常。
在全面了解SCZ中大脑信息处理障碍的模式后,认识到SCZ患者在不同层面上的显著异质性至关重要,包括大脑异常、核心SCZ症状、认知能力和抗精神病药物反应。近期研究表明,通过解剖学定义的亚组可以提高预测SCZ症状严重程度的准确性。因此,本研究从多维角度揭示SCZ患者异常大脑信息交互的个体差异,采用层次贝叶斯模型(LDA)来分解SCZ患者大脑协同功能障碍的模式,揭示其背后的多维病理机制。
为了揭示SCZ患者异常的大脑功能组织并解开其异质性,本文依次展开三个问题:
1) 分解的信息成分是否捕捉到SCZ中的功能障碍组织?
2) SCZ中是否存在多维的功能障碍模式?
3) 不同的遗传、认知、分子和神经动态机制以及症状如何与每种功能障碍模式相关?
利用信息解析方法,本文在包含538名SCZ患者和540名正常对照(NC)的多中心fMRI数据集中,首先研究了每个个体的协同和冗余信息交互,揭示了两组间显著且一致的协同交互差异。随后,应用层次贝叶斯模型(LDA)将SCZ患者全脑协同功能障碍模式分解为三个潜在因素,解释症状异质性。通过广泛的影像转录组学分析,将因素模式与Allen人脑图谱(Allen Human Brain Atlas)的标准化基因表达数据相结合,进一步发现每个因素对应SCZ风险基因集的一部分,并揭示了每个因素的分子组织和神经生物学基础。结合来自NeuroSynth和开放分子影像数据源的数据,以及空间异质性平均场模型(pMFM),进一步展示了每个因素的独特认知、分子和神经动态相关性。
2 结果:多维度解析精神分裂症患者大脑协同功能障碍
2.1 全脑协同功能障碍
在这部分,本研究采用了一种创新的信息解析方法来分析来自538名精神分裂症(SCZ)患者和540名正常对照(NC)的静息态功能磁共振成像(fMRI)数据。这种方法允许他们构建基于区域间BOLD时间序列的个体协同和冗余交互矩阵。研究的关键发现是,与正常对照相比,SCZ患者在全脑范围内显示出协同交互的显著降低,特别是在高级认知网络如默认模式网络(DMN)和前顶叶网络(FPN)中。这种降低表明,SCZ患者的大脑区域在整合信息方面存在障碍,这可能影响复杂的认知功能。
此外,本研究还发现,尽管在不同脑区冗余交互值有所变化,但全脑平均水平的冗余交互值和功能连接(FC)值在患者和对照组之间并没有显著差异。这表明,协同交互的降低是SCZ的一个特异性特征,而不是一般性的大脑功能中断。图1通过可视化的方式展示了这些发现,包括全脑水平的比较(图1b)和不同脑区的比较(图1c, 1d及支持材料),为理解SCZ的神经生物学基础提供了新的视角。
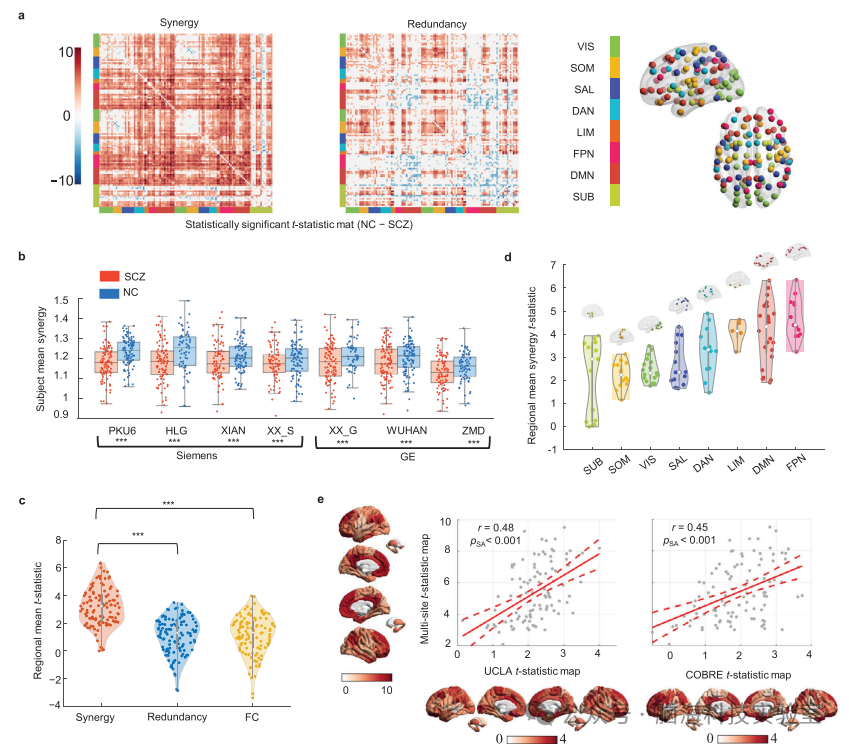
图1. SCZ中协同网络的功能障碍。a)协同和冗余交互作用的t统计矩阵显示组间的差异(NC−SCZ;538 SCZ和540 NC;未配对双侧t检验)。协同作用的大t统计值表明SCZ组的协同作用显著降低。b)比较不同站点的SCZ组和NC组之间的平均协同作用的散点盒图。左起: PKU6(p < 2.5×10−6)、HLG(p < 5.9×10−4)、XIAN(p < 2.5×10−3)、XX_S(p < 1.2×10−2)、XX_G(p < 7.9×10−3)、WUHAN(p < 4.2×10−3)和ZMD(p < 7.9×10−3),非配对双侧t检验。每个彩色的圆圈代表一个主题。框的上边界和下边界代表第一和第三个四分位数,而中位数则由框内的水平线表示。下、上胡须延伸到四分位数范围的1.5倍。尽管使用了不同的扫描仪,但SCZ组在所有独立部位均观察到协同网络功能障碍。c)三种类型的交互作用的区域平均t统计值(协同作用:平均= 3.83,s.d。= 1.8;冗余:平均= 1.33,s.d。= 1.9;功能连接:平均= 1.13,s.d。= 1.9).***表示p < 0.001;未配对的双侧t检验。d)区域协同功能障碍的不同静息状态网络特征。每个小提琴图显示了在x轴上分配给指定子网络的大脑区域的协同t统计量分布。8个典型静息状态网络的t统计值从低阶感觉运动皮质(VIS,SOM)增加到高阶关联皮质(FPN,DMN)。e)跨SCZ数据集的协同t-统计量图的稳健性。多位点数据集的结果与UCLA/COBRE数据集(UCLA,r = 0.48,pSA < 0.001;COBRE,r = 0.45,pSA < 0.001)之间存在显著相关性,表明协同功能障碍结果的稳健性。相关性分析采用皮尔逊相关性法进行分析。p值采用由BrainSMASH方法生成的空间自相关(SA)保留替代图进行估计。
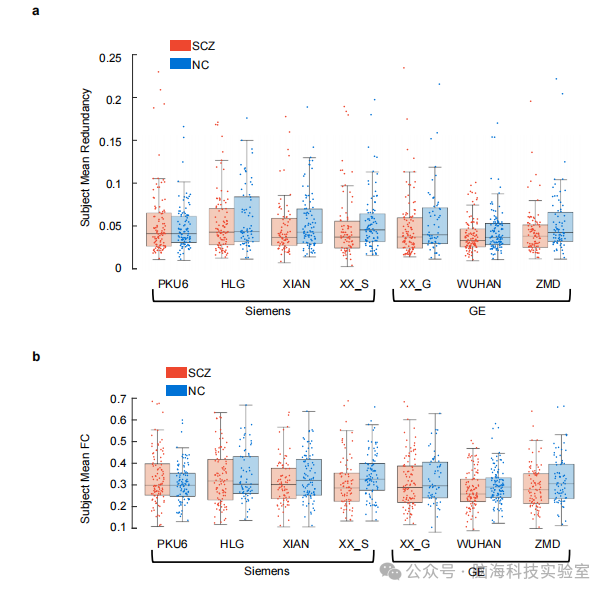
支持图片S1. 受试者平均冗余度和FC在每个站点的组间无显著差异。a)精神分裂症组(SCZ,红色)和正常对照组(NC,蓝色)在不同部位的平均冗余度的散点框图。b)精神分裂症组(SCZ,红色)和正常对照组(NC,蓝色)在不同部位的平均冗余度的散点盒图。每个彩色的圆圈代表一个主题。在方框图中,水平线表示中位数,方框的铰链表示上面和下面的第一和第三个四分位数。下须和上须是四分位数范围(IQR)的1.5倍。
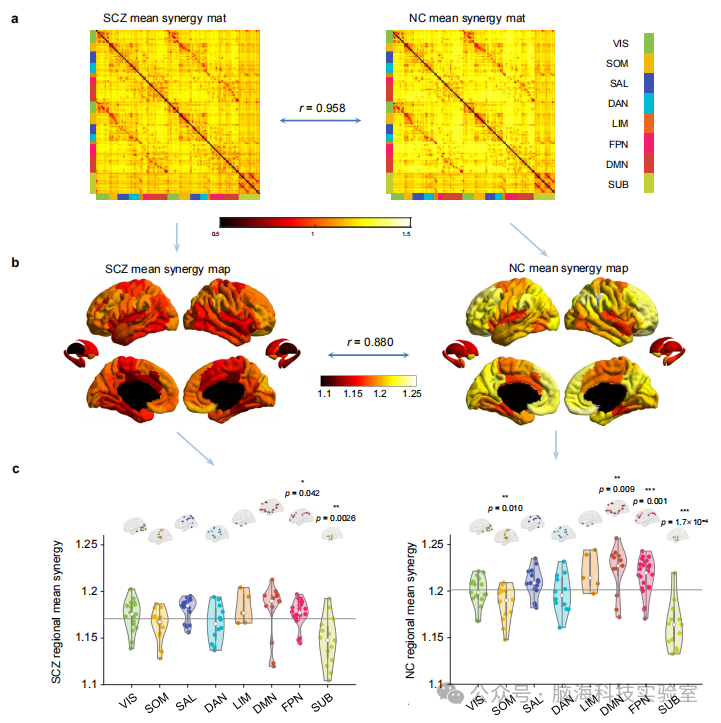
支持图片S2. 比较SCZ和NC在连接矩阵、脑区和功能网络水平上的协同作用。a) 组平均协同矩阵显示了每对大脑区域之间的协同交互作用(左: SCZ,右: NC)。与NC组相比,SCZ协同作用也表现出相似的结果(皮尔逊相关性: r = 0.958),但与NC组相比,总体上连通性模式下降。b) 脑图显示了NC SCZ组的协同矩阵计算出的区域平均协同图。SCZ协同组表现出相似(皮尔逊相关: r = 0.88),但与NC组相比,总体区域模式下降。c) 小提琴图显示了在x轴上显示的功能子网络的大脑区域的分布。白色圆圈表示中值;盒子代表上和下四分位数,须代表四分位数范围的1.5×。显著性水平用星号表示(*表示p < 0.05,**表示p < 0.01,***表示p < 0.01),通过单样本非参数排列t检验(双侧)与全脑的平均值(灰线)进行比较确定,没有对多重比较进行校正。在NC组(右)中,SOM网络(初级运动皮层;模块解离网络)的协同连接显著低于整体大脑平均水平,而FPN和DMN(高阶关联网络;模块集成网络)表现出显著更高的协同水平,符合协同作用的定义,即两个大脑区域相互依赖产生新信息。然而,在SCZ组(左)中,这种网络特异性的分化失去了意义,特别是在SOM和DMN网络中,这强调从全脑的角度检查协同因素的重要性。
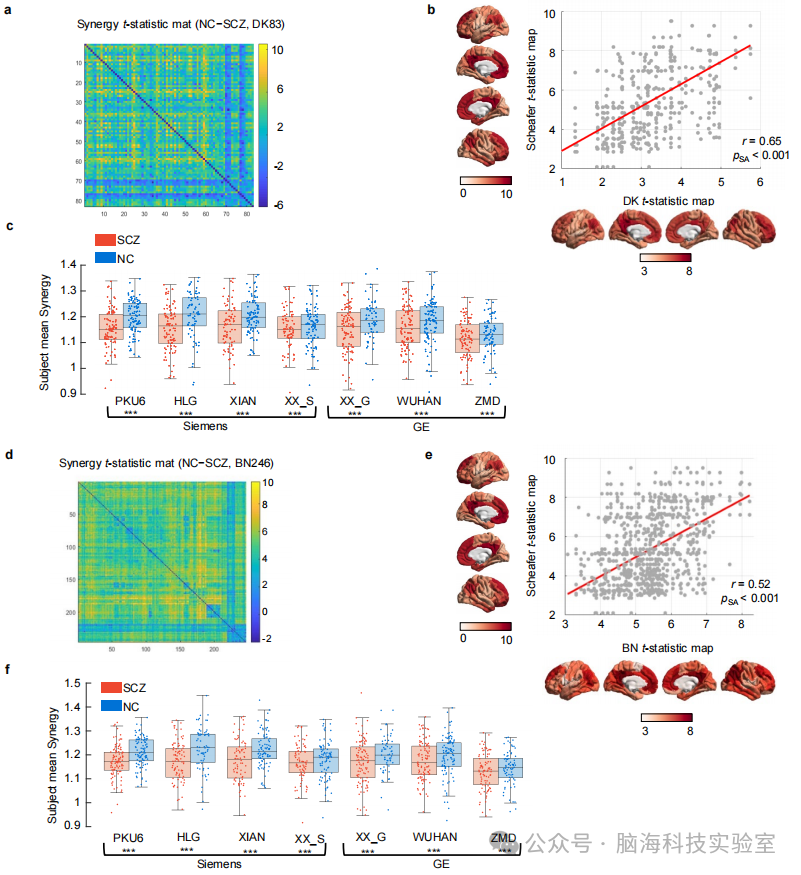
支持图片S3. 精神分裂症中的协同网络功能障碍对于脑区划分的使用具有稳健性。 a) t统计值矩阵显示了在DK-83划分中协同交互的组间差异,该划分源自Desikan-Killiany解剖图谱,包括68个皮层区域和15个皮层下区域。 b) 对DK-83划分的协同t统计图的稳健性。增强的Schaefer-115划分与DK-83划分之间的显著相关性(r = 0.65, p<0.001)强调了协同功能障碍对于不同划分方案的稳健性。 c) 使用DK-83划分在不同地点的精神分裂症组(SCZ,红色)和正常对照组(NC,蓝色)的平均协同的散点箱型图。尽管扫描设备存在差异,但在所有独立地点,精神分裂症组的协同网络功能障碍都是明显的。 d) t统计值矩阵显示了在BN-246划分中协同交互的组间差异,该划分由Brainnetome解剖图谱获得,包括210个皮层区域和36个皮层下区域。 e) 对BN-246划分的协同t统计图的稳健性。增强的Schaefer-115划分与BN-246划分之间的显著相关性(r = 0.65, p<0.001)证实了协同功能障碍对于不同划分方案的稳健性。 f) 使用DK83划分在不同地点的精神分裂症组(SZ,红色)和正常对照组(NC,蓝色)的平均协同的散点箱型图。尽管使用了不同的扫描仪进行采集,但在所有独立站点,精神分裂症组的协同网络功能障碍都是明显的。
2.2 三个协同因素
在这一节中,本研究使用层次贝叶斯模型(LDA)进一步分析了SCZ患者的全脑协同功能障碍模式。这种方法允许他们将复杂的协同交互模式分解为三个潜在因素,每个因素都与特定的脑网络和症状特征相关联。这种分解揭示了SCZ患者大脑协同功能障碍的异质性,表明不同患者可能表现出不同的协同交互模式。
因素1主要涉及亚皮层和边缘网络,与情绪处理和记忆有关。因素2与视觉皮层的交互异常有关,可能影响感知功能。因素3主要涉及皮层内交互,特别是DMN和FPN,与高级认知功能如社会认知和工作记忆相关。这些因素的发现为理解SCZ的复杂病理机制提供了新的维度,并可能有助于开发针对性的治疗方法。图2展示了三个协同因素的推断过程和它们特定的协同交互模式(图2a-d及支持材料),为理解SCZ的病理提供了新的视角。
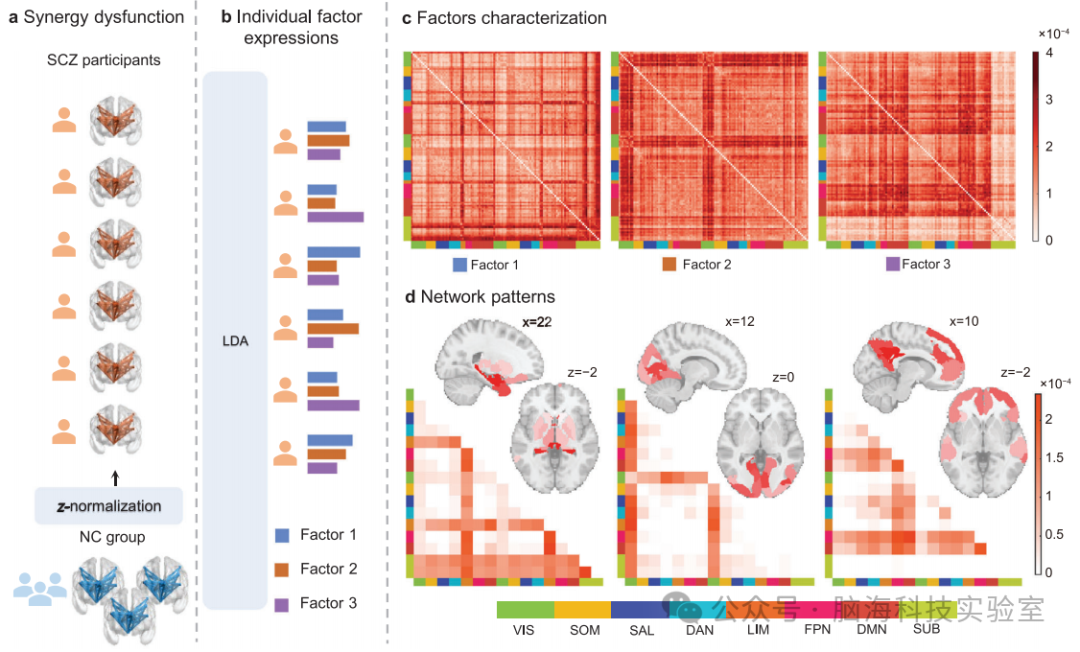
图2. 通过LDA模型推断出三个具有不同相互作用模式的协同因素。a)两组患者的全脑协同相互作用和SCZ的进行标准化。每个有SCZ的个体的协同矩阵与NC中的相应分布进行标准化。b)利用LDA模型推断出三个主要的协同因素。该模型基于SCZ患者存在多个潜在因素的假设,能够提取出具有混合隶属度特征的潜在因素。因此,每个参与者的协同交互作用的网络组织被建模为同时受到多个潜在的协同作用因素的影响。c)因素特异性的协同相互作用模式。LDA模型同时估计了与每个因素相关的相应协同模式,称为因素特异性协同模式。d)三个潜在因素的网络级协同模式,通过平均功能子网内的协同交互作用的值来计算。
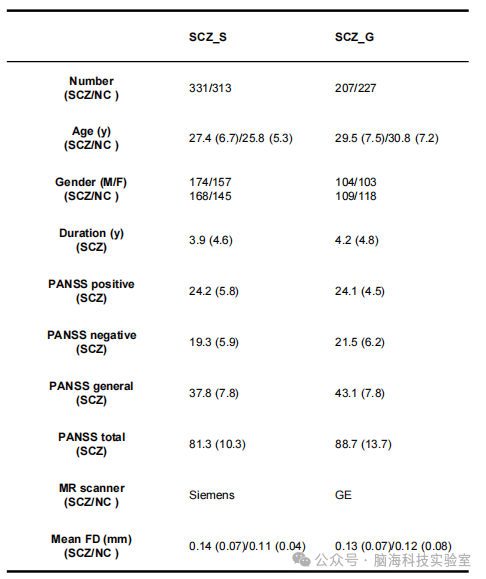
支持表格S2. 分半控制分析(half-spilt control analysis)中精神分裂症患者的人口统计学和临床特征
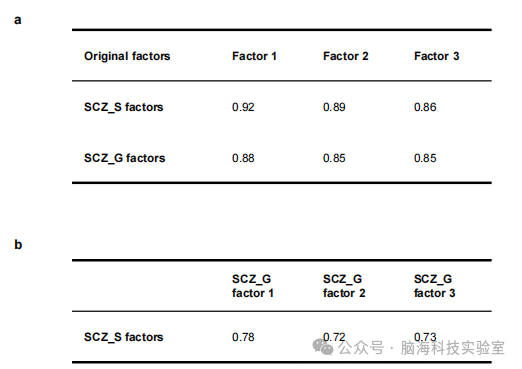
支持表格S3. 分半控制分析(half-spilt control analysis)中各因素间的相关性。a)两个半分裂样本中的潜在因素与从整个样本中推断出的因素之间的相关性。b)两个半分裂样本中的因素之间的相关性。
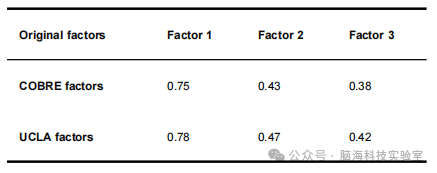
支持表格S4. 对独立数据集的控制分析。COBRE和UCLA数据集的原始因素与估计因素之间的相关性。
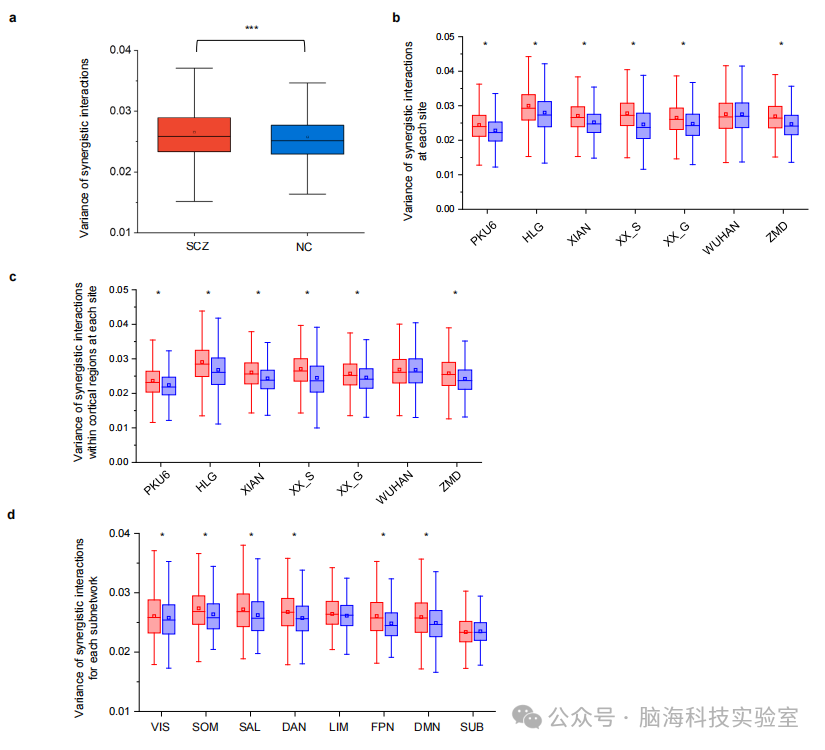
支持图片S4. 与正常对照组(NC)相比,精神分裂症组(SCZ)中的协同交互表现出显著更高的个体间差异。 a) 箱型图显示了SCZ组和NC组中协同交互分布的差异。每个点代表一个协同交互的差异。如星号所示(p<0.001;t检验),与NC组相比,SCZ组的协同交互差异显著更高。 b) 在七个研究地点中的六个,SCZ组的协同交互差异与NC组相比显著更高。星号标记的项目表示p<0.05,FDR调整。在武汉(WUHAN)地点,SCZ组的协同差异(0.269±0.055)略高于NC组(0.268±0.054),尽管没有达到显著性(p=0.57)。 c) 在七个研究地点中的六个,SCZ组与NC组相比,皮层区域内的协同交互差异显著更高,这与考虑整个大脑协同的结果一致。星号标记的项目表示p<0.05,FDR校正。在武汉(WUHAN)地点,SCZ组的协同差异(0.274±0.058)高于NC组(0.272±0.056),尽管没有达到显著性(p=0.11)。 d) 在八个网络中的六个,SCZ组与NC组相比,协同交互差异显著更高。星号标记的项目表示p<0.05,FDR校正。
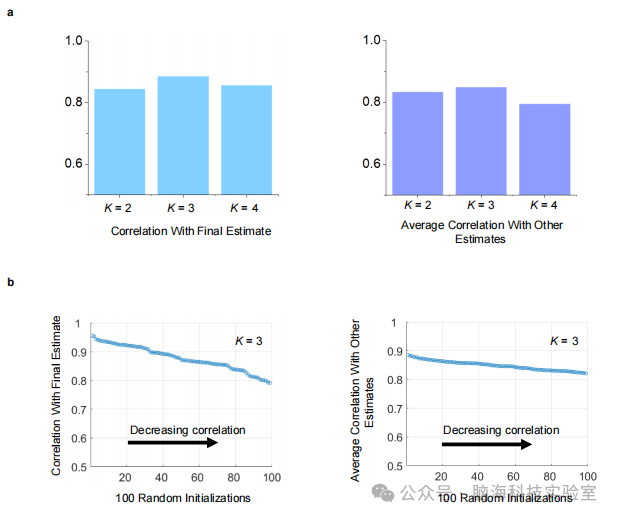
支持图片S5. 在双因素、三因素和四因素估计中,最终估计值与来自100次随机初始化的解决方案之间的相关性。 a) 我们对双因素、三因素和四因素估计进行了100次随机初始化,并选择最终估计作为每种潜在因素数量K的其他解决方案中平均相关性最高的解决方案。因素估计K=3不仅与最终估计值的相关性最高(r=0.89,左图),而且与其他估计值的平均相关性也最高(r=0.84,右图),表明三因素估计是最稳健和稳定的结果。 b) 散点图显示了与最终估计值的相关性分布(左图)以及与其他估计值的平均相关性(右图),K=3的情况。
2.3 个体水平的因素表达与精神分裂症参与者特征之间的关联
这部分研究探讨了SCZ患者表达的协同因素与他们的临床症状以及其他非临床变量之间的关联。研究发现,大多数SCZ患者在不同地点表现出多个协同因素的共同表达,表明这些因素在患者中的普遍性。通过表征相似性分析(RSA),本研究发现因素表达与PANSS症状评分显著相关,而与年龄、性别和地点等非临床变量无关。特别是,因素1与阳性症状显著正相关,而因素3与阴性症状和一般症状显著负相关。这些发现表明,协同因素可能是SCZ症状严重程度的生物学标志物。
此外,研究还发现这些因素与抗精神病药物剂量、病程和总灰质体积无关,表明它们是相对独立的生物学特征。这些结果为理解SCZ的病理生理机制提供了新的视角,并可能有助于开发新的诊断工具和治疗方法。图3通过可视化的方式展示了因素表达与参与者特征之间的关联,与其他支持材料的图表进一步证实了这些发现的稳健性。
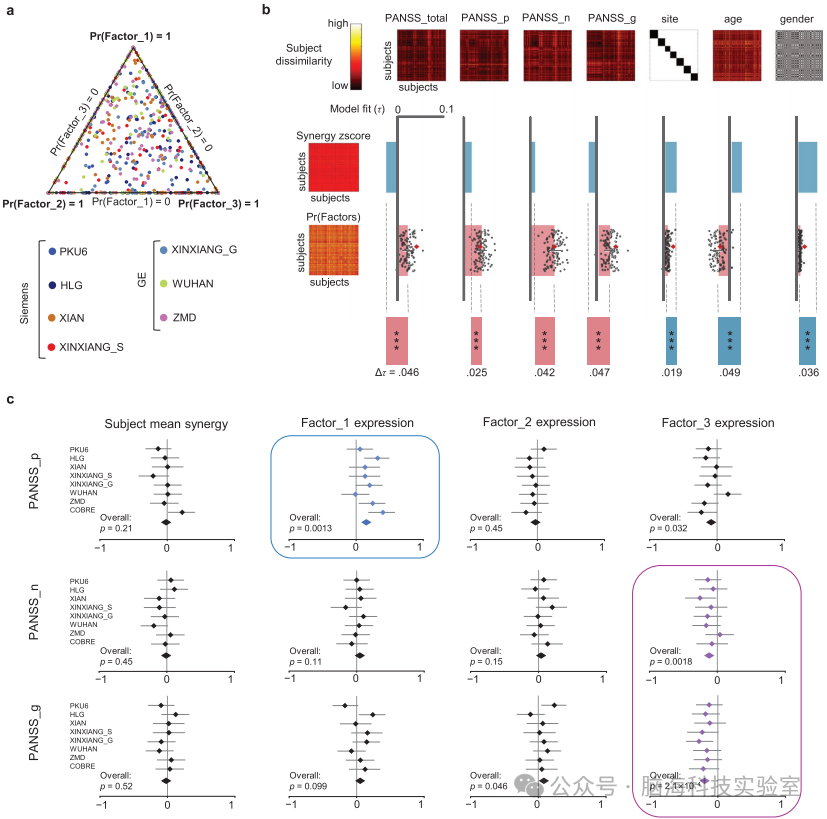
图3.因素组成与参与者特征的关联a) 多地点样本中SCZ的因素组成:每个点代表一个参与者,其在双色坐标中的位置表示该参与者的因素组成;三角形的顶点代表纯因素,靠近顶点的点表示对应因素的概率更高;边缘上的点表示两个因素的共同表达。B) 基于不同参与者特征的协同z分数和因素概率的不相似性矩阵:使用参与者之间变量的欧几里得距离计算了主题不相似性矩阵;利用肯德尔秩相关系数(Kendall τ)评估模型拟合度;红色菱形代表100次随机估计中的最终估计;从因素表达加载获得的主题不相似性矩阵与症状(PANSS)显著相关,而与性别、年龄、地点等NC和SCZ参与者共有的变量相关性显著较低;这突出了LDA在识别SCZ协同交互中症状维度方面的有效性。C) 森林图:三个PANSS子量表得分与三个因素表达加载的相关性:包括所有七个地点和COBRE数据集的森林图;报告了三个PANSS子量表得分与三个因素表达加载之间的皮尔逊相关性及其95%置信区间(CI);通过合并所有参与者计算了总体相关性;FDR多重比较校正后显著的总体相关性用蓝色和紫色框标出;结果表明因素1与PANSS阳性子量表相关,而因素3与PANSS阴性和一般子量表相关。

支持图片S6. 不同因素在年龄、性别、教育年限和头动大小的差异。在进行FDR(假发现率;q < 0.05)多重比较校正后,没有显著的成对比较结果。图中的蓝点表示因素间的估计差异,红条对应标准误差。结果进一步验证了图3中的结论,表明LDA方法减少了因素与NC(正常对照组)和SCZ(精神分裂症组)参与者共有变量之间的相关性。
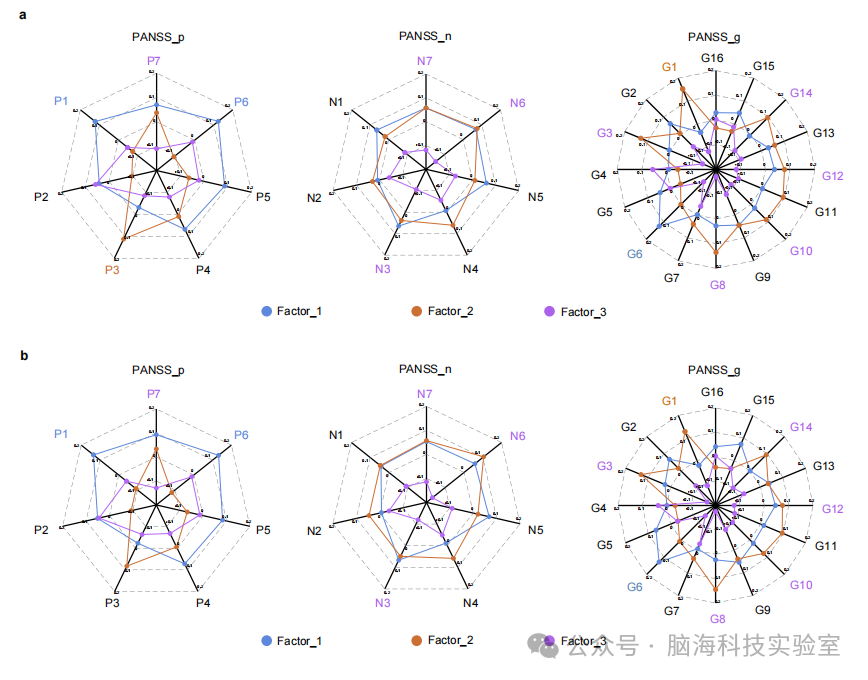
支持图片S7. 协同因素与症状之间的关联:a) 蜘蛛图展示了三个潜在因素与30个PANSS项目得分之间的皮尔逊相关性,控制变量(地点、性别、年龄)已被回归。用因素特定颜色标记的项目表示p < 0.05,FDR调整。其中,14个项目(显著多于随机值)与其中一个因素有显著相关。对于阳性子量表,蓝色线包围的区域最大,表明因素1与这些症状项目中的大多数正相关。对于阴性和一般子量表,紫色线包围的区域最小,表明因素3与这些症状项目中的大多数负相关。b) 蜘蛛图展示了在未回归控制变量的情况下,30个PANSS项目得分与三个潜在因素之间的皮尔逊相关性。
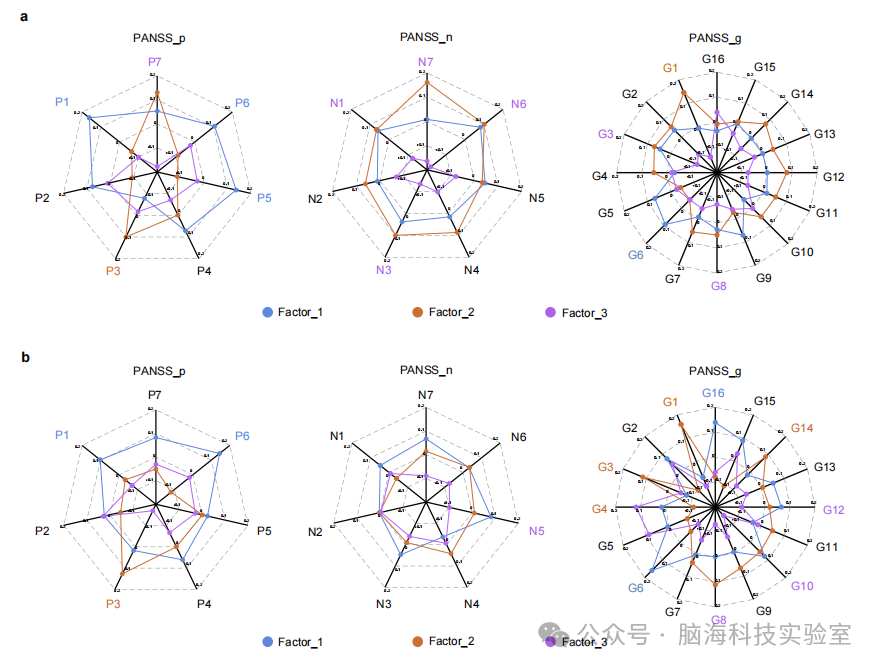
支持图片S8. SCZ协同因素与临床症状在半控制分析中的关联:a) 和 b) 蜘蛛图展示了30个PANSS项目得分与由SCZ-Siemens(N = 331;地点:PKU6、HLG、XIAN、XX_S;扫描仪:Siemens)和SCZ-GE(N = 207;地点:XX_G、WUHAN、ZMD;扫描仪:GE)推断的三个潜在因素之间的皮尔逊相关性。因素用特定颜色标记的项目表示p < 0.05,使用FDR校正。
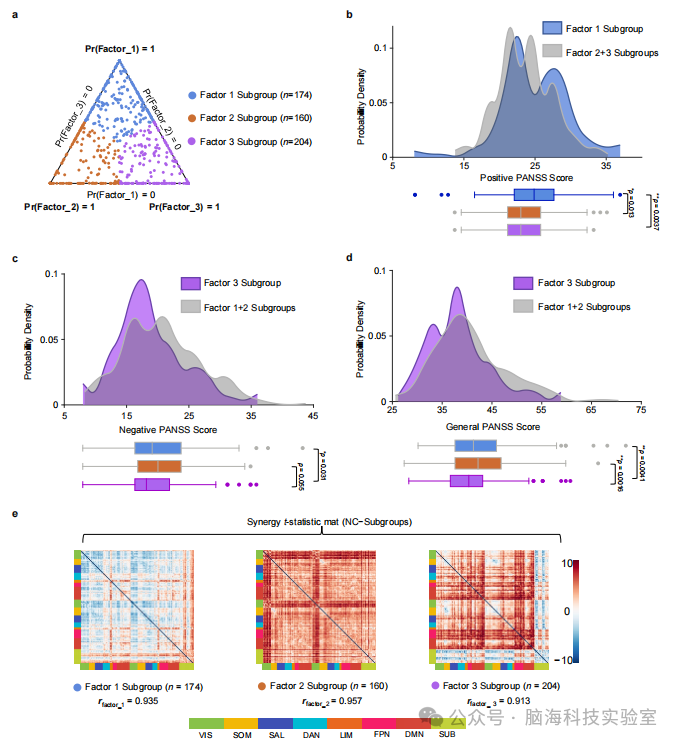
支持图片S9. 根据因素组成和PANSS评分的组间差异对三个SCZ亚组进行分层a) 每个SCZ患者根据协同因素的最高表达被分层到相应的亚组。每个点对应一个参与者,其在双色坐标中的位置表示该参与者的因素组成。b) 因素1亚组显示出显著更高的PANSS阳性得分。c) 因素3亚组显示出更低的阴性和一般PANSS得分。d) 因素3亚组显著更低的总体PANSS得分。e) 协同亚组的t统计矩阵(NC-亚组)显示出与原始协同因素相似的连接模式。
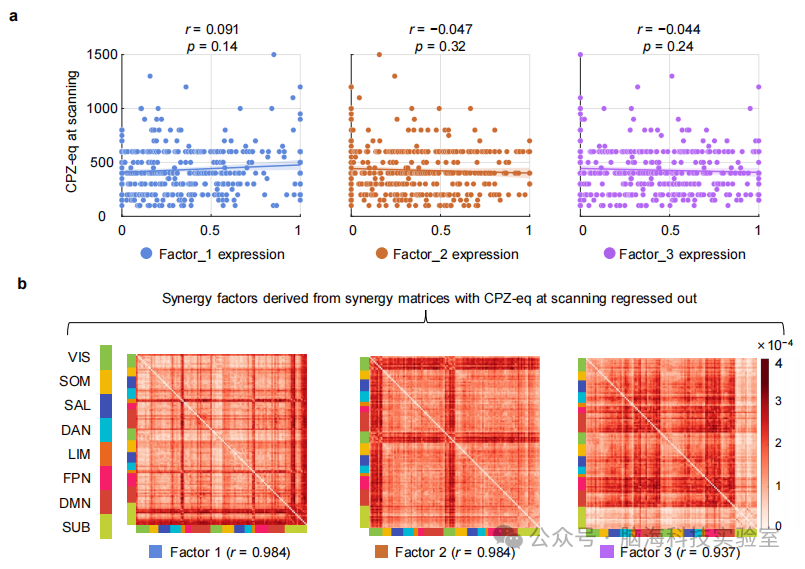
支持图片S10. SCZ协同因素与扫描时抗精神病药物的关系:a) 散点图展示了氯丙嗪(CPZ-eq)在扫描时与药物治疗的SCZ组三个因素表达之间的关联。使用皮尔逊相关性进行相关性分析。未观察到显著相关性(因素1:r = 0.091, p = 0.014; 因素2:r = -0.047, p = 0.32; 因素3:r = -0.044, p = 0.24)。b) 重新估计了CPZ-eq从每个协同交互中回归出的因素特定协同模式,用于药物SCZ组的协同矩阵。三个因素的模式与原始因素高度相关(平均皮尔逊相关性:r = 0.968)。
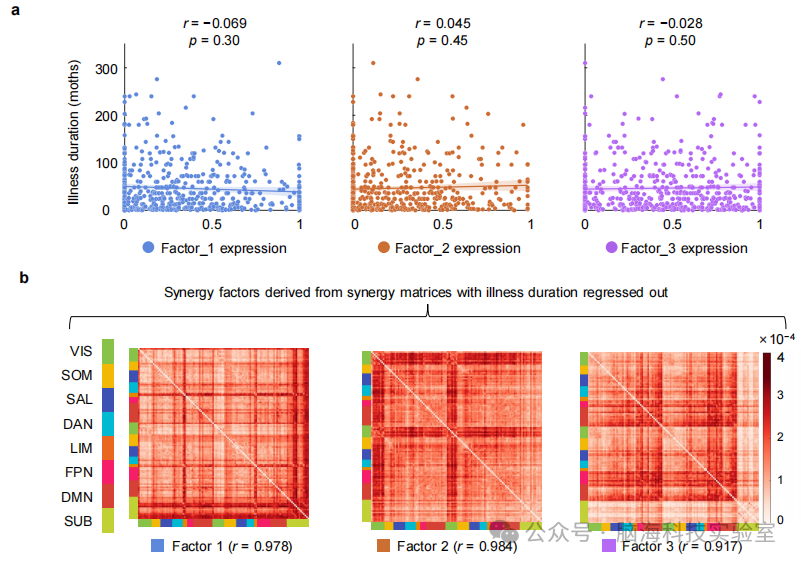
支持图片S11. SCZ协同因素与病程的关系。a) 展示了SCZ患者病程(月)与三个因素表达之间的关联散点图。使用皮尔逊相关性进行相关性分析。未观察到显著相关性(因素1:r=-0.069,p=0.30;因素2:r=0.045,p=0.45;因素3:r=-0.028,p=0.50)。b) 从SCZ患者的协同矩阵中每个协同交互中回归出病程后,重新估计因素特定的协同模式。三个因素的模式与原始因素高度相关。(平均皮尔逊相关性:r=0.961)
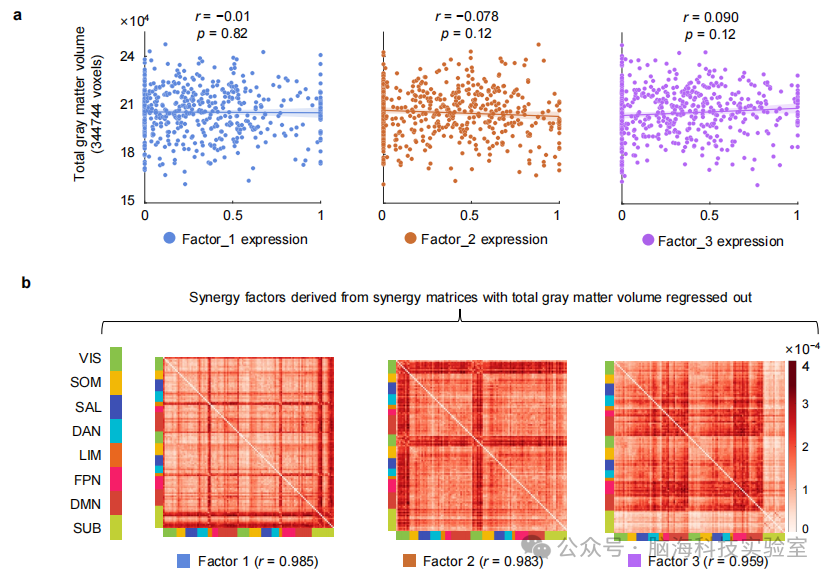
支持图片S12. SCZ协同因素与总灰质体积之间的关系。 a) 展示了SCZ组总灰质体积与三个因素表达之间的关联散点图。使用皮尔逊相关性进行相关性分析。在FDR多重比较校正后未观察到显著相关性(因素1:r = -0.01,p = 0.82;因素2:r = -0.078,p = 0.12;因素3:r = 0.09,p = 0.12)。 b) 从SCZ组协同矩阵的每个协同交互中回归出总灰质体积后,重新估计因素特定的协同模式。三个因素的模式与原始因素高度相关。(平均皮尔逊相关性:r = 0.976)
2.4 转录组关联对三个因素进行分析
在这一节中,本研究进行了转录组关联分析和基因本体(GO)富集分析,以深入了解三个协同因素背后的神经生物学机制。通过整合Allen人脑图谱的基因表达数据,研究发现与三个协同因素相关的基因集在SCZ风险基因中显著富集。因素1与神经元解剖结构和细胞过程相关,而因素3与神经递质运输和信号转导相关。这些结果表明,三个因素可能反映了SCZ患者不同的病理生物学机制。
此外,研究还发现这些因素与特定的神经递质系统有关,如因素1与多巴胺和5-羟色胺受体相关,因素3与大麻素和乙酰胆碱受体相关(支持材料图片S13、S14)。这些发现为理解SCZ的分子基础提供了新的线索,并可能有助于开发新的治疗靶点。这一部分的研究结果为理解SCZ的复杂病理机制提供了新的视角。
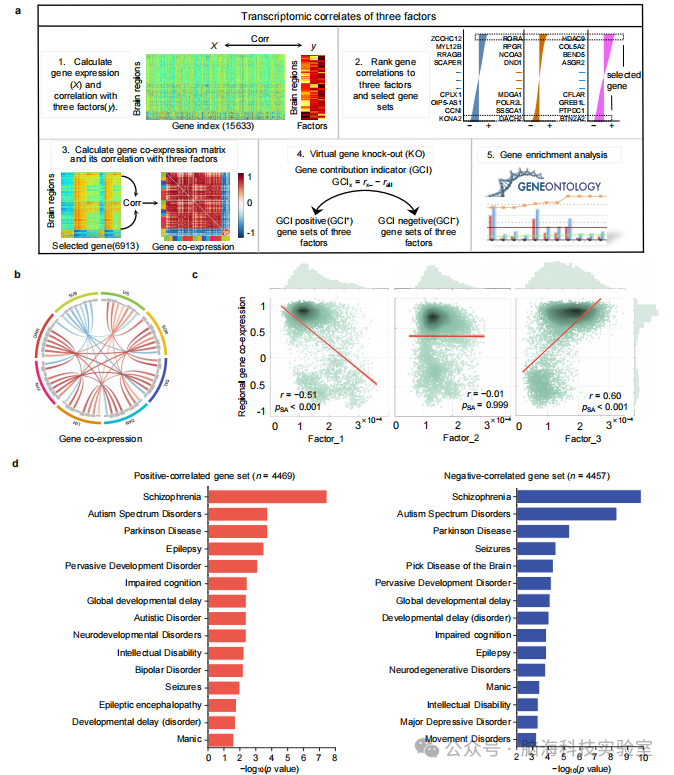
支持图片S13. 三个精神分裂症潜在因素中协同交互功能失调模式的转录组学关联。 a) 转录组学分析示意图,用于测试基因表达是否解释三个潜在因素。首先,我们计算了每个脑区(ROI)中基因表达与每个因素ROI上协同功能失调的皮尔逊相关性。其次,我们按相关系数对基因进行排序,并选择每个因素的顶部和底部10%作为因素特定的基因集。第三,我们使用选定的基因集计算基因表达相似性,并测试构建的共表达矩阵是否与潜在因素相关。此外,我们使用虚拟基因敲除(KO)方法得出GCI+和GCI-基因集的基因贡献指标(GCI)。最后,我们对每个因素的GCI+和GCI-基因集进行了GO富集分析。 b) 弦图显示了在网络中平均的基因共表达矩阵。弦的颜色强度与a.3中的颜色条相同。 c) 基因共表达与潜在因素相关。显著性通过空间自相关(SA)置换(基因表达的自旋)测试估计。 d) 条形图显示了顶部和底部10%因素特定基因集的疾病富集分析结果。条形长度表示p值(Bonferroni校正)。结果表明顶部和底部基因集在精神分裂症中最显著富集,这进一步确认了LDA推断的三个因素作为精神分裂症特异性因素。
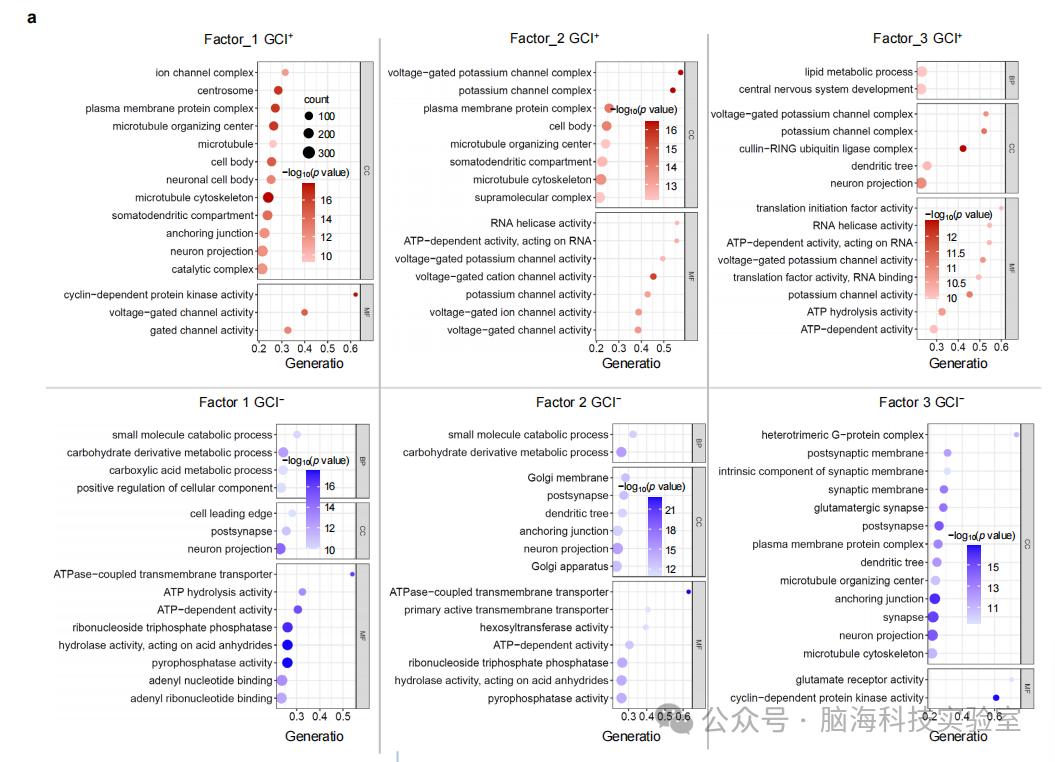
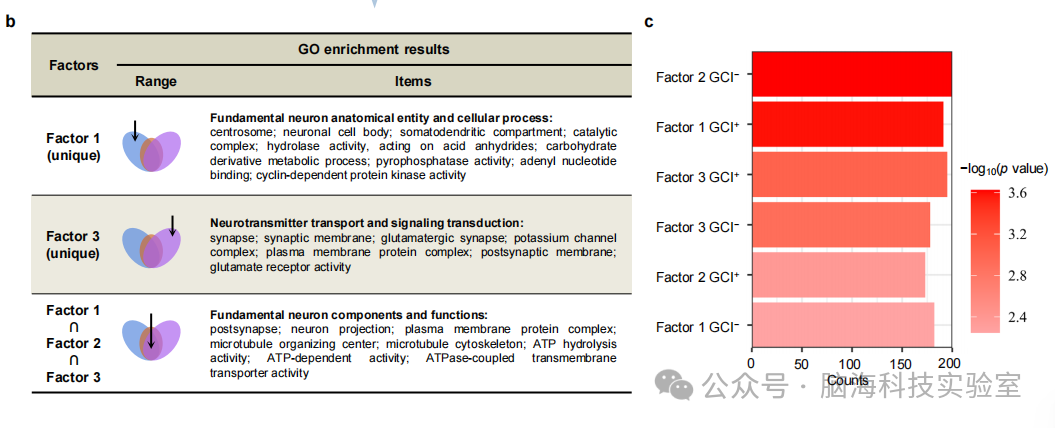
支持图片S14. 从基因角度对三个精神分裂症特异性因素的验证分析。a) 每个因素的GCI⁺和GCI⁻基因集的基因本体(GO)富集分析。显示GCI⁺(上调)和GCI⁻(下调)的GO富集前15个术语的气泡图。生物过程(BP)、细胞成分(CC)和分子功能(MF)分别显示。点的大小(计数)表示在感兴趣的GCI⁺或GCI⁻基因面板内以及特定GO术语(y轴)中的基因数量。不同的颜色强度表示p值(Bonferroni校正)。b) 因素的GO富集结果的差异和相似性。因素1和3是由于最不同的病理机制的结果。而因素2与因素1和3都有一些相似之处。c) 每个因素的6组GCI⁺和GCI⁻基因集在精神分裂症中都显著富集(Bonferroni校正)。
2.5认知、分子和神经动力学相关性
最后,在这一节中,本研究探讨了三个协同因素与认知功能、分子影像学数据和神经动力学模型的关联。通过NeuroSynth分析,因素2与视觉和多感觉处理相关,因素1与情绪和疼痛相关,因素3与社会认知和工作记忆相关。这些发现表明,不同的协同因素可能影响SCZ患者不同的认知领域。
此外,研究还发现因素2与皮层下输入相关,因素3与皮层内再入连接相关。这些结果表明,协同因素可能通过影响特定的神经回路来调节认知功能。因素1与5-羟色胺和多巴胺受体相关,因素2与μ-阿片受体负相关,因素3与大麻素和乙酰胆碱受体正相关。这些发现进一步揭示了三个因素在认知、分子和神经动力学上的独特特征,表明它们可能与SCZ的不同症状和病理机制相关。
这一部分的研究结果为理解SCZ的复杂病理机制提供了新的视角,并为未来的精准诊断和治疗提供了潜在的生物标志物。通过将认知功能、分子影像学和神经动力学数据整合到协同因素分析中,本研究能够更全面地理解SCZ的多维病理生理学。
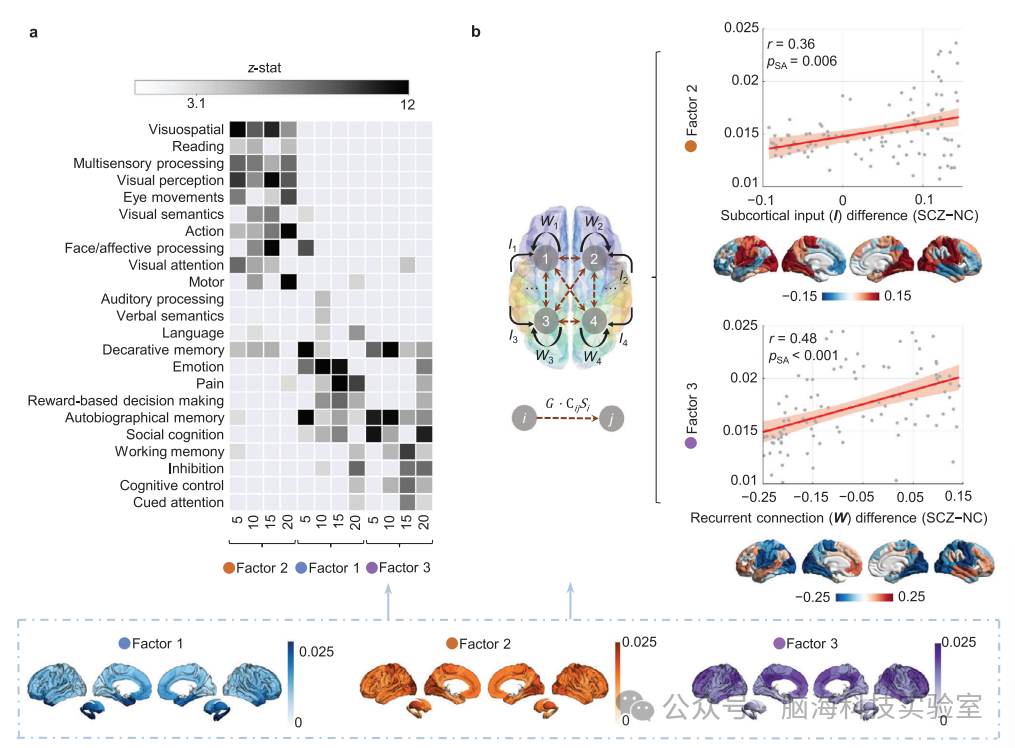
图4. 三个精神分裂症协同因素中,跨脑区的汇总的功能障碍模式的空间相关性。a) NeuroSynth基于术语的元分析。每个因素由前20% 的脑区进行特征化,揭示这三个因素对应于广泛且多样化的认知主题。b) 使用参数化的平均场模型(pMFM)模拟功能动态信号并推断区域微电路(Microcircuit)参数,特别是递归连接(W)和皮质下输入(I)。精神分裂症患者与正常对照(NC)个体之间这两种微电路(Microcircuit)参数的差异与三个因素相关,以探索它们的神经动力学机制。观察到W差异与因素3之间,以及I差异与因素2之间的显著正线性相关。空间皮尔逊相关性通过SA置换测试进行评估。
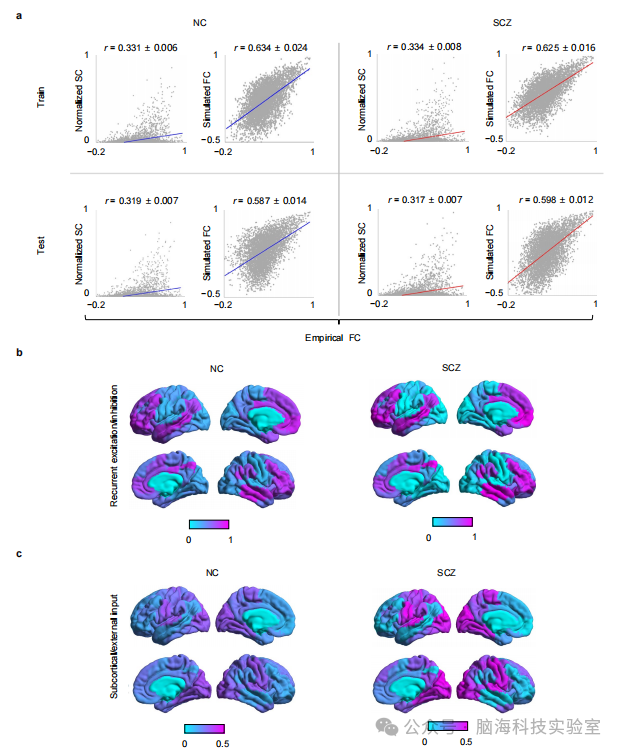
支持图片S15. 微电路(Microcircuit)参数和生物物理模拟。a) 实证功能连接(FC)和结构连接(SC)以及实证FC和模拟FC之间的线性相关性的散点图。左侧:正常对照组(NC);右侧:精神分裂症组(SZ)。上部:训练集;下部:测试集。最佳模型预测的功能连接通常高于结构(SC)和功能连接(FC)之间的相应基线相关性。b) 从pMFM推断的正常对照组(左侧)和精神分裂症组(右侧)的递归连接。c) 从pMFM推断的正常对照组(左侧)和精神分裂症组(右侧)的皮质下输入。
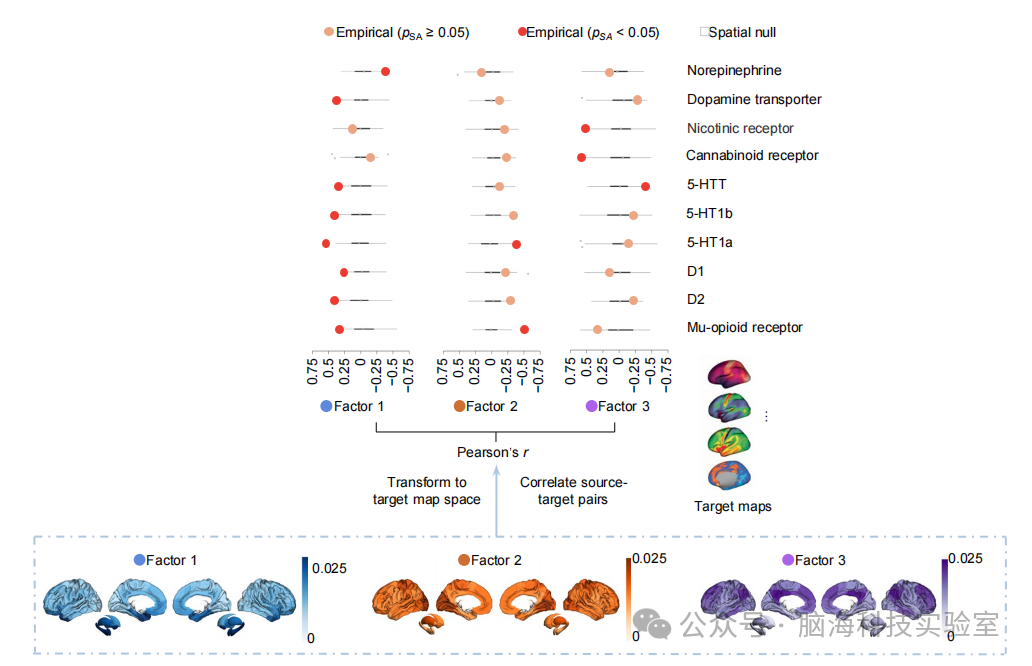
支持图片S16. 应用Neuromaps来为三个协同因素图提供上下文(contextualize)。因素图被转换为目标图的本地空间。点代表源图和目标图之间的皮尔逊相关性(显著性定义为PSA<0.05)。所有相关性都经过了多重比较校正。

支持图片S17. 使用Neuromaps为三个因素的脑图提供上下文(contextualize)。分析结合了经典的17张图,这些图提供了对神经解剖学和功能各个方面的全面见解,为研究与这三个因素的空间关联提供了深入的细节。研究结果揭示,这三个因素与最初的协同功能障碍图相比,对应于一组多样且独特的图。这一发现进一步阐明了精神分裂症的异质性,并为其发展的潜在机制提供了见解。
3. 讨论
本研究对精神分裂症(SCZ)中的信息交互作用进行了开创性和全面的调查。研究发现,SCZ患者在全脑和脑区水平上的协同作用显著减少,这种减少与认知功能中不能仅依赖于共享信息的复杂任务的损害有关。此外,研究成功地将大脑中典型的协同交互模式分解为三个可分离的因素,每个因素都显示出临床和生物学特异性。这些因素与特定的神经生物学机制相关,并与SCZ的症状特征相关联。研究结果强调了协同作用在SCZ中的关键作用,并指出将SCZ分解为三个特定因素有助于揭示该疾病的复杂性,并为理解其病理生理机制提供了新的证据。
4. 结论
本研究揭示了SCZ患者中协同作用的广泛减少,这些异常模式表现出相当大的异质性,可以进一步表征为三种不同的潜在因素模式。每位患者不同程度地表达了不同的因素,每个因素都与临床症状特征和神经生物学基础特定地对齐。我们的发现强调了协同作用的关键作用,而将SCZ分解为三个特定因素有助于解开该疾病的复杂性,并为理解其病理生理机制提供了新的证据,这些发现可能对未来的诊断和治疗策略有所裨益。
5. 实验部分
研究包括538名SCZ患者和540名正常对照组(NC)参与者,数据来自六个医院的七个地点。所有参与者都经过了质量控制措施,并且提供了知情同意。研究使用3T西门子或3T GE扫描仪收集了静息态fMRI数据、T1加权数据和DTI数据。
研究步骤包括:
1. MRI数据采集:使用统一的扫描协议以避免不同扫描参数带来的混淆。
2. 数据预处理:包括时间层校正、头动校正、空间标准化、去除混杂因素以及带通滤波等。
3. 脑区划分:使用“Schaefer-115”脑区划分法,包括100个皮层和15个皮层下区域。
4. 功能连接性(FC)计算:计算区域间fMRI时间序列对的皮尔逊相关性,得到每个参与者的115×115 FC矩阵。
5. 协同和冗余的推断:使用集成信息分解方法来计算脑区间的协同和冗余交互作用。
6. 潜在因素推断:应用层次贝叶斯潜在狄利克雷分配(LDA)模型来推断潜在因素。
7. 神经影像学-临床关联分析:探索LDA分解的协同因素组成与参与者的非临床和临床特征之间的关联。
8. 神经影像学-转录组关联分析:使用艾伦人脑图谱数据集来探索每个因素背后的潜在机制。
9. 微观尺度神经动态建模:使用参数化平均场模型(pMFM)模拟功能动态信号,并推断皮层区域的微观电路参数。
10. PET和SPECT数据的空间相关性分析:使用Neuromaps工具箱定量评估三个因素的分子和功能富集。
11. 控制分析:进行一系列控制分析以确保发现的稳健性和有效性。
12. 统计分析:使用各种统计测试来全面评估“Schaefer-115”图的空间相关性。
整个实验部分详细说明了研究的设计、数据收集、处理和分析方法,以及如何验证和解释发现。这项研究为理解SCZ中的协同功能障碍提供了一种多模态且多尺度的方法。
END
参考文献:
Ding, C., Li, A., Xie, S., Tian, X., Li, K., Fan, L., Yan, H., Chen, J., Chen, Y., Wang, H., Guo, H., Yang, Y., Lv, L., Wang, H., Zhang, H., Lu, L., Zhang, D., Zhang, Z., Wang, M., Jiang, T., … Liu, B. (2024). Mapping Brain Synergy Dysfunction in Schizophrenia: Understanding Individual Differences and Underlying Molecular Mechanisms. Advanced science (Weinheim, Baden-Wurttemberg, Germany), 11(32), e2400929. https://doi.org/10.1002/advs.202400929
